急性主动脉夹层(acute aortic dissection,AAD)是危及生命的主动脉急症。通常其起病前并无明显预兆;起病后若不予治疗,33%的患者于起病后24 h内死亡,50%的患者起病后48 h内死亡,2周内死亡患者达75%,3个月后仅10%的患者仍存活[1]。在美国,有报道其发病率为(3~4)/10万[2],但考虑到大部分患者起病后短时间内死亡而未明确诊断,其真实发病率可能被低估。目前已明确某些基因的变异可增加个体AAD的易感性,如Marchesani综合征、Loeys-Dietz综合征、Ehlers-Danlos综合征、Turner综合征、主动脉瓣二叶畸形、其它不明原因的家族遗传性AAD,但以上病因引起的AAD仅占全部AAD患者的10%左右,仍有大量AAD病例起病原因不明。
细胞外基质(extracellular matrix,ECM)非结构糖蛋白肌腱蛋白-C(tenascin-C,TnC)最先发现于1985年[3],其在胚胎发育、组织重构过程中广泛表达[4]。近来有研究报道AAD患者血液中TnC水平显著上升[5],并且在小鼠中其表达缺失可促成AAD的发生[6]。本文总结了TnC在AAD发生与发展过程中扮演的角色和作用。
1 TnC结构TnC属于ECM肌腱蛋白家族,在胚胎期的心脏中广泛表达,包括心肌、瓣膜、冠脉等处均可检测到表达,出生后其表达迅速下降,仅在细胞更新活跃与机械压力承受区组织处可检测到,但当组织发生炎症反应、癌变时其表达显著上调[4]。TnC由6条多肽链聚合而成,每条多肽链氮端至碳端包括肌腱蛋白聚合区(tenascin assembly damain,TA)、表皮生长因子(epidermal growth factor like repeats,EGF)类似重复、纤连蛋白Ⅲ(fibronection like repeats,FNⅢ)类似重复、纤维蛋白原(fibriogen,FG)类似区共4个部分,其中TA可能与TnC在细胞内的组装有关,EGF类似重复参与介导细胞趋化与粘附,FNⅢ类似重复有多样的氨基酸序列并且可与多种配体结合,FG类似区是可与Toll样受体-4(Toll-like receptor-4,TLR-4)结合的内源性配体[7]。由于FNⅢ类似重复区的mRNA前体存在一个剪切易变区,TnC存在一系列分子量不同的亚型[8]。已知TnC在心血管系统中的功能包括抗细胞粘附、上调基质金属蛋白酶(matrix metalloproteinase,MMP)表达、调控炎症反应、促进平滑肌细胞表型转化、促进纤维化等作用[9]。
2 机械压力与TnC在封闭式循环系统中,主动脉作为弹性储器在心脏射血期扩张存储能量,在非射血期释放能量以维持血液在管道中持续流动。主动脉壁的三层结构与其上述功能相适应,包括由内皮及内皮下层组成的内膜,由血管平滑肌细胞(vascular smooth muscle cell,VSMC)与有孔弹性纤维膜组成的中膜,以及由肌成纤维细胞及其产生的富含胶原ECM组成的外膜。主动脉壁中膜是行驶主动脉弹性储器功能的主要结构[10]。当血压持续升高时,正常主动脉可通过自身结构重塑适应管腔内压力改变;但如果某些原因使血管壁结构与所承受压力不相匹配,AAD可能发生。TnC在正常主动脉结构中的表达与承受的机械压力相关,Mackie等[11]报道在承受压力较高的动脉血管分叉处检测到TnC表达明显高于周围区域;Kimura等[6]报道在AAD小鼠模型中主动脉内压力变化率(dp/dt)高的部位TnC表达显著上调;Chiquet等[12]发现机械压力引起的牵拉可通过纤维母细胞RhoA/ROCK信号通路介导TnC表达;Xu等[13]则发现反复机械牵拉人类骨髓间充质干细胞可导致TnC表达上调。上述研究均提示TnC的表达与机械力的作用相关。
3 TnC与AAD 3.1 TnC与小鼠AAD模型Kimura等[6]通过向10~14周龄小鼠肾动脉以下腹主动脉周围注射CaCl2使其硬化,同时植入胶囊渗透压泵持续泵入血管紧张素Ⅱ(AngⅡ)来制作AAD模型。接受此处理的小鼠包括野生型小鼠(wild type,WT)和TnC基因敲除(TnC knockout,TnC-KO)小鼠。虽然TnC-KO鼠的循环系统发育相较WT鼠无明显异常,但接受CaCl2+AngⅡ处理1周后的TnC-KO鼠其胸主动脉内径与dp/dt均显著上升,并且在未硬化的肾动脉以上主动脉段发生了AAD,其AAD发生率较WT鼠、单纯CaCl2处理鼠(WT鼠与TnC-KO鼠)、单纯AngⅡ处理鼠(WT鼠与TnC-KO鼠)显著增高。
3.2 TnC在AAD中的作用Trescher等[14]报道较之主动脉瘤(aortic aneurysm,AA)及主动脉瓣置换患者,AAD患者中主动脉壁中TnC的分布范围更广、表达更高,并且伴随周围血液中TnC水平上升。这提示TnC参与了AAD的发生发展过程。
TnC维持主动脉壁VSMC的正常生理功能。VSMC适度表型转化参与了ECM及弹性膜的构建以及受损组织的修复,是血管壁维持正常生物学性能的必要条件[15]。Ishigaki等[16]报道小鼠VSMC接受PDGF-BB刺激时,TnC可通过上调整合素αvβ3增强PDGF信号通路从而促进VSMC由收缩型向合成型转化,增强其分裂增殖与合成能力;而在无PDGF-BB刺激时,TnC对于VSMC的表型转化则无影响。Kimura等[6]发现在AAD发生前TnC-KO鼠肾动脉以上平面VSMC功能紊乱,其编码ECM蛋白基因如编码弹性蛋白基因、胶原纤维基因、原纤维蛋白基因等表达受损,而炎症相关基因如编码白介素6(IL-6)基因、血浆炎性趋化因子(CCL-2)基因表达显著上调[4]。这些结果说明TnC在维持主动脉壁VSMC正常功能方面发挥重要作用。
TnC维持ECM正常结构。AAD的发生伴随着主动脉壁中层弹性膜性能退化、层数减少,胶原纤维、弹性纤维断裂,以及一系列ECM改变。Scherer等[17]报道正常人主动脉VSMC在受到压力刺激时TnC合成显著增多。Kirsch等[18]报道在MMP过表达的组织中TnC可促使合成型VSMC凋亡以降低MMP表达,而MMP的过度表达是主动脉壁中层结构破坏的主要原因[19]。Bobik[20]报道TnC表达缺失可抑制VSMC中TGF-β信号通路进而使ECM合成减少并影响主动脉壁机械性能。
TnC抑制了AAD时主动脉壁的炎症反应。炎症反应在AAD的发生中扮演重要角色,机械压力可影响炎症介质的产生[21]。Tieu等[22]报道ANGⅡ可通过上调主动脉壁成纤维细胞IL-6表达诱导巨噬细胞浸润主动脉壁并高表达巨噬细胞诱导因子MCP-1,造成炎症反应过度、ECM重构,最终导致AAD发生。Ikeshima-Kataoka等[23]报道在小鼠的TnC-KO脑损伤模型中发现IL-6高于WT鼠;Golledge等[7]则发现TnC可抑制T细胞的活化与增值;TnC-KO鼠α平滑肌肌动蛋白(smooth muscle α-actin,SMα)标记阴性细胞中大部分为CD45标记阳性的炎症细胞并且其NF-κB与Stat3通路均被激活,这些通路的激活增强了炎症反应;同时TGF-β信号通路下游的Smad2的表达下调[4],TGF-β通路的抑制可导致VSMC向合成型转化并分泌炎症因子[24]。
综上所述,可推测在主动脉ECM中,TnC为一种对主动脉壁有保护作用的压力反应性蛋白,在通常情况下处于低表达状态,但当主动脉壁承受的机械压力增高时其表达上调。TnC通过调整ECM结构、调节VSMC功能来加强主动脉壁机械性能,同时抑制过度的炎症反应,最终使主动脉壁的机械性能与所承受压力相适应,避免AAD发生(图1)。
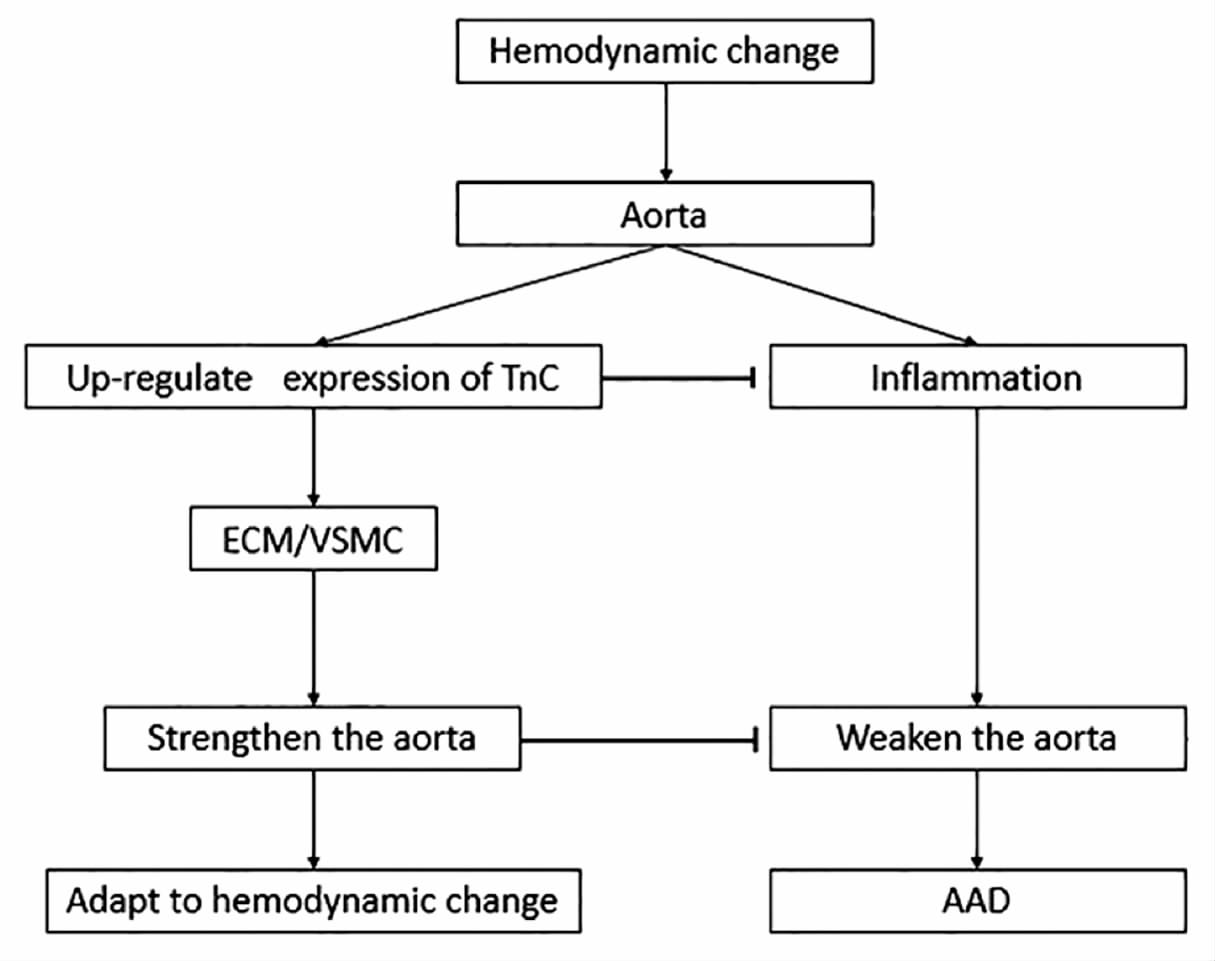
|
图 1 TnC对主动脉的保护作用示意图 Fig 1 Diagram of TnC-mediated protection of the aorta Aortic stress induces TnC expression,which in turn protects the aorta by modulating ECM structure,regulating vascular smooth muscle cell phenotype switch and suppressing the excessive proinflammatory response(↓: Positive impact; ⊥: Negative impact). TnC: tenascin-C; AAD: Aucte aortic dissection; ECM: Extracelluar matrix; VSMC: Vascular smooth muscle cell |
TnC可能是AAD发生过程中的关键分子;但TnC对主动脉壁不同细胞的迁移渗透、凋亡存活、增殖的影响,以及血流动力学变化是如何被感知并影响TnC表达等问题仍待阐明。同时,目前使用的TnC-KO小鼠AAD模型不能很好的模拟人AAD的特性,如:人AAD多为纵向撕裂而小鼠AAD多为横向撕裂,小鼠AAD模型中主动脉弓部TnC表达较低等。此外有报道多种蛋白可在机械压力刺激下表达上调[25],这些蛋白与TnC的关系及是否参与了AAD的发生亦无定论。TnC在AAD发生发展过程中的作用仍需进一步探究。
| [1] | De Leon Ayala I A, Chen Y F. Acute aortic dissection: an update[J]. Kaohsiung J Med Sci, 2012, 28: 299-305. |
| [2] | LeMaire S A, Russell L. Epidemiology of thoracic aortic dissection[J]. Nat Rev Cardiol, 2011, 8: 103-113. |
| [3] | Grumet M, Hoffman S, Gassin K L, Edelman G M. Cytotactin, an extracellular matrix protein of neural and non-neural tissues that mediates glia-neuron interaction[J]. Proc Natl Acad Sci USA, 1985, 82: 8075-8079. |
| [4] | Chiquet-Ehrismann R, Orend G, Chiquet M, Tucker R P, Midwood K S. Tenascins in stem cell niches[J]. Matrix Biol, 2014, 37: 112-123. |
| [5] | Nozato T, Sato A, Hirose S, Hikita H, Takahashi A, Endo H, et al. Preliminary study of serum tenascin-C levels as a diagnostic or prognostic biomarker of type B acute aortic dissection[J]. Int J Cardiol, 2013, 168: 4267-4269. |
| [6] | Kimura T, Shiraishi K, Furusho A, Ito S, Hirakata S, Nishida N,et al. Tenascin C protects aorta from acute dissection in mice[J]. Sci Rep,2014,4:4051. |
| [7] | Golledge J, Clancy P, Maguire J, Lincz L, Koblar S. The role of tenascin C in cardiovascular disease[J]. Cardiovasc Res, 2011, 92: 19-28. |
| [8] | Giblin S P, Midwood K S. Tenascin-C: form versus function[J]. Cell Adh Migr, 2015,9(1-2):48-82. |
| [9] | Imanaka-Yoshida K. Tenascin-C in cardiovascular tissue remodeling: from development to inflammation and repair[J]. Circ J, 2012, 76: 2513-2520. |
| [10] | Wagenseil J E, Mecham R P. Vascular extracellular matrix and arterial mechanics[J]. Physiol Rev, 2009, 89: 957-989. |
| [11] | Mackie E J, Scott-Burden T, Hahn A W, Kern F, Bernhardt J, Regenass S, et al. Expression of tenascin by vascular smooth muscle cells. Alterations in hypertensive rats and stimulation by angiotensin Ⅱ[J]. Am J Pathol, 1992, 141: 377-388. |
| [12] | Chiquet M, Tunc-Civelek V, Sarasa-Renedo A. Gene regulation by mechanotransduction in fibroblasts[J]. Appl Physiol Nutr Metab, 2007, 32: 967-973. |
| [13] | Xu B, Song G, Ju Y, Li X, Song Y, Watanabe S. RhoA/ROCK, cytoskeletal dynamics, and focal adhesion kinase are required for mechanical stretch-induced tenogenic differentiation of human mesenchymal stem cells[J]. J Cell Physiol, 2012, 227: 2722-2729. |
| [14] | Trescher K, Thometich B, Demyanets S, Kassal H, Sedivy R, Bittner R, et al. Type A dissection and chronic dilatation: tenascin-C as a key factor in destabilization of the aortic wall[J]. Interact Cardiovasc Thorac Surg, 2013, 17: 365-370. |
| [15] | Shi N, Chen S Y. Mechanisms simultaneously regulate smooth muscle proliferation and differentiation[J]. J Biomed Res, 2014, 28: 40-46. |
| [16] | Ishigaki T, Imanaka-Yoshida K, Shimojo N, Matsushima S, Taki W, Yoshida T. Tenascin-C enhances crosstalk signaling of integrin αvβ3/PDGFR-β complex by SRC recruitment promoting PDGF-induced proliferation and migration in smooth muscle cells[J]. J Cell Physiol, 2011, 226: 2617-2624. |
| [17] | Scherer C, Pfisterer L, Wagner A H, Hodebeck M, Cattaruzza M, Hecker M, et al. Arterial wall stress controls NFAT5 activity in vascular smooth muscle cells[J]. J Am Heart Assoc, 2014, 3: e000626. |
| [18] | Kirsch E W, Radu N C, Gervais M, Allaire E, Loisance D Y. Heterogeneity in the remodeling of aneurysms of the ascending aorta with tricuspid aortic valves[J]. J Thorac Cardiovasc Surg, 2006, 132: 1010-1016. |
| [19] | Wang L, Zhang J, Fu W, Guo D, Jiang J, Wang Y. Association of smooth muscle cell phenotypes with extracellular matrix disorders in thoracic aortic dissection[J]. J Vasc Surg, 2012, 56: 1698-1709. |
| [20] | Bobik A. Transforming growth factor-betas and vascular disorders[J]. Arterioscler Thromb Vasc Biol, 2006, 26: 1712-1720. |
| [21] | Wang J H, Thampatty B P. Mechanobiology of adult and stem cells[J]. Int Rev Cell Mol Biol, 2008, 271: 301-346. |
| [22] | Tieu B C, Lee C, Sun H, Lejeune W, Recinos A 3rd, Ju X,et al. An adventitial IL-6/MCP1 amplification loop accelerates macrophage-mediated vascular inflammation leading to aortic dissection in mice[J]. J Clin Invest, 2009, 119: 3637-3651. |
| [23] | Ikeshima-Kataoka H, Shen J S, Eto Y, Saito S, Yuasa S. Alteration of inflammatory cytokine production in the injured central nervous system of tenascin-deficient mice[J]. In Vivo, 2008, 22: 409-413. |
| [24] | Deaton R A, Su C, Valencia T G, Grant S R. Transforming growth factor-beta1-induced expression of smooth muscle marker genes involves activation of PKN and p38 MAPK[J]. J Biol Chem, 2005, 280: 31172-31181. |
| [25] | Imanaka-Yoshida K, Aoki H. Tenascin-C and mechanotransduction in the development and diseases of cardiovascular system[J]. Front Physiol, 2014, 5: 283. |
 2015, Vol. 36
2015, Vol. 36


