随着固定矫治技术的不断进步,错颌畸形患者存在的美观及功能问题得到有效解决,随之也出现了一些并发症,如釉质脱矿[1]、牙龈炎及牙周疾病[2, 3, 4]等。牙釉质脱矿是固定矫治过程中最常见的并发症之一,托槽周围釉质脱矿的发病率从2%~97%不等[5, 6, 7]。托槽周围菌斑形成是导致釉质脱矿的主要原因,因此,控制托槽周围菌斑形成是预防釉质脱矿的关键。纳米TiO2具有良好的光催化性能,被广泛应用于大气净化、除臭、净水、防雾、自清洁等各个方面[8]。Shu等[9]和Shah等[10]在托槽表面制备了TiO2薄膜,体外抗菌实验结果均显示,在紫外光作用下,对口腔主要致龋菌具有良好的抗菌性。本课题组通过射频磁控溅射法在不锈钢金属托槽表面成功制备了TiO2-xNx薄膜,该薄膜在可见光下对嗜酸乳杆菌及白假丝酵母菌具有良好的抗菌性能[11]。
尽管TiO2-xNx薄膜托槽的体外抗菌实验取得了良好的结果,但临床应用前的安全性评价不可或缺,而且有关纳米TiO2-xNx薄膜的生物相容性研究鲜有报道。因此,本实验通过TiO2-xNx薄膜托槽的体外生物相容性实验,评价TiO2-xNx薄膜对小鼠成纤维细胞L929的毒性效应,探讨掺氮含量与薄膜厚度因素对L929细胞黏附、增殖、凋亡的影响,为TiO2-xNx薄膜托槽的临床应用提供依据。
1 材料和方法 1.1 TiO2-xNx薄膜托槽试样的制备及表征采用MBT直丝弓金属托槽原材料316L不锈钢作为基材,将其制备成直径为8 mm、厚度为1 mm的试样,于99.5%丙酮、99%乙醇、去离子水中分别超声清洗30 min,干燥后备用。
利用JZCK-580高真空多功能磁控溅射设备在试样表面沉积不同掺氮含量和不同薄膜厚度的TiO2-xNx薄膜。不同氮含量组为通入氩气和氮气两种气体,氩/氮气体流量比分别设定为30:1(N1组)、30:1.5(N2组)、30:2(N3组),溅射相同的时间180 min;不同厚度组为在相同的氩/氮气体流量比(30:1)的条件下,分别溅射30(T1组)、60(T2组)、90(T3组) min。将制备好的TiO2-xNx薄膜放入含氮气的高温管式炉中进行退火,退火温度为450℃。
采用Riguku D/MAX-2400型X射线衍射仪、扫描电子显微镜(SEM,日立S4800,日本JEOL公司)分别对TiO2-xNx薄膜的晶相和表面形貌进行表征,并采用椭偏仪(L116,美国Gaertner公司)测量不同厚度组TiO2-xNx薄膜的厚度。
将不锈钢金属基片(对照组)和3组不同掺氮含量的TiO2-xNx薄膜试样和(或)3组不同厚度的TiO2-xNx薄膜试样在去离子水中超声清洗20 min,然后用75%乙醇浸泡15 min,去离子水冲洗,自然干燥后在121℃下高温高压灭菌30 min,备用。
1.2 L929小鼠成纤维细胞的培养、传代与接种小鼠成纤维细胞L929(购自中国科学院典型培养物保藏委员会细胞库)复苏后常规接种于含体积分数为10%胎牛血清的RPMI 1640培养液(含青霉素100 IU/mL,链霉素100 μg/mL)中,置于5%CO2、37℃饱和湿度的孵箱中培养,隔天换液,待细胞长至85%~90%时传代,第3代细胞用于实验。
将灭菌后的TiO2-xNx薄膜托槽试样分别置于48孔培养板(NY14831,Corning,USA)中,并分别设置为对照组(SS组)、薄膜托槽组[N1组(30:1)、N2组(30:1.5)、N3组(30:2)]/[T1组(30 min)、T2组(60 min)、T3组(90 min)]和阴性对照组(聚苯乙烯培养板),每组设3个复孔。然后将传至第3代的L929细胞(2.5×104/mL)接种于试样表面,每孔350 μL,放置于孵箱培养相应的时间。
1.3 细胞黏附实验观察细胞附着形态L929细胞培养24 h后,将试样取出,PBS冲洗3次,室温下以3%的戊二醛固定4 h后,使用30%、40%、50%、60%、70%、80%、90%、100%的梯度乙醇依次脱水10 min,1%锇酸固定4 h,真空冷冻干燥12 h,表面喷金,扫描电镜下观察细胞附着形态。
1.4 MTT实验测定细胞相对增殖率L929细胞分别培养24、48、72 h后,每孔添加MTT溶液35 μL,继续培养4 h后,每孔加入350 μL SDS溶液,充分震荡,溶解过夜,采用酶标仪在570 nm波长处测定各孔的光密度(D)值。实验重复3次,计算细胞相对增殖率,求得平均值。
1.5 乳酸脱氢酶(LDH)实验测定活性L929细胞分别培养24 h和72 h,收集细胞培养液,在55.5×g的离心力条件下离心10 min。吸出上清液,根据LDH试剂盒(南京建成生物工程研究所)的操作说明检测LDH释放,采用酶标仪在450 nm波长处测定各组上清液的D值,并通过公式计算LDH活性。
1.6 统计学处理采用SPSS 19.0统计软件分析数据定量数据采用x±s表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
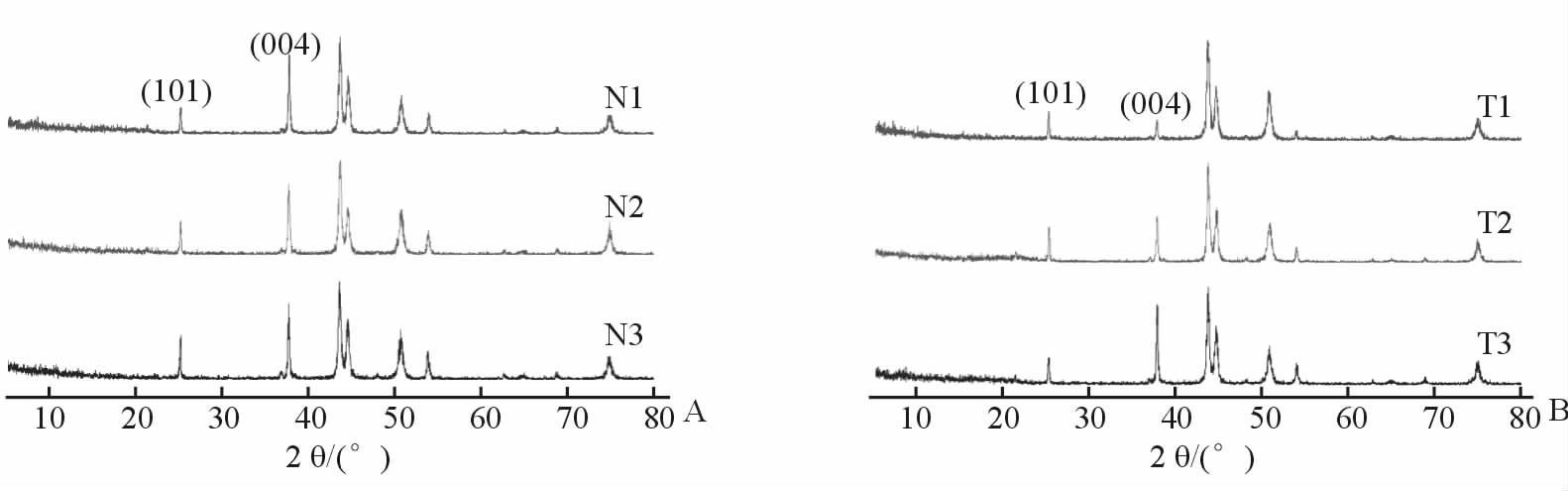
2 结果 2.1 TiO2-xNx薄膜托槽试样的表征通过对X射线衍射结果分析(图 1)可见,TiO2-xNx薄膜存在对应晶型为(101)和(004)衍射峰,为锐钛矿型结构,根据谢乐公式[12]得到薄膜的平均粒径为30 nm,为纳米量级。图 2A为不同氮含量组TiO2-xNx薄膜的扫描电镜图,图中显示TiO2-xNx薄膜均匀致密,但可见薄膜表面存在一定程度的裂隙;图 2B为不同厚度组TiO2-xNx薄膜的扫描电镜图,可见薄膜粒径大小一致,均匀致密,无裂隙存在。溅射时间为30、60、90 min时,不同厚度组TiO2-xNx薄膜的厚度大小分别为(83.67±1.53)、(172.33±6.03)、(261.67±5.03) nm,可见随着溅射时间的延长薄膜厚度逐渐增加。
|
图 1 TiO2-xNx薄膜试样的X射线衍射分析 Fig 1 X-ray diffraction analysis of the TiO2-xNx thin films A: According to the argon/nitrogen gas flow ratio, the nitrogen content group was divided into N1(30:1), N2(30:1.5), and N3(30:2) groups; B: According to the sputtering time, the thickness group was divided into T1(30 min), T2(60 min), and T3(90 min) groups |

|
图 2 TiO2-xNx薄膜试样的扫描电镜图像 Fig 2 Scanning electron microscope (SEM) images of the TiO2-xNx thin films A: According to the argon/nitrogen gas flow ratio, the nitrogen content group was divided into N1(30:1), N2(30:1.5), and N3(30:2) groups; B: According to the sputtering time, the thickness group was divided into T1(30 min), T2(60 min), and T3(90 min) groups. Original magnification: ×50 000 |
L929细胞在对照组和薄膜托槽组表面培养24 h后,扫描电镜图(图 3)结果显示,所有试样表面的L929细胞均呈现梭形或三角形,有的细胞发出丝状伪足黏附于试样表面,胞膜表面可见大量的胞质突起,可从周围摄取更多的营养成分,胞质丰满,黏附和伸展状态良好。

|
图 3 接种24 h后扫描电镜观察L929成纤维细胞在各组试样表面的黏附生长情况 Fig 3 SEM micrographs of L929 cells cultured on the samples for 24 h A: According to the argon/nitrogen gas flow ratio, the nitrogen content group was divided into N1(30:1), N2(30:1.5), and N3(30:2) groups; B:According to the sputtering time, the thickness group was divided into T1(30 min), T2(60 min), and T3(90 min) groups. SS: Stainless steel brackets |
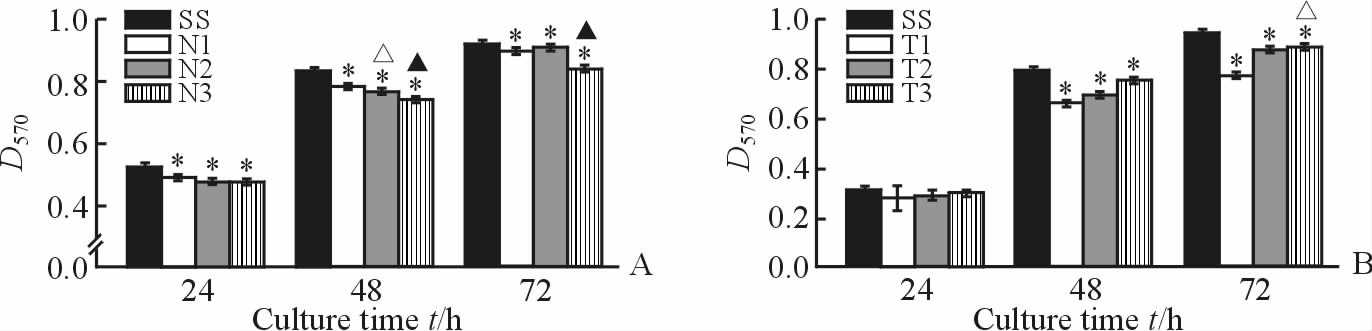
图 4结果表明,不同氮含量组和不同厚度组随着培养时间的延长,各组的D值均上升。不同氮含量组和不同厚度组的D值均比对照组低(P < 0.05),所有组的细胞相对增殖率均在80%以上,根据细胞毒性分级标准[13],所有组的细胞毒性分级均为0级。不同氮含量组中,随着氮含量的增加其细胞相对增殖率逐渐下降,统计学分析结果显示,24、48和72 h时各氮含量组和对照组之间差异均有统计学意义(P < 0.05);24 h时3个氮含量组之间差异均无统计学意义(P>0.05),48 h时3个氮含量组之间差异均存在统计学意义(P < 0.05),72 h时除N1和N2组之间差异无统计学意义(P>0.05)以外,N1、N3组和N2、N3组之间差异均存在统计学意义(P < 0.05)。不同薄膜厚度组中,随着薄膜厚度的增加,其细胞相对增殖率逐渐增加,结果显示24 h时所有组别之间差异均无统计学意义(P>0.05),48 h和72 h时3个厚度组与对照组之间差异均存在统计学意义(P < 0.05);48 h时3个厚度组之间差异均无统计学意义,72 h时除T2和T3组之间差异无统计学意义(P>0.05)以外,T1、T2组和T1、T3组之间差异均存在统计学意义(P < 0.05)。
|
图 4 不同培养时间点各组细胞相对增殖率 Fig 4 Relative proliferation rates of cells in each group at different culture time points SS: Stainless steel brackets. A: According to the argon/nitrogen gas flow ratio, the nitrogen content group was divided into N1 (30:1), N2 (30:1.5), and N3 (30:2) groups; B: According to the sputtering time, the thickness group was divided into T1 (30 min), T2 (60 min), and T3 (90 min) groups. *P<0.05 vs SS group; △P < 0.05 vs N1 (A) or T1 (B) group; ▲P < 0.05 vs N2 group. n=10, x±s |
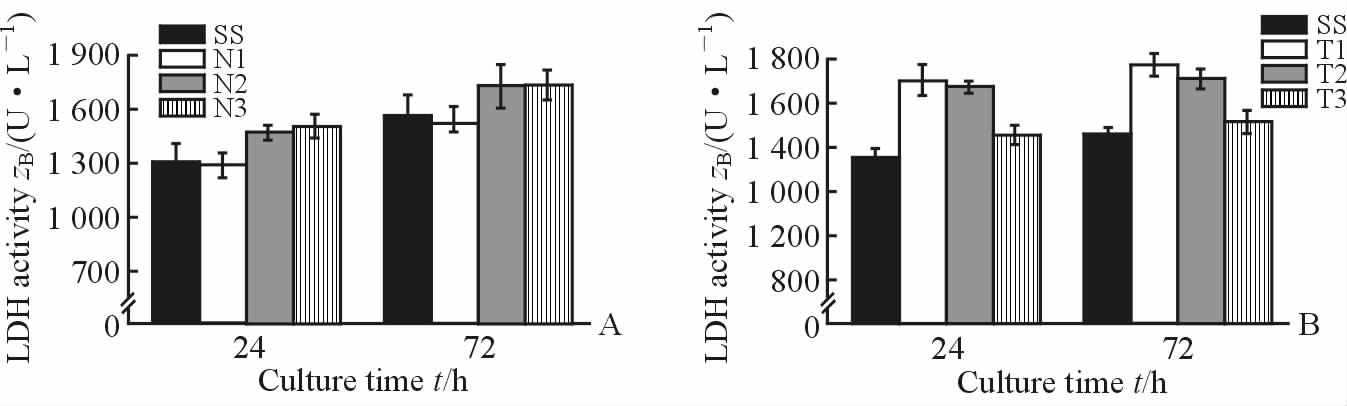
L929细胞生长在不锈钢和薄膜试样表面24 h和72 h后,细胞培养液中LDH的活性如图 5所示。结果表明随着氮含量的增加,LDH活性相应增加,随着厚度的增加,其LDH活性相应降低,所有组别之间差异均无统计学意义(P>0.05)。
|
图 5 不同培养时间点各组细胞乳酸脱氢酶活性 Fig 5 LDH activity of each group at different culture time points SS: Stainless steel brackets. A: According to the argon/nitrogen gas flow ratio, the nitrogen content group was divided into N1 (30:1), N2 (30:1.5), and N3 (30:2) groups; B: According to the sputtering time, the thickness group was divided into T1 (30 min), T2 (60 min), and T3 (90 min) groups. n=10, x±s |
近年来,随着纳米TiO2应用的逐渐增加,有关纳米TiO2毒性的研究也引起了学者们的广泛关注。目前,关于TiO2纳米颗粒生物毒性方面的研究[14, 15]一致认为纳米TiO2颗粒能够诱导大鼠体内产生炎症反应,引起上皮损伤,影响肺泡细胞间隙功能的吞噬和趋化,粒径< 20 nm的TiO2颗粒作用于纤维原细胞导致细胞核核仁消失,细胞膜起泡,形成小体,DNA呈现梯状随机断裂,引起细胞凋亡。Heinlaan等[16]研究认为,当纳米TiO2悬液的浓度低于20 g/L 时对大型蚤和仙女虾是无毒的。而Wang等[17]研究发现,TiO2纳米颗粒对离体人淋巴细胞有显著的细胞毒性作用,可以剂量效应和时间效应的方式杀死细胞。Li等[18]通过测定和比较N-TiO2和TiO2在光动力疗法(photodynamic therapy,PDT)下处理HeLa细胞后细胞参数的变化,如线粒体膜电位(mitochondrial membrane potential,MMP)、细胞内Ca2+和NO浓度,结果显示N-TiO2导致了比TiO2更多的MMP损失,胞内Ca2+和NO的浓度增加更多,并显示出了更加严重的失真和破膜。
纳米TiO2颗粒存在着一定的生物学毒性,而纳米TiO2薄膜生物相容性的研究则出现了不同的结果,研究者们普遍认为,TiO2薄膜能够促进成骨细胞和类成骨细胞的黏附[19, 20, 21]。Wang等[22]在纯Ti基片表面制备出TiO2纳米管并对其进行类成骨细胞(SaOS2 cells)的生物相容性评价,结果显示黏附于TiO2纳米管的细胞数量明显高于纯Ti基片,并且伸展更充分,伪足也更长。Dhayal等[23]体外研究结果表明,Ni掺杂的TiO2薄膜有利于提高MC3T3细胞的黏附、伸展、增殖、分化和迁移的能力。然而,Park等[24]在TiO2薄膜中Mn(原子百分比为4.7%)的掺杂却使成骨细胞株MC3T3-E1的细胞黏附、伸展和增殖水平均比纯Ti组明显降低,且成骨细胞分化迟钝。Kang等[25]指出,掺Cl[(5.4±0.9)%]TiO2薄膜表面细胞活性显著低于对照组。由此可以看出,纳米TiO2薄膜的生物相容性结果存在着争议。
细胞形态代表细胞的健康状态[26]。特别是丝状伪足,是细胞活性的重要标志,在细胞黏附的早期阶段即可看到[27]。SEM结果显示L929细胞在对照组和所有TiO2-xNx薄膜托槽表面的黏附状态良好,细胞伸展充分,表面有大量的细胞突起,胞质丰满。Lan等[28]通过掺Ag-TiO2纳米管的生物学SEM研究观察到了一致的结果,电镜观察显示粒径25 nm掺Ag-TiO2纳米管表面细胞黏附更好,伸展更充分,原因是其表面提供了一个高度不规则的纳米量级的表面,为整合素聚集提供了更多合适的纳米量级位点,从而增强了细胞黏附。而Park等[24]的研究结果与之相反,TiO2薄膜中Mn的掺杂降低了细胞的黏附数量,这可能与金属阳离子本身存在一定的细胞毒性有关[29]。
MTT实验结果显示,首先除不同厚度组在24 h时所有组别之间差异均无统计学意义(P>0.05)以外,薄膜托槽组和对照组之间在3个时间点时差异均存在统计学意义(P < 0.05),表明在该掺氮含量(N1/N2/N3)和薄膜厚度(T1/T2/T3)范围内,相对于不锈钢金属托槽而言,TiO2-xNx薄膜对细胞有一定的毒性效应。其次根据3个氮含量组和3个薄膜厚度组之间差异的统计学分析结果表明,掺氮含量和薄膜厚度对TiO2-xNx薄膜的生物学效应有一定的影响,特别是掺氮含量尤为明显。Dhayal等[30]将Ⅷ族元素(铁、镍、钌、钯)掺入TiO2薄膜后出现了与本研究相似的MTT实验结果,结果显示Ni掺杂的TiO2表面对于成骨细胞来说有最好的生物学反应,其中未掺杂TiO2和掺杂Fe、Ni的TiO2显示了>80%的细胞活性,但是掺杂Ru和Pd的TiO2薄膜却显示了 < 50%的细胞活性,说明掺Fe、Ni后增加了其细胞活性,而掺Ru、Pd后降低了TiO2薄膜的细胞活性。Kang等[25]将Cl掺入TiO2薄膜后MTT结果显示,除C3(NaCl溶液浓度为2 mol/L)组具有显著的细胞毒性(相对增殖率低于80%)外,其余组别细胞相对增殖率均在80%以上。由此可以看出,掺杂元素的不同引起了TiO2薄膜生物相容性结果的不同,而且掺杂元素含量的差异也导致了TiO2薄膜细胞相对增殖率的差异。从总体趋势来看,随着掺氮含量的增加,其生物学活性逐渐降低,这可能与氮含量的增加增强了其光催化作用、产生的活性氧逐渐增多有关。而随着薄膜厚度的增加其生物学活性逐渐增加,与Xiang等[27]的研究结果一致。在该研究中分别制备了1、2、3、4-层TiO2薄膜,随着TiO2薄膜层数的增加,生物学差异也更加明显,其中,生物学活性最强的是4-层纳米TiO2薄膜;与此结果相似的还有Zhu等[31]通过复合电化学氧化法制备梯度TiO2涂层,细胞与该涂层的相互作用研究表明,L929细胞接种和培养在梯度涂层上的黏附良好,增殖率最大,体内实验结果表明梯度涂层具有良好的生物相容性,这可能是由于致密氧化物薄膜是金属材料在体内析出金属离子的有效化学屏障[32]。
LDH是一种与细胞呼吸相关的重要蛋白质,由于LDH的释放与细胞膜的破坏相关,因此被作为是细胞损伤和(或)死亡的一个可靠的指标[33]。本研究LDH实验表明,随着掺氮含量的增加,TiO2-xNx薄膜表面细胞LDH活性逐渐增强,表明生物相容性逐渐降低;而随着厚度的增加其TiO2-xNx薄膜表面细胞LDH活性逐渐降低,表明其生物活性随薄膜厚度的增加而增强。这也与MTT试验结果相一致。统计学分析结果表明掺氮含量和薄膜厚度对TiO2-xNx薄膜的生物学活性的影响并没有统计学意义。这与Cimpean等[26]采用MOCVD技术在Ti基表面沉积TiO2薄膜的LDH实验结果一致,研究显示实验组和对照组的细胞培养液内LDH释放量均较低,表明均无细胞毒性,且各组试样之间无差异,表明TiO2薄膜具有良好的生物相容性,且生物相容性与合适的粗糙度和润湿性有关。
本研究通过射频磁控溅射法在不锈钢金属托槽表面成功制备了不同掺氮含量及厚度的锐钛矿相TiO2-xNx薄膜。TiO2-xNx薄膜托槽表面的L929细胞黏附和伸展状态良好;试样表面细胞相对增殖率均>80%;LDH释放量较低,细胞毒性为0级。掺氮含量和薄膜厚度对TiO2-xNx薄膜托槽的生物相容性有一定的影响。
| [1] | de Souza-e-Silva C M, Parisotto T M, Steiner-Oliveira C, Kamiya R U, Rodrigues L K, Nobre-dos-Santos M. Carbon dioxide laser and bonding materials reduce enamel demineralization around orthodontic brackets[J]. Lasers Med Sci, 2013, 28:111-118. |
| [2] | Liu Y, Zhang Y, Wang L, Guo Y, Xiao S Q. Prevalence of Porphyromonas gingivalis four rag locus genotypes in patients of orthodontic gingivitis and Periodontitis[J]. PLoS One, 2013, 8: e61028. |
| [3] | Ngom P I, Benoist H M, Soulier-Peigue D, Niang A. Reciprocal relationships between orthodontics and periodontics: relevance of a synergistic action[J].Orthod Fr, 2010, 81:41-58. |
| [4] | Panchal A H, Patel V G, Bhavsar N V, Mehta H V. Orthodontic-periodontic intervention of pathological migration of maxillary anterior teeth in advanced periodontal disease[J]. Indian Soc Periodontol, 2013, 17: 378-382. |
| [5] | Lucchese A, Gherlone E. Prevalence of white-spot lesions before and during orthodontic treatment with fixed appliances[J]. Eur J Orthod, 2013, 35: 664-668. |
| [6] | Tufekci E, Dixon J S, Gunsolley J C, Lindauer S J. Prevalence of white spot lesions during orthodontic treatment with fixed appliances[J]. Angle Orthod, 2011, 81: 206-210. |
| [7] | Boersma J G, van der Veen M H, Lagerweij M D, Bokhout B. Caries prevalence measured with QLF after treatment with fixed orthodontic appliances: influencing factors[J]. Caries Res, 2005, 39: 41-47. |
| [8] | Liu B, Wang Y, Yin S, Sato T. TiO2/TiO2-xNy nanocomposite and its acetaldehyde photodecomposition ability[J]. Res Chem Intermediat, 2010, 36: 39-49. |
| [9] | Shu L, Ding Y, Cao Y, Fu S M, Cao M, Shi Z. Development of a nano-TiO2 ceramic-coated orthodontic bracket[J]. J Pract Stomatol, 2005, 21: 252-255. |
| [10] | Shah A G, Shetty P C, Ramachandra C S, Bhat N S, Laxmikanth S M. In vitro assessment of photocatalytic titanium oxide surface modified stainless steel orthodontic brackets for antiadherent and antibacterial properties against Lactobacillus acidophilus[J]. Angle Orthod, 2011, 81: 1028-1035. |
| [11] | Cao S, Liu B, Fan L Y, Yue Z Q, Dong P Y, Liu B, et al. Highly antibacterial activity of N-doped TiO2 thin films coated on stainless steel brackets under visible light irradiation[J]. Appl Surf Sci, 2014, 309: 119-127. |
| [12] | Cao B C, Wang Y H, Li N, Liu B, Zhang Y J. Preparation of an orthodontic bracket coated with an nitrogen-doped TiO2-xNy thin film and examination of its antimicrobial performance[J]. Dent Mater J, 2013, 32: 311-316. |
| [13] | 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 16886.12-2005/ISO 10993-12:2002, 医疗器械生物学评价第12部分:样品制备与参照样品[S].北京:中国标准出版社, 2005. |
| [14] | Renwick L C, Brown D, Clouter A, Donaldson K. Increased inflammation and altered macrophage chemotactic responses caused by two ultrafine particle types[J]. Occup Environ Med, 2004, 61:442-447. |
| [15] | Rahman Q, Lohani M, Dopp E, Pemsel H, Jonas L, Weiss D G, et al. Evidence that ultrafine titanium dioxide induces micmnulei and apoptosis in syrian hamster embryo fibmblasts[J]. Environ Health Pempect, 2002, 110: 797-800. |
| [16] | Heinlaan M, Ivask A, Blinova I, Dubourguier H C, Kahru A. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus[J]. Chemosphere, 2008, 71: 1308-1316. |
| [17] | Wang J J, Sanderson B J, Wang H. Cyto-and genotoxicity of ultrafine TiO2 particles in cultured human lymphoblastoid cells[J]. Mutat Res, 2007, 628: 99-106. |
| [18] | Li Z, Pan X B, Wang T L, Wang P N, Chen J Y, Mi L. Comparison of the killing effects between nitrogen-doped and pure TiO2 on HeLa cells with visible light irradiation[J]. Nanoscale Res Lett, 2013, 8: 96. |
| [19] | Ferrer M L, Yuste L, Rojo F, del Monte F. Biocompatible sol-gel route for encapsulation of living bacteria in organically modified silica matrixes[J]. Chem Mater, 2003, 15: 3614-3618. |
| [20] | Vandrovcova M, Hanus J, Drabik M, Kylian O, Biederman H, Lisa V, et al. Effect of different surface nanoroughness of titanium dioxide films on the growth of human osteoblast-like MG63 cells[J]. J Biomed Mater Res A, 2012, 100: 1016-1032. |
| [21] | Amaravathy P, Rose C, Sathiyanarayanan S, Rajendran N. Evaluation of in vitro bioactivity and MG63 oesteoblast cell response for TiO2 coated magnesium alloys[J]. J Sol-Gel Sci Technol, 2012, 64: 694-703. |
| [22] | Wang Y, Wen C, Hodgson P, Li Y C. Biocompatibility of TiO2 nanotubes with different topographies[J]. J Biomed Mater Res A, 2014, 102:743-751. |
| [23] | Dhayal M, Kapoor R, Sistla P G, Kant C, Pandey R R, Govind, et al. Growth, differentiation, and migration of osteoblasts on transparent Ni doped TiO2 thin films deposited on borosilicate glass[J]. J Biomed Mater Res A, 2012, 100:1168-1178. |
| [24] | Park J W, Kim Y J, Jang J H. Surface characteristics and in vitro biocompatibility of a manganese-containing titanium oxide surface[J]. Appl Surf Sci, 2011, 258: 977-985. |
| [25] | Kang M K, Moon S K, Kim K M, Kim K N. Antibacterial effect and cytocompatibility of nano-structured TiO2 film containing Cl[J]. Dent Mater J, 2011, 30: 790-798. |
| [26] | Cimpean A, Popescu S, Ciofrangeanu C M, Gleizes A N. Effects of LP-MOCVD prepared TiO2 thin films on the in vitro behavior of gingival fibroblasts[J]. Mater Chem Phys, 2011, 125: 485-492. |
| [27] | Xiang X L, Yao L T, Jiang M D, Yuan Y, Tang J Q, Ke Y J, et al. The cytocompatibility of nano-TiO2 thin film fabricated by layer-by-layer assembly technique[J]. Integr Ferroelectrics, 2012, 136: 71-80. |
| [28] | Lan M Y, Liu C P, Huang H H, Lee S W. Both enhanced biocompatibility and antibacterial activity in Ag-decorated TiO2 nanotubes[J]. PLoS One, 2013, 8: e75364. |
| [29] | Li Z, Mi L, Wang P N, Chen J Y. Study on the visible-light-induced photokilling effect of nitrogen-doped TiO2 nanoparticles on cancer cells[J]. Nanoscale Res Lett, 2011, 6:356. |
| [30] | Dhayal M, Kapoor R, Sistla P G, Pandey R R, Kar S, Saini K K, et al. Strategies to prepare TiO2 thin films, doped with transition metal ions, that exhibit specific physicochemical properties to support osteoblast cell adhesion and proliferation[J]. Mater Sci Eng C Mater Biol Appl, 2014, 37: 99-107. |
| [31] | Zhu L, Ye X, Tang G X, Zhao N M, Gong Y D, Zhao Y L, et al. Corrosion test, cell behavior test, and in vivo study of gradient TiO2 layers produced by compound electrochemical oxidation[J]. J Biomed Mater Res A, 2006, 78:515-522. |
| [32] | Nie X, Meletis E I, Jiang J C, Leyland A, Yerokhin A L, Matthews A. Abrasive wear/corrosion properties and TEM analysis of Al2O3 coatings fabricated using plasma electrolysis[J]. Surf Coat Technol, 2002, 149: 245-251. |
| [33] | Lanone S, Rogerieux F, Geys J, Dupont A, Maillot-Marechal E, Boczkowski J, et al. Comparative toxicity of 24 manufactured nanoparticles in human alveolar epithelial and macrophage cell lines[J]. Part Fibre Toxicol, 2009, 6: 14. |
 2015, Vol. 36
2015, Vol. 36


