2. 河北中医学院实验中心, 石家庄 050000
2. Experimental Center, Hebei University of Chinese Medicine, Shijiazhuang 050000, Hebei, China
肥须亚麻蝇(Parasarcophaga crassipalpis)在我国分布广泛,成蝇较早飞临腐败尸体,幼虫尸食性,具有重要的法医学意义。探讨毒物对尸源性昆虫及其幼虫发育历期的影响,进而推测死后间隔时间(postmortem interval,PMI),是法医昆虫毒理学的一个重要研究方向[1, 2]。头咽骨是蝇幼虫头部的主要结构,其形态学稳定性良好,在幼虫的分类鉴定和反映幼虫的发育历期方面具有重要的意义。我们前期已观察了实验室恒温条件下盐酸吗啡对肥须亚麻蝇幼虫头咽骨的影响,认为在恒温条件下可利用头咽骨骨化面积和平均光密度推测PMI[3]。自然条件下,温度是决定昆虫生长发育速率的最重要的因子[4],而积温(accumulated degree hour,ADH)的测定是自然条件下研究温度对昆虫及其幼虫生长发育影响的主要手段。本研究观察了自然条件下盐酸吗啡对肥须亚麻蝇幼虫发育积温和头咽骨的影响,进一步探讨利用肥须亚麻蝇幼虫形态学指征和积温推测尸体PMI的可行性。
1 材料和方法 1.1 主要试剂和仪器盐酸吗啡(morphine hydrochloride)注射液,规格为1 mL: 10 mg,分析纯,由河北医科大学药理学教研室提供,批号为101105-1。2002-11型恒温光照培养箱,Motic Med 6.0医学图像分析系统,Olympus SZX9体视显微镜、OlympusDP71照相机、OlympusDP71显微镜。
1.2 成蝇的采集和饲养在河北中医学院校园内以鼠内脏诱捕肥须亚麻蝇,依据《中国常见蝇类检索表》[5]进行蝇种鉴定。将蝇带回实验室置于养蝇笼内饲养,饲以自来水、奶粉、糖(奶粉:糖=1: 1)。养蝇笼置于生化培养箱内,温度和相对湿度分别设置为28℃、75%,光周期为12 h: 12 h。注意保证水清洁和饲料充足,以第3代成蝇作为母代开始实验。
1.3 幼虫饲养材料的制备健康成年家兔4只,雌雄各2只,雌兔未孕,体质量分别为2.80、2.90、3.10、3.05 kg。根据“人和动物按体表面积折算的等效最大用量”[6]计算出吗啡对家兔的致死剂量为5.33 mg/kg,分别设定家兔的注射剂量为1/2倍致死剂量、1倍致死剂量、2倍致死剂量,对3只家兔分别经耳缘静脉注射盐酸吗啡,另1只家兔注射生理盐水。注射后30 min处死家兔,保存肌肉组织并分别标定为Mn1、Mn2、Mn3、Mn0。
1.4 肥须亚麻蝇幼虫的饲养在28℃恒温条件下以新鲜猪肝(猪肝切成2 cm×2 cm×2 cm的小块,置于50 mL的烧杯中)诱导成蝇产幼虫,将时间间隔30 min以内的幼虫取出,移至含不同浓度盐酸吗啡(Mn0~Mn3)的兔肉上饲养,以此时间作为幼虫发育历期的零时。将4只实验组烧杯置于盛有土层的养虫缸内,养虫缸需用尼龙纱密封,以防止其他昆虫爬入和肥须亚麻蝇幼虫爬出,再将养虫缸置于特制的试验用箱(底部和顶部密封,两侧用铁砂封闭)中。放置于河北中医学院树荫处模拟自然现场。2014年5月25日至6月15日实验期间的日均气温资料由河北省石家庄气象台提供。将实验期间的日均温度累加为积温。每2 h观察记录,尤其注意幼虫离食时间(判断标准:幼虫不再取食,四处爬动寻找化蛹场所)。
1.5 幼虫标本的留取和制作每间隔12 h留取幼虫标本,至50%幼虫化蛹,每组每次留取10头幼虫标本。用80℃热水烫死幼虫并保存于70%甘油乙醇溶液中。化蛹标准:刺激幼虫没有伸缩或移动反应。将幼虫置于KOH溶液中24 h消化内部组织。从保存液中取出标本,置于培养皿上,吸干表面液体后用大头针在幼虫腹部一侧扎几个小孔,再次放入10% KOH溶液中24 h以消化内部组织,后将幼虫取出并用清水清洗数次,在体视显微镜下分离出幼虫的头节至其后2个胸节部分(供幼虫头咽骨标本制作)备用。将已分离的幼虫头节及胸节部分再用清水冲洗2次,用滤纸吸干多余水分。然后在体视显微镜下对头咽骨进行对称性分离,之后在载玻片上依次滴加30%、50%、70%、80%、90%、95%、100%乙醇、100%乙醇与二甲苯的混合液(1: 1)逐级脱水,每级15 min,更换脱水液时要求用滤纸将前次剩余的液体吸净,最后滴加二甲苯1~2滴透明,待液体即将挥发时滴加加拿大树胶,解剖镜下将标本整姿,用盖玻片封片,置于阴凉处风干。
1.6 标本形态特征的提取利用计算机图像分析系统对不同日龄幼虫的图像进行处理和特征提取。头咽骨面积及平均光密度阈值设定为0~170,头咽骨骨化面积阈值设定为0~130。面积:所选图像内所有像素点之和乘以每个像素点所代表的实际面积。骨化面积:通过图像分析系统选定的头咽骨骨化部分图像内所有像素点之和乘以每个像素点所代表的实际面积。光密度(D):检测部位在同一光源下吸收或透过光的数值。
1.7 统计学处理应用SPSS 16.0软件进行统计学分析,用Excel软件绘图。各组头咽骨的各项形态学指标均采用x±s表示,各组最大值或最小值间比较应用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
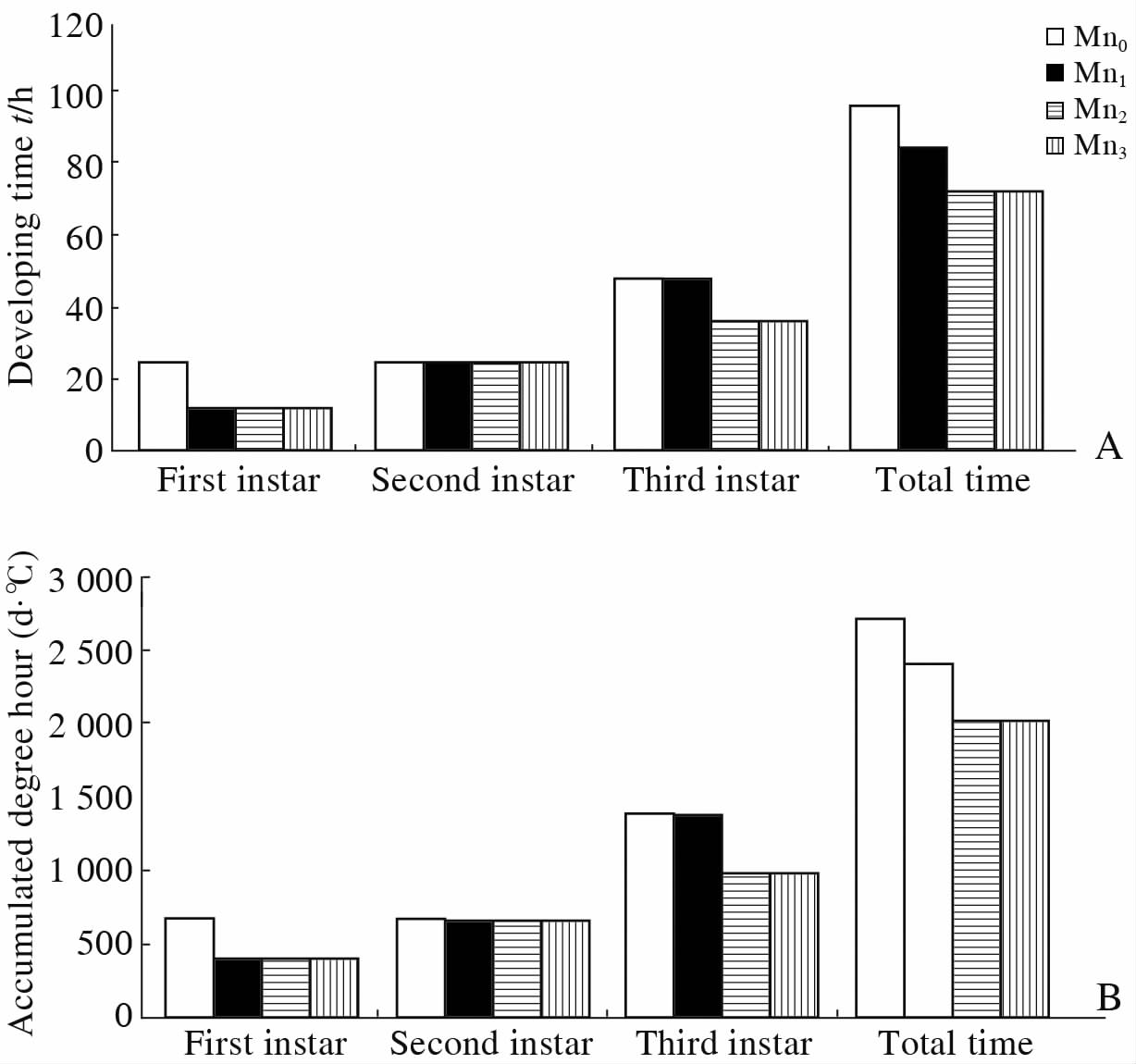
2 结果 2.1 盐酸吗啡对肥须亚麻蝇幼虫发育历期和积温的影响自然条件下,随着盐酸吗啡浓度的改变,肥须亚麻蝇幼虫的发育历期和积温均发生明显改变。自然条件下,从一龄期开始到三龄期结束,Mn1、Mn2、Mn3组幼虫较Mn0组发育历期分别减少了12、24、24 h,发育总积温分别减少了312、708、708 d·℃(图 1)。由此可见,自然条件下,盐酸吗啡对幼虫的发育历期和积温均有一定的影响。
|
图 1 自然条件下盐酸吗啡对肥须亚麻蝇幼虫发育历期(A)和积温(B)的影响 Fig 1 Effect of morphine hydrochloride on developing time (A) and accumulated degree hour (B) of Parasarcophaga crassipalpis larvae under natural condition The larvae were fed on rabbit meat injected with morphine hydrochloride: blank control(Mn0), half lethal dose(Mn1), lethal dose(5.33 mg/kg, Mn2)and twice lethal dose(Mn3)before death |
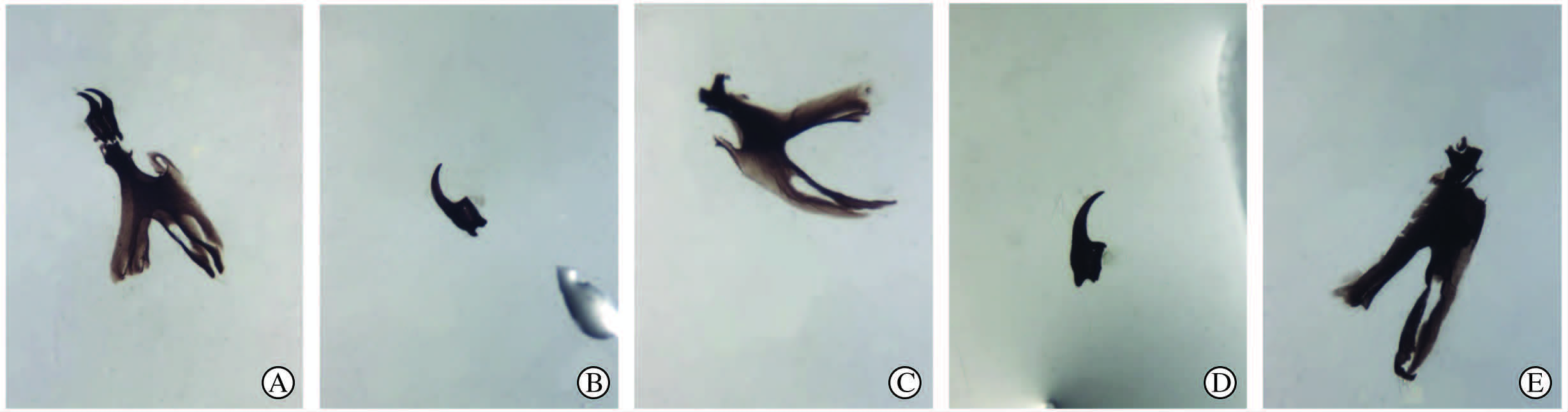
一龄幼虫:头咽骨较小,淡灰色,“H”型。口钩基部稍宽,整体呈镰刀形。口钩窗明显。口钩弯曲度小。咽骨背角较腹角长。下口骨和侧口骨相融合,杆状外形(图 2A)。二龄幼虫:头咽骨较一龄期显著加大,颜色加深至棕黄色。口钩钩部缩短,弯曲度较一龄期更小,基部则加宽。口钩窗减小。咽骨背角仍较腹角长。腹角窗和背角窗出现。下口骨明显,前部三角形,后部长方形。侧口骨顶部尖窄。外形不规则的齿骨明显(图 2B、2C)。三龄幼虫:头咽骨在此期达最大。颜色加深至黑褐色,骨化范围达到最大。口钩弯曲度继续减少的同时基部加宽。口钩窗消失。咽骨背角始终长于腹角。腹角背缘隆突出现。腹角窗显著。下口骨加大。侧口骨变粗变长。齿骨达到最大。点状的附口骨出现(图 2D、2E)。
|
图 2 肥须亚麻蝇幼虫头咽骨的形态学变化 Fig 2 Morphological changes of cephalopharyngeal skeleton of the larvae of Parasarcophaga crassipalpis A: Cephalopharyngeal skeleton of the first instar larvae fed on rabbit meat injected with morphine hydrochloride at twice lethal dose (5.33 mg/kg) before death(Mn3);B: Mouth hook of the second instar larvae in Mn3;C: Pharyngeal sclerite of the second instar larvae in Mn3; D: Mouth hook of the third instar larvae in Mn3; E: Pharyngeal sclerite of the third instar larvae in Mn3 |
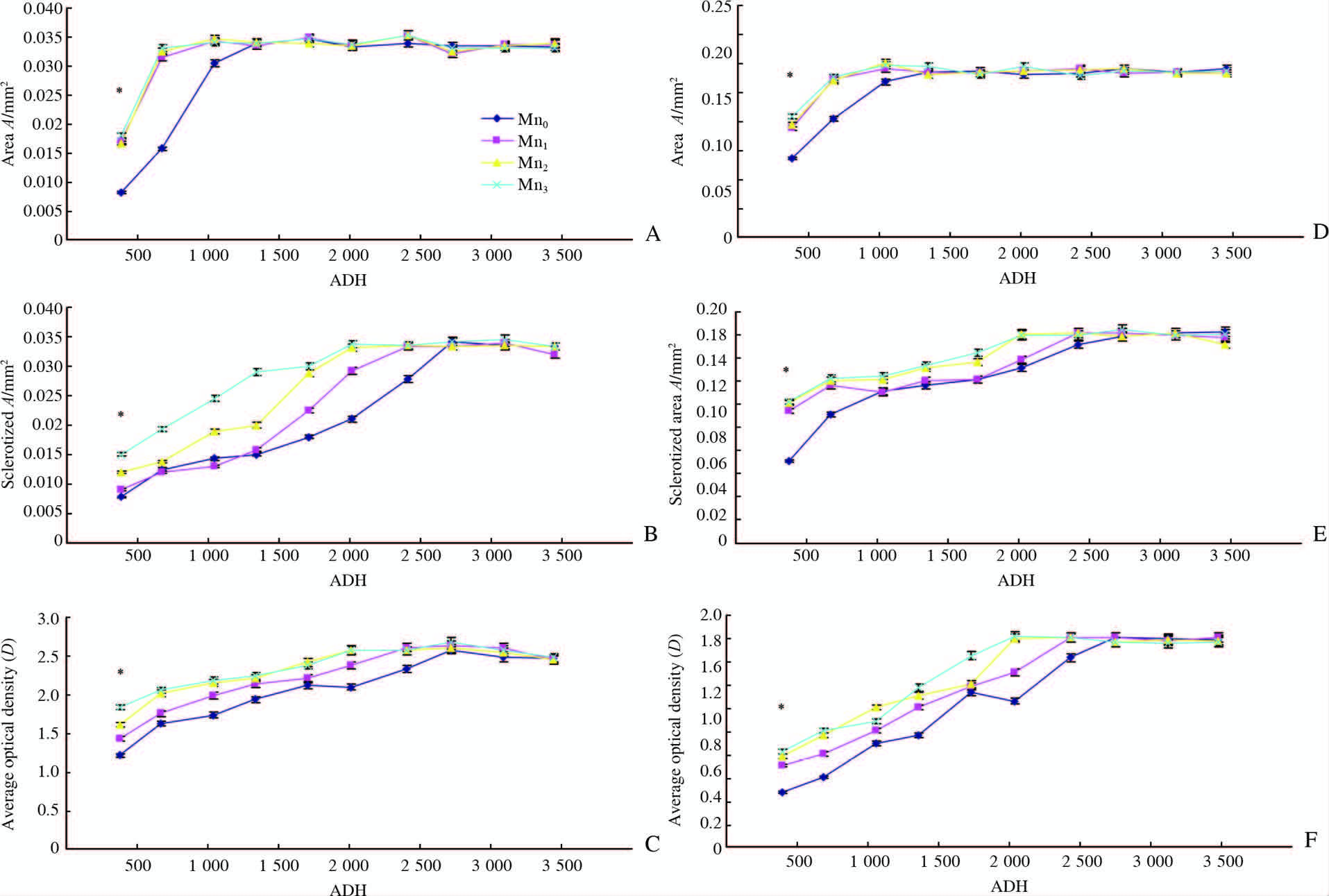
自然条件下,肥须亚麻蝇幼虫口钩面积、咽骨面积均随积温的积累迅速增加,并在三龄期初即刻达到最大值后维持基本恒定,Mn0、Mn1、Mn2、Mn3组幼虫口钩面积、咽骨面积达到最大时的积温分别为1 340、1 044、1 044、1 044 d·℃;幼虫产出12 h时各组口钩面积均为最小,且各组最小值间差异有统计学意义(P<0.05),而各组口钩面积最大值间差异无统计学意义(P>0.05,图 3A、3D)。幼虫口钩及咽骨骨化面积和平均光密度均随着积温增加而逐渐增加,直至三龄期结束;幼虫产出后12 h时,各供试组的口钩及咽骨骨化面积和平均光密度最小,且最小值间差异有统计学意义(P<0.05),而最大值间差异无统计学意义(P>0.05,图 3B、3C、3E、3F);Mn0、Mn1、Mn2、Mn3组口钩及咽骨骨化面积和平均光密度达到最大值的积温一致,分别为2 723、2 411、2 015、2 015 d·℃。
|
图 3 不同浓度盐酸吗啡作用下肥须亚麻蝇幼虫头咽骨形态指征随积温的变化 Fig 3 Changes of morphological index of larval cephalophsryngeal skeleton of Parasarcophaga crassipalpis with the change of ADH The larvae were fed on rabbit meat injected with morphine hydrochloride: blank control(Mn0), half lethal dose(Mn1), lethal dose(Mn2)and twice lethal dose(Mn3)before death. A: Area of larval mouth hook; B: Sclerotized area of mouth hook; C: Average optical density of larval mouth hook; D: Area of pharyngeal sclerite; E: Sclerotized area of pharyngeal sclerite; F: Average optical density of pharyngeal sclerite. ADH: Accumulated degree hour. P<0.05 among the four groups. n=10,x±s |
近年来,随着毒品犯罪的猖獗,PMI的推断逐渐成为法医昆虫毒理学研究的热点[7]。肥须亚麻蝇是石家庄地区夏秋季的优势蝇种,较早飞临腐败尸体,在法医昆虫毒理学的研究中具有重要意义。以往研究多集中于恒温条件下药物对昆虫生长发育改变的影响[8, 9],而传统的指标如蝇蛆的体长、体质量和历期法等对于推断PMI都有一定的局限性[10, 11, 12]。笔者前期已在实验室恒温条件下观察了盐酸吗啡对肥须亚麻蝇幼虫头咽骨的影响,并初步证实了头咽骨骨化面积和平均光密度这两个指标作为PMI推测指标的可行性[3]。自然条件下,温度不再恒定,温度、湿度、风力等变化都会对蝇蛆的生长造成影响。对于幼虫的成长,相对于湿度和风力变化的影响,热量的积累(积温)更为关键。本实验在自然环境中进行,与实验室恒温环境相比,更加接近复杂的现场环境;同时,以积温作为幼虫发育的指标,观察了在盐酸吗啡作用下肥须亚麻蝇幼虫的发育和头咽骨形态学指标之间的内在联系,试图找到推断PMI的有效指标。
在整个实验中,幼虫头咽骨的形态变化规律基本一致:颜色从一龄到三龄逐渐由灰色变为黑褐色,口钩缩短的同时基部加宽,口钩窗消失而腹角窗和背角窗却日益明显。下口骨、侧口骨、附口骨亦越发明显。头咽骨在叠龄期加大最为显著。从一龄期开始到三龄期结束,Mn0、Mn1、Mn2、Mn3组幼虫发育历期分别为96、84、72、72 h,总积温分别为2 723、2 411、2 015、2 015 d·℃;伴随盐酸吗啡浓度增高,Mn1、Mn2、Mn3组较Mn0组发育历期和发育总积温减少,说明盐酸吗啡对肥须亚麻蝇幼虫发育积温和历期产生了一定程度的影响。
自然条件下,各供试组幼虫口钩面积和咽骨面积在幼虫产出12 h时均最小,且最小值之间具有显著性差异。随着盐酸吗啡浓度的增高,口钩面积和咽骨面积的增长速度在一定程度上加快,Mn1、Mn2、Mn3组较Mn0组幼虫口钩面积达到最大时的积温分别减少296、296、296 d·℃,时间分别减少12、12、12 h。另外,口钩和咽骨面积在进入三龄期后随即达到最大值并进入平台期。头咽骨骨化面积和平均光密度的变化趋势类似,Mn1、Mn2、Mn3组较Mn0组口钩、咽骨骨化面积和平均光密度达最大值的积温均减少。可以看出,盐酸吗啡降低了幼虫头咽骨面积、骨化面积和平均光密度达到最大值所需的积温,加快了头咽骨面积、骨化面积和平均光密度的增长速度。同时,我们发现各供试组的幼虫头咽骨面积、骨化面积和平均光密度最大值之间差异均无统计学意义,但头咽骨骨化面积、光密度的变化趋势与面积的变化趋势存在显著差异,二者达到最大值的积温高于面积达到最大值时的积温。另外,头咽骨骨化面积的最大值接近头咽骨面积的最大值。Mn1组口钩面积达到最大值(0.034 8±0.002 1)mm2时的积温为1 044 d·℃,而此时的骨化面积为(0.013 0±0.000 4)mm2;此后口钩骨化面积逐渐增长,直至三龄期末达到最大(0.033 9±0.001 3)mm2,所需积温为2 723 d·℃。也就是说,各供试组的头咽骨面积均在进入三龄期后维持基本恒定,而头咽骨骨化面积和光密度却在三龄期内始终保持增长直至三龄期结束。由此可看出,肥须亚麻蝇幼虫头咽骨面积、骨化面积和平均光密度的最大值未受盐酸吗啡影响,头咽骨具有良好的稳定性。同时幼虫头咽骨的骨化面积和平均光密度在幼虫的整个生长过程中持续、稳定地增长直至三龄期末,说明头咽骨的骨化面积和平均光密度是反映幼虫发育的可靠指标。
通过本实验可以总结:自然条件下,盐酸吗啡使肥须亚麻蝇幼虫的发育所需积温一定程度上减少,但肥须亚麻蝇头咽骨稳定性良好,其最终发育结果未受盐酸吗啡影响;同时幼虫头咽骨的骨化面积和平均光密度在幼虫的整个生长过程中持续、稳定地增长直至三龄期末,能可靠反映幼虫的发育状态。提示根据头咽骨的骨化面积和平均光密度结合发育积温和当地气温可以合理推断PMI。
| [1] | 郭景元.现代法医学[M].北京:科学出版社, 2000:915. |
| [2] | 胡 萃.法医昆虫学[M].重庆:重庆出版社, 2000:167. |
| [3] | 张 楠, 李 嘉, 梁 婕, 牛晓莉, 冯慧敏, 李泽民.不同温度条件下盐酸吗啡对肥须亚麻蝇幼虫的影响及法医学意义[J]. 第二军医大学学报, 2012, 33:1236-1240. Zhang N, Li J, Liang J, Niu X L, Feng H M, Li Z M. Effect of morphine hydrochloride on the larvae of Parasarcophaga crassipalpis under different temperatures and its forensic implication[J]. Acad J Sec Mil Med Univ, 2012, 33: 1236-1240. |
| [4] | 陈 瑜, 马春森. 气候变暖对昆虫影响研究进展[J].生态学报, 2010, 30:2159-2172. |
| [5] | 范滋德.中国常见蝇类检索表[M]. 2版.北京:科学出版社, 1992:992. |
| [6] | 施新猷. 医学动物实验方法[M].北京:人民卫生出版社, 1983:448. |
| [7] | Yang Y Q, Lyu Z, Li X B, Li K, Yao L, Wan L H. Technical note: development of Hemipyrellia ligurriens(Wiedemann)(Diptera: Calliphoridae)at constant temperatures: applications in estimating postmortem interval[J].Forensic Sci Int, 2015, 253:48-54. |
| [8] | 赵文爱, 王伯霞, 胡圣爱, 冯晓勇.恒温条件下吗啡对丝光绿蝇发育规律的改变与死者死亡时间推断的相关研究[J]. 中国病原生物学杂志, 2008, 3: 612-615. |
| [9] | 吕 宙, 翟仙敦, 周海梅, 李 朴, 马锦琦, 官 玲, 等.氯胺酮对大头金蝇生长发育的影响[J]. 中国寄生虫学和寄生虫病杂志, 2012, 30: 361-367. |
| [10] | Ireland S, Turner B. The effects of larval crowding and food type on the size and development of the blowfly, Calliphora vomitoria[J]. Forensic Sci Int, 2006, 159(2-3):175-181. |
| [11] | Ames C, Turner B. Low temperature episodes in development of blowflies: implications for postmortem interval estimation[J]. Med Vet Entomol, 2009, 17:178-186. |
| [12] | Kharbouche H, Augsburger M, Cherix D, Sporkert F, Giroud C, Wyss C, et al. Codeine accumulation and elimination in larvae, pupae, and imago of the blowfly Lucilia sericata and effects on its development[J]. Int J Legal Med, 2008, 122: 205-211. |
 2015, Vol. 36
2015, Vol. 36


