2. 第二军医大学长海医院整形外科, 上海 200433
2. Department of Plastic Surgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
在创面处覆盖生物敷料是压疮非手术治疗中最常见的治疗手段之一。在伤口愈合的过程中,敷料可以起到暂时的屏障功能,防止伤口感染,为伤口愈合提供良好环境。目前临床上使用的敷料主要有普通棉制纱布、棉垫、大网眼棉制纱布、凡士林纱布等。但是,传统敷料具有单一性、局限性的缺点,仅能覆盖创面却无法明显促进愈合,且愈合过程中肉芽组织容易长入纱网、诱导微生物黏附和浸润,进而会增加外源性感染的风险[1]。纳米银-活性炭纤维敷料是一类新型敷料,同时具备纳米银及活性炭敷料的特性[2]。在本研究中,我们分析了纳米银-活性炭纤维敷料对压疮动物模型创面愈合情况的影响。
1 材料和方法 1.1 动物及分组50只成年SD大鼠由第二军医大学实验动物中心提供[许可证号:SYXK(沪)2012-0003],雌雄随机,体质量为230~250 g。采用随机数字表法将实验动物分为纳米银-活性炭纤维(Ag/AFC)敷料组(A组)、纳米银敷料组(B组)、活性炭敷料组(C组)、洗必泰凡士林敷料组(D组)、空白对照组(E组),每组各10只,在常规条件下单独饲养。
1.2 压疮创面制作SD大鼠腹腔麻醉后俯卧于手术台上,固定四肢后在大鼠背部以正中线为中轴设计约4 cm×3 cm的手术区域(图1A),脱毛后清洗消毒,用尖刀片沿标记区近头侧的横向切口切开,约3 cm,层次位于深筋膜下方,可见肌肉层并可及脊椎(图1B、图1C)。用眼科剪于标记区皮下组织锐性游离,使SD大鼠背部手术区域成类似“口袋”状(图1D)。充分止血后植入1.6 g高温灭菌后的铁片(图1E),铁片长4 cm、宽2 cm、厚0.3 cm。最后用4-0带针丝线缝合全层切口(图1F)。术后第2天,将一块4 cm×2 cm大小的永久性磁铁(1 200 GS)吸附于实验大鼠背部铁片植入区(图1G),作用2 h后移开,使该区皮肤的血流再灌注30 min,如此重复4次,连续操作5 d。以皮肤变黑、变硬、针刺不出血视为压疮创面建立成功(图1H)。
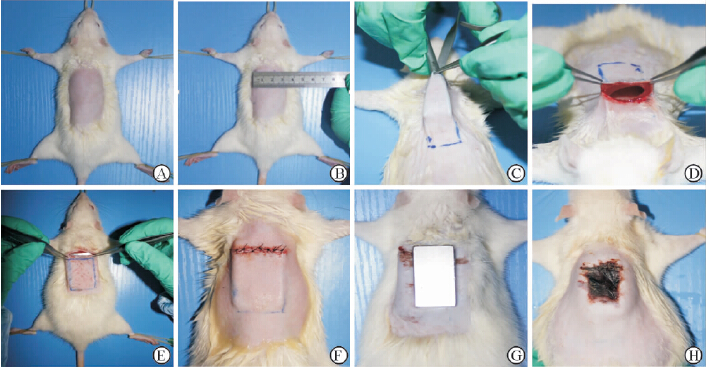
|
图 1 SD大鼠压疮模型的制作 Fig 1 Establishment of SD rat model of bedsore A: Fixation and skin preparation after anesthesia; B: Mark the surgical area; C: Cut the skin and free the subcutaneous; D: Form a “bag-like” cut; E: Place iron; F: Suture the skin; G: Magnets adsorb to iron implanted region; H: Bedsores animal model |
动物模型复制成功后,每组每只SD大鼠均单独饲养。清理A组实验大鼠压疮后背部的黑色坏死组织直至可见新鲜肉芽,覆盖纳米银-活性炭纤维敷料,用4-0丝线于创面四周打包固定以防止敷料滑脱;同法清理B组、C组、D组、E组大鼠压疮创面,并分别覆盖纳米银敷料、活性炭敷料和洗必泰凡士林敷料,E组不覆盖任何敷料,再用丝线打包固定。每隔2 d更换一次敷料。
1.4 创面愈合情况评价治疗前和治疗后第3、7、14、21天时分别拍照记录创面情况,采用CAD软件计算创面面积。以治疗前创面面积为S0,治疗后第3、7、14、21天时的创面面积分别为S3、S7、S14、S21,参照下列公式计算创面愈合率。创面愈合率(%)=(原始面积S0-未愈合面积Sn)/原始面积S0×100%。以创面愈合至上皮化为愈合标准。
1.5 创面中细胞因子含量的检测治疗后第21天时,切取5组大鼠的创面组织,放置在冻存管中用液氮迅速冷冻10 min,后取出并于-80℃保存。检测细胞因子含量时,取出创面组织适量,加入TRIzol裂解液后匀浆,抽提组织中的RNA,反转录后得到cDNA,设计特异性引物后进行实时定量PCR反应,分别测定血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、血管内皮生长因子B(vascular endothelial growth factor B,VEGFB)、血管内皮生长因子C(vascular endothelial growth factor C,VEGFC)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素2(interleukin-2,IL-2)、白介素8(interleukin-8,IL-8)和β肌动蛋白(β-actin)的mRNA含量。
1.6 统计学处理采用SPSS 20.0软件进行统计学分析,数据以x±s表示,5组间比较采用方差分析、两两比较采用LSD-t检验,检验水准(α)为0.05。
2 结 果 2.1 一般情况观察压创后第1~3天,各组的创面炎性渗出均较多,各组敷料对创面渗出的吸收力情况为:纳米银-活性炭纤维敷料>纳米银敷料>洗必泰凡士林敷料>活性炭敷料。大鼠的活动量较平时略有减少,进食情况一般。1周后,大鼠基本恢复正常生活状态,进食饮水情况、活动情况基本满意。4周后,各组压疮创面基本愈合(图2)。
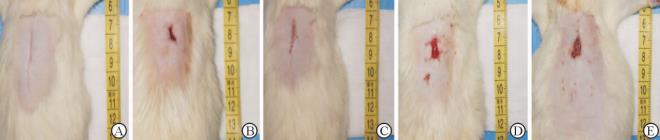
|
图 2 压疮后第21天各组SD大鼠创面愈合情况 Fig 2 Healing states of SD rats on the 21st day after pressure ulcer A: Nano-silver active carbon dressings group; B: Nano-silver dressings group; C: Active carbon dressings group; D: Vaseline chlorhexidine dressing group; E: Control group |
由表1可见,大鼠的创面愈合时间在5组间有差异,A、B、C、D组大鼠的创面愈合时间均短于E组(P< 0.05);A组大鼠的创面愈合时间短于B、C、D组(P< 0.05),A组的平均愈合时间较其余4组提前了3~8 d。在压疮后第3天、第7天,A组大鼠的愈合率高于其余4组,差异有统计学意义(P< 0.05),而B、C、D、E组间愈合率的差异无统计学意义(P>0.05);压疮后第14天、第21天,A、B、C、D组大鼠的愈合率均高于E组(P< 0.05),且A组大鼠的愈合率高于B、C、D组,差异有统计学意义(P< 0.05)。
|
|
表 1 5组大鼠创面愈合率及愈合时间 Tab 1 Wound healing rate and healing time of rats in five groups |
由图3可见,A、B、C、D组大鼠创面组织中血管新生因子VEGFA、VEGFB、VEGFC的mRNA含量均高于E组(P< 0.05),且A组大鼠创面组织中VEGFA、VEGFB、VEGFC的mRNA含量高于B、C、D组,差异有统计学意义(P< 0.05)。
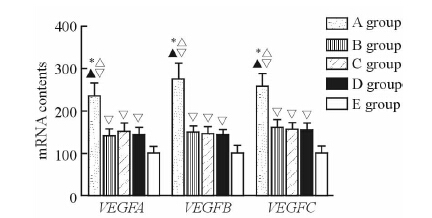
|
图 3 5组大鼠创面中VEGFA、VEGFB、VEGFC的mRNA含量 Fig 3 Contents of VEGFA, VEGFB, and VEGFC mRNA in the wound tissues of rats in 5 groups VEGFA: Vascular endothelial growth factor A; VEGFB: Vascular endothelial growth factor B; VEGFC: Vascular endothelial growth factor C. A: Nano-silver active carbon dressings group; B: Nano-silver dressings group; C: Active carbon dressings group; D: Vaseline chlorhexidine dressing group; E: Control group. *P< 0.05 vs B group; △P< 0.05 vs C group; ▲P< 0.05 vs D group; ▽P< 0.05 vs E group. n=10, x±s |
由图4可见,A、B、C、D组大鼠创面组织的炎症因子TNF-α、IL-2、IL-8的mRNA含量低于E组(P< 0.05),且A组大鼠创面组织中TNF-α、IL-2、IL-8的mRNA含量低于B、C、D组,差异有统计学意义(P< 0.05)。

|
图 4 5组大鼠创面组织中TNF-α、IL-2、IL-8的mRNA含量 Fig 4 Contents of TNF-α, IL-2, and IL-8 mRNA in the wound tissues of rats in 5 groups TNF-α: Tumor necrosis factor-α; IL-2: Interleukin-2; IL-8: Interleukin-8. A: Nano-silver active carbon dressings group; B: Nano-silver dressings group; C: Active carbon dressings group; D: Vaseline chlorhexidine dressing group; E: Control group. *P< 0.05 vs B group; △P< 0.05 vs C group; ▲P< 0.05 vs D group; ▽P< 0.05 vs E group. n=10, x±s |
纳米银-活性炭纤维敷料就是以活性炭纤维与纳米银为基质经改性后精制而成的新一代高科技医用复合敷料,其具备了纳米银及活性炭敷料两者的特性,能够在创面局部发挥抗感染和促进伤口愈合的作用[3]。一方面,在该敷料的垂直表面上密集且均匀分布着0.6~30 nm的微细孔,5~50 nm孔径的中微孔能够吸附创面的液体,0.7~1.6 nm孔径的亚微孔能够避免创面受到来自空气细菌的传播感染[4]。另一方面,该材料同时具有极强的吸湿作用和保湿作用,既能有效地吸附创面渗出液、杀死其中的细菌并维持创面处于一个相对无菌的环境;同时当创面失水过多且干燥、影响肉芽生长时,该材料能够适当释放保湿成分,大大减少了创面修复所需的蛋白质、激素、酶、维生素、电解质等物质的损失,进而促进创面局部肉芽的生长。此外,该材料使用无纺布材料,不会粘连创面,避免了创面换药时所造成的二次创伤[5]。
创伤愈合是皮肤或器官组织受伤后自我修复的一个较为复杂的过程,该过程是一个动态变化且极其复杂的生物过程。现有的研究认为,最佳的创面愈合过程应包括6个步骤[6]:(1)快速止血;(2)合适的炎症反应和炎性细胞浸润;(3)间充质细胞分化、增殖并迁移到创面;(4)足够的新生血管生成;(5)创面表层上皮组织的形成;(6)胶原蛋白适当的合成和交联,并提供足够的愈合强度。创面在经历了凝血阶段和炎性细胞浸润阶段后开始进入修复阶段,在这一阶段中肉芽组织不断形成,同时新生的毛细血管以每日延长0.1~0.6 mm的速度形成,能够迅速将创面填平并为上皮再生创造有利条件[7]。为了明确纳米银-活性炭纤维敷料用于压疮创面愈合的价值,本研究对创面愈合率和愈合时间进行了分析,结果显示纳米银-活性炭纤维敷料组、纳米银敷料组、活性炭敷料组、洗必泰凡士林敷料组4组大鼠的创面愈合时间均短于未覆盖任何敷料的空白对照组,而愈合率高于空白对照组,说明4种敷料均具有促进创面愈合的作用;纳米银-活性炭纤维敷料组大鼠的创面愈合时间短于另3组,而愈合率高于这3组,说明4种敷料中纳米银-活性炭纤维敷料的作用最为明显。
新生血管形成是创面愈合的重要环节,局部形成的新生血管有助于促进充实局部肉芽组织并对局部微循环起到改善作用,同时也为后续的修复过程提供必需的氧气及营养物质。现有的研究认为,创面局部新生毛细血管数目越多、管腔越大、血供越丰富,创面的愈合过程越迅速且愈合质量越高[8]。血管内皮生长因子(VEGF)是目前已知功能最为强大的促血管新生因子。在创面愈合过程中,局部低氧环境会诱导转录因子HIF-1α大量产生并通过启动基因表达的方式增加VEGF的表达,进而在愈合过程中发挥刺激新生血管生成、改善微循环的作用。愈合创面中新生血管形成的过程包括血管舒张、基底膜降解、内皮细胞迁移和增殖、毛细管形成发生、循环血管和新基底膜形成等步骤[9]。VEGF在这几个环节中均发挥了重要作用,是促进创面愈合的关键分子。本研究对不同敷料治疗后创面中VEGF的表达量进行了检测和分析,结果显示,纳米银-活性炭敷料组大鼠创面组织VEGFA、VEGFB、VEGFC的mRNA含量均高于其余各组(P< 0.05)。这就说明纳米银-活性炭纤维敷料能够促进VEGF表达、增加创面中新生血管形成。
创面的愈合过程伴有炎症反应的动态变化。创面形成和愈合的早期为浆液性渗出期,局部表现为无菌性炎症,适宜浓度的炎症介质有助于杀灭潜在感染的病原菌、促进创面的愈合[10]。随着创面愈合进程的发展,微生物黏附、浸润以及外源性感染的发生风险增加,局部炎症反应增强并对创面愈合造成不利影响。纳米银材料具有一定的抗感染功能,能够抑制创面愈合过程中的炎症反应并使炎症反应处于适宜程度[11]。创面内炎症反应的激活表现为炎症细胞浸润以及炎症因子释放,常见的炎症因子包括TNF-α、IL-2、IL-8等。TNF-α由活化的单核巨噬细胞合成和分泌,具有启动炎症反应、激活炎症因子网络、形成炎症级联放大反应的作用;IL-2是由活化淋巴细胞产生的淋巴因子,通过与免疫细胞表面的IL-2R结合来诱导细胞活化、增殖并发挥杀伤效应;IL-8是内源性趋化因子,能够在创面局部募集中性粒细胞、淋巴细胞等,促进多种炎症介质的释放[12]。本研究对不同敷料治疗后创面中炎症因子的表达量进行了检测和分析,结果显示,纳米银-活性炭纤维敷料组大鼠创面组织中TNF-α、IL-2、IL-8的mRNA含量低于其余各组(P< 0.05),说明纳米银-活性炭纤维敷料能够抑制炎症因子的表达,缓解创面炎症反应。
综上所述,纳米银-活性炭纤维敷料有助于促进压疮创面愈合、缓解创面炎症反应、促进创面内新生血管形成,是处理压疮创面的理想材料。
| [1] | Kerihuel J C. Effect of activated charcoal dressings on healing outcomes of chronic wounds[J]. J Wound Care,2010,19:208-215. |
| [2] | 马艳梅,单 思,杨蕾芳,张奥琨,巴彩凤. 压疮动物模型组织损伤的实验研究[J].中国实用护理杂志,2013,29:66-67. |
| [3] | Lin Y H, Hsu W S, Chung W Y, Ko T H, Lin J H.Evaluation of various silver-containing dressing on infected excision wound healing study[J].J Mater Sci Mater Med,2014,25:1375-1386. |
| [4] | Lin Y H, Lin J H, Wang S H, Ko T H, Tseng G C.Evaluation of silver-containing activated carbon fiber for wound healing study: in vitro and in vivo[J].J Biomed Mater Res B Appl Biomater,2012,100:2288-2296. |
| [5] | Prestes M A, Ribas C A, Ribas Filho J M, Moreira L B, Boldt A B, Brustolin E V, et al.Wound healing using ionic silver dressing and nanocrystalline silver dressing in rats[J].Acta Cir Bras,2012,27:761-767. |
| [6] | 杨景哲,温海玲,耿琪瑛,陈凤平,冯欣姝. rhGM-CSF 及纳米银对深Ⅱ度烫伤创面愈合过程血管化的影响[J]. 医药导报,2014,33:1570-1574. |
| [7] | 王佳琪,王国栋,颜红柱,吴 洋. 生长因子在创伤愈合中作用的研究[J]. 创伤外科杂志,2013,15:281-283. |
| [8] | 阮琼芳,谢卫国,温丰平. 血管内皮生长因子在电烧伤大鼠血清及创面组织中的表达变化[J].中华烧伤杂志,2012,28:423-427. |
| [9] | Kwon M J, An S, Choi S, Nam K, Jung H S, Yoon C S, et al.Effective healing of diabetic skin wounds by using nonviral gene therapy based on minicircle vascular endothelial growth factor DNA and a cationic dendrimer[J].J Gene Med, 2012,14:272-278. |
| [10] | 杨景哲,陈凤平,耿琪瑛,冯欣姝,王 芳. rhGM-CSF纳米银对深Ⅱ°烫伤愈合过程炎症反应的影响[J]. 武汉大学学报(医学版),2014,35:674-677. |
| [11] | Jafarzadeh A, Nemati M, Rezayati M T, Ebrahimi M, Hassan Z M.Cimetidine enhances delayed-type hypersensitivity responses and serum interleukin (IL)-2, -10, -12, and IL-17 levels after burn injury in an animal model[J].J Immunotoxicol,2013,10:201-209. |
| [12] | 李巧芬,李春深,李云平,常 柏. 生肌象皮膏对糖尿病大鼠溃疡肉芽组织中白介素-2与肿瘤坏死因子-α的影响[J].中国实验方剂学杂志,2013,19:279-282. |
 2015, Vol. 36
2015, Vol. 36


