2. 第二军医大学长海医院泌尿外科, 上海 200433;
3. 第二军医大学长海医院病理科, 上海 200433
2. Department of Urology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
中央叶前列腺癌约占前列腺癌的30%[1]。虽然中央叶前列腺癌的Gleason评分和病理分期相对较低,但如不及时发现并针对其进行相应处理,约有16%的患者将出现进展[2]。随着高强度聚焦超声(high-intensity focused ultrasound,HIFU)等局部治疗方法在前列腺癌患者中的逐步应用,局限于前列腺包膜内低危组的中央叶前列腺癌患者成为HIFU等局部治疗方式的理想人群[3]。这样的局部治疗方式不仅可以有效根治肿瘤,改善患者预后,也使患者生活质量较其他前列腺癌根治的患者明显提高。早期检出位于中央叶的前列腺癌是针对其进行局部治疗的重要前提。
中央叶前列腺因其复杂多变的组织成分构成,在MRI上信号表现错综复杂,一直是前列腺癌诊断的难点。近年来文献报道,扩散加权成像(diffusion weighted imaging,DWI)作为最常用的诊断和鉴别诊断外周带前列腺癌的功能成像磁共振技术之一,在诊断中央叶前列腺癌中有着较高的价值[4, 5]。本研究拟以磁共振超声融合靶向穿刺病理结果为金标准,比较单指数模型ADCtotal及双指数模型ADCslow、ADCfast、f值在诊断及鉴别诊断中央叶前列腺癌、腺体型前列腺增生、基质型前列腺增生中的应用价值。
1 资料和方法 1.1 临床资料回顾性分析经磁共振超声融合靶向穿刺证实的中央叶前列腺癌、腺体型前列腺增生、基质型前列腺增生病例资料。其中中央叶前列腺癌患者23例,平均年龄为(69.3±5.43)岁,平均前列腺特异抗原(prostate specific antigen,PSA)为(12.3±3.43) ng/mL;中央叶腺体型前列腺增生患者19例,平均年龄为(60.4±8.51)岁,平均PSA为(6.31±4.62) ng/mL;中央叶基质型前列腺增生患者24例,平均年龄为(62.3±6.53)岁,平均PSA为(9.81±5.57) ng/mL。所有病例均于穿刺前行包括多方位T2WI、T1WI及多b值DWI在内的MRI检查。b值设置为0、50、100、150、200、500、800、1 000、1 500、2 000 s/mm2。病例入选标准:(1)患者检查前未行放疗、化疗、内分泌或局部治疗等相关治疗;(2)MR检查时间位于穿刺前;(3)病理结果为磁共振超声融合靶向穿刺所证实;(4)无其他恶性肿瘤病史;(5)MR质量满足诊断所需要求。排除标准:不满足上述标准的任何一条。
1.2 磁共振扫描序列所有患者MRI检查均在Siemens Magnetom 3.0 T Skyra超导型成像仪上完成。射频发射采用内置体部线圈,磁共振信号接收采用体表线圈,体表线圈由腹部相控阵线圈与脊柱相控阵线圈组合而成。先行常规矢状面、冠状面及横断面的高分辨率T2WI及横断面的T1WI的脉冲序列得到前列腺的解剖图像,而后行DWI序列扫描,DWI采用单次激发的回波平面成像行横断位扫描。所用脉冲序列及序列参数见表1。
|
|
表 1 磁共振扫描参数及脉冲序列 Tab 1 MRI protocols and sequence parameters |
由两名经验丰富的影像科医师结合欧洲泌尿生殖学会发布的前列腺癌报告和诊断评分系统[6]及相关文献报道[7, 8],依据患者T2WI信号表现、病灶形态及边界、DWI信号表现、ADC图进行综合判断,确定穿刺靶点。
1.4 靶向穿刺的实施及病理结果判读依据磁共振确定靶向穿刺点,使用GE公司的LOGIQ E9超声成像仪,将DICOM格式的T2WI加权图像导入该超声成像仪,由影像科医师负责确认超声指示点和磁共振可疑靶点是否相匹配,由泌尿外科医师负责实施穿刺,并对穿刺靶点进行实时标记。穿刺所得的前列腺组织放入预先准备好的带有标记的标本瓶中,由一名专门从事泌尿生殖系统病理研究的病理科医师读片。
1.5 DWI与病理结果的匹配在明确穿刺靶点病理结果后,将病理结果同靶向穿刺区域的DWI图像进行匹配,并测定靶区ADCtotal、ADCslow、ADCfast、f值。为了尽量避免因图像伪影带来的误差,采用在病灶范围内取多个小感兴趣区(region of interested,ROI)求其平均值的策略来划定ROI。ROI划定步骤:(1)T2WI确定病灶大致区域;(2)调整多b值DWI使病灶清晰显示并在DWI图像上划定ROI;(3)计算出全腺体的ADCtotal、ADCslow、ADCfast、f值,而后在相应层面调整ROI在各参数图中的位置,使得各ROI均在病灶范围内并且各参数指标亦无负数值及0值的出现(图1)。
1.6 统计学处理使用SPSS 16.0进行统计分析。采用Kruskal-Wallis检验进行组间差异性比较,检验水准(α)为0.05。采用受试者工作特征(receiver operating characteristics,ROC)曲线计算曲线下面积(area under curve,AUC)、敏感性(sensitivity)和特异性(specificity)及cutoff值。

|
图 1 ROI划定示意图 Fig 1 Schematic diagram of ROI A: T2WI showed homogenous low T2 signal intensity in the right central gland of prostate; B: DWI showed homogenous high signal intensity in the right central gland of prostate; C: ADCtotal map showed relatively low signal intensity in the right central gland of prostate; D: ADCfast map showed relatively low signal intensity in the right central gland of prostate; E: ADCslow map showed relatively low signal intensity in the right central gland of prostate; F: f map. The three circles in B-F represented three different ROIs,the ADCtotal,ADCfast,ADCslow and f value were the mean values of the three different ROIs. ROI: Region of interested |
分别计算中央叶前列腺癌、腺体型前列腺增生、基质型前列腺增生的ADCtotal、ADCslow、ADCfast、f值的平均值及标准差,并进行差异性检验,结果(表2)显示: ADCtotal、ADCslow、f值在各组之间差异有统计学意义(P=0.000、0.001和0.000),ADCfast在各组间差异无统计学意义(P=0.489)。
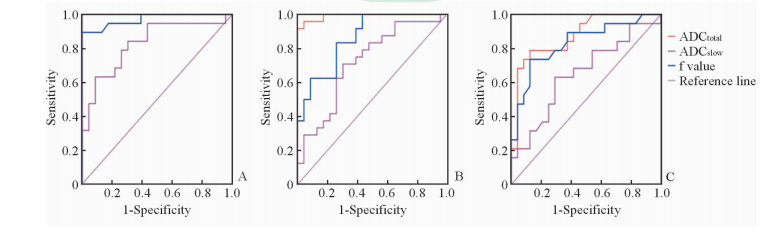
2.2 DWI各参数的诊断效能分析运用ROC曲线分析,分别计算ADCtotal、ADCslow、f值在鉴别中央叶前列腺癌、中央叶腺体型前列腺增生及基质型前列腺增生时的特异性、敏感性、cutoff值及AUC值,结果(表3、图2)显示,单指数模型的ADCtotal较双指数模型的ADCslow和f值在鉴别诊断中央叶前列腺癌、腺体型前列腺增生、基质型前列腺增生时具有更佳的诊断效能。
|
|
表 2 不同病理类型前列腺中央叶病灶各参数值的比较 Tab 2 Comparison of ADCtotal,ADCslow,ADCfast and f values of prostate central gland lesions of different pathological types |
|
|
表 3 ADCtotal、ADCslow、f值鉴别诊断前列腺中央叶不同病理类型的效能比较 Tab 3 Diagnostic efficiency of ADCtotal,ADCslow,and f value,for central gland lesions of prostate of different pathological types |
|
图 2 ADCtotal、ADCslow、f值鉴别诊断前列腺中央叶不同病理类型的ROC曲线 Fig 2 The ROC curve of ADCtotal,ADCslow,and f value for diagnosis of different pathology types in prostate central gland A: The ROC curve of central gland prostate cancer vs glandular prostatic hyperplasia; B: The ROC curve of central gland prostate cancer vs stromal prostatic hyperplasia; C: The ROC curve of central glandular prostatic hyperplasia vs stromal prostatic hyperplasia. ROC: Receiver operating characteristic |
本研究结果显示在b值位于0~2 000 s/mm2时单指数模型和双指数模型在诊断和鉴别诊断中央叶前列腺癌中的效能与病理类型密切相关。在中央叶不同病理类型中,ADCtotal、ADCslow、f值3个定量参数均有显著性差异,而ADCfast无显著性差异。ADCtotal无论在鉴别何种病理类型中均表现出较高的诊断效能。
随着年龄的增长,移行带良性前列腺增生的发生率逐渐增高,其在T2WI上的信号表现复杂多样。常规的T2WI已经不能胜任诊断中央叶前列腺癌的临床需要。文献报道单独使用T2加权像诊断中央叶前列腺癌的特异性和敏感性分别为51%~75%和50.0%~61.5%[9, 10]。中央叶良性前列腺增生可进一步细分为腺体型前列腺增生和基质型前列腺增生,腺体型前列腺增生因其在T2WI相对特征的T2高信号表现和常具有完整包膜等使得其较容易和中央叶前列腺癌鉴别。在我们的研究结果中也发现ADCtotal值能完全将中央叶前列腺癌和腺体型前列腺增生区分开来。但基质型前列腺增生常表现为形态欠规则无包膜的结节,其T2WI也表现为和前列腺癌类似的T2低信号。这些表现使得其极易和中央带前列腺癌相混淆[5, 7]。Zakian等[11]在运用磁共振波谱成像诊断移行带前列腺癌的研究中发现,虽然移行带前列腺癌组织和良性组织的代谢产物比值的差异有统计学意义,但其代谢产物比值范围过大,限制了其在移行带前列腺癌诊断中的运用。Swindle等[12]在对中央叶前列腺癌和基质型前列腺增生进行磁共振波谱研究中发现,两者的代谢产物具有显著差异,但该研究使用的是8.5T的MR,如此高的场强尚未进入临床使用。Oto等[5]运用动态增强磁共振成像(dynamic contrast-enhanced MR imaging,DCE-MRI)对中央叶前列腺癌和前列腺增生进行研究,结果表明中央叶前列腺癌和基质型前列腺增生的灌注参数差异无统计学意义。而中央叶基质型前列腺增生恰巧是我们需要和前列腺癌进行鉴别的重点对象。
DWI是一种常用的诊断前列腺癌的功能成像磁共振方式,目前可运用多种数学模型计算出不同的定量参数指标。Liu等[13]比较了单指数模型和拉伸指数模型在诊断前列腺癌中的运用价值,结果表明拉伸指数模型较单指数模型的诊断效能更高,但其未将中央叶前列腺癌单独罗列出来比较。和外周带前列腺癌相比,专门将DWI用于中央叶前列腺癌诊断的文献报道较少。在我们的研究中发现中央叶前列腺癌、腺体型前列腺增生、基质型前列腺增生的ADCtotal值分别为(0.46±0.06)、(0.87±0.19)和(0.68±0.09)×10-3 mm2/s,三者间差异具有统计学意义;并且ADCtotal值在鉴别前列腺癌和腺体型前列腺增生时AUC为1。但是对于如何鉴别中央叶前列腺癌和基质型前列腺增生我们仍然面临较大的挑战。基质型前列腺增生因含有丰富的间质成分和缺乏相应的导管使得其ADCtotal值和前列腺癌组织的ADCtotal值重叠区域较多。双指数模型是一种更为复杂的扩散加权成像的模型,到目前为止双指数模型的本质尚未被很好地阐明。之前的一些研究试图通过在低b值下建立的体素内不相干运动(intravoxel incoherent motion,IVIM)模型来解释[14]。在这种模型中扩散加权的成分表现被分为扩散和灌注两种成分,也就对应我们的ADCslow和ADCfast。但在Liu 等[15]的研究中发现,ADCfast较机体的真实灌注成分要大得多。Le Bihan[16]的研究推测ADCslow可能代表细胞膜及细胞骨架结构相关的扩散受限部分,而ADCfast可能代表其余的位于细胞外间隙或细胞内限制相对受限较少的部分。因此在前列腺增生尤其是基质型前列腺增生较为复杂的组织成分构成导致其影响ADCfast的因素极为复杂,很有可能导致其和前列腺癌组织间有较大范围的交叉。我们的研究结果得出各病理类型间ADCfast差异无统计学意义,这和上述推测相吻合。Park等[17]研究发现由两个b值所得出的ADCtotal值和多个b值所计算的ADCtotal值无显著性差异,提示在临床工作中可以选择扫描两个b值,由此计算出ADCtotal对中央叶不同病理类型的前列腺组织进行鉴别,在兼顾诊断效能的同时也将大大缩短扫描时间。
总之,本研究发现在b值位于0~2 000 s/mm2时单指数模型ADCtotal较双指数模型的ADCslow和f值在诊断及鉴别诊断中央叶前列腺癌、腺体型前列腺增生、基质型前列腺增生时具有更佳的诊断效能。本研究也具有一定的局限性:(1)纳入的病例数量较少,要想进一步验证上述结果仍需要大量病例进行验证。我们也准备在后续工作中继续跟踪和推进此研究。(2)缺乏大切片的同层对照,可能造成研究数据的偏差。随着我院大切片机的投入使用,这一问题也将得到有效解决。(3)尽管采取划定多个小ROI取平均值的方法来划定ROI,但仍无法完全避免高b值DWI形变伪影对结果产生的影响,尚需进一步改进。
| [1] | Mcneal J E, Redwine E A, Freiha F S, Stamey T A. Zonal distribution of prostatic adenocarcinoma. Correlation with histologic pattern and direction of spread[J]. Am J Surg Pathol, 1988, 12:897-906. |
| [2] | Shannon B A, Mcneal J E, Cohen R J. Transition zone carcinoma of the prostate gland: a common indolent tumour type that occasionally manifests aggressive behaviour[J]. Pathology, 2003, 35:467-471. |
| [3] | Ahmed H U, Freeman A, Kirkham A, Sahu M, Scott R, Allen C, et al. Focal therapy for localized prostate cancer: a phase Ⅰ/Ⅱ trial[J]. J Urol, 2011, 185:1246-1254. |
| [4] | 李 鹏,杨文君,陈志强,郭玉林,蔡 磊,杜 奕,等. T2WI、DWI和动态增强MRI联合应用对前列腺中央腺体癌诊断的价值[J]. 中华医学杂志,2014,94:2448-2451. |
| [5] | Oto A, Kayhan A, Jiang Y, Tretiakova M, Yang C, Antic T, et al. Prostate cancer: differentiation of central gland cancer from benign prostatic hyperplasia by using diffusion-weighted and dynamic contrast-enhanced MR imaging[J]. Radiology, 2010, 257:715-723. |
| [6] | Barentsz J O, Richenberg J, Clements R, Choyke P, Verma S, Villeirs G, et al. ESUR prostate MR guidelines 2012[J]. Eur Radiol, 2012, 22:746-757. |
| [7] | Akin O, Sala E, Moskowitz C S, Kuroiwa K, Ishill N M, Pucar D, et al. Transition zone prostate cancers: features, detection, localization, and staging at endorectal MR imaging[J]. Radiology, 2006, 239:784-792. |
| [8] | Haider M A, van der Kwast T H, Tanguay J, Evans A J, Hashmi A T, Lockwood G, et al. Combined T2-weighted and diffusion-weighted MRI for localization of prostate cancer[J]. AJR Am J Roentgenol, 2007, 189:323-328. |
| [9] | Li H, Sugimura K, Kaji Y, Kitamura Y, Fujii M, Hara I, et al. Conventional MRI capabilities in the diagnosis of prostate cancer in the transition zone[J]. AJR Am J Roentgenol, 2006, 186:729-742. |
| [10] | Yoshizako T, Wada A, Hayashi T, Uchida K, Sumura M, Uchida N, et al. Usefulness of diffusion-weighted imaging and dynamic contrast-enhanced magnetic resonance imaging in the diagnosis of prostate transition-zone cancer[J]. Acta Radiol, 2008, 49:1207-1213. |
| [11] | Zakian K L, Eberhardt S, Hricak H, Shukla-Dave A, Kleinman S, Muruganandham M, et al. Transition zone prostate cancer: metabolic characteristics at 1H MR spectroscopic imaging--initial results[J]. Radiology, 2003, 229:241-247. |
| [12] | Swindle P, Ramadan S, Stanwell P, McCredie S, Russell P, Mountford C. Proton magnetic resonance spectroscopy of the central, transition and peripheral zones of the prostate: assignments and correlation with histopathology[J]. MAGMA, 2008, 21:423-434. |
| [13] | Liu X, Zhou L, Peng W, Wang H, Zhang Y. Comparison of stretched exponential and monoexponential model diffusion weighted imaging in prostate cancer and normal tissues[J]. J Magn Reson Imaging, 2015,42:1078-1085. |
| [14] | Riches S F, Hawtin K, Charles-Edwards E M, de Souza N M. Diffusion-weighted imaging of the prostate and rectal wall: comparison of biexponential and monoexponential modelled diffusion and associated perfusion coefficients[J]. NMR Biomed, 2009, 22:318-325. |
| [15] | Liu X, Zhou L, Peng W, Wang C, Wang H. Differentiation of central gland prostate cancer from benign prostatic hyperplasia using monoexponential and biexponential diffusion-weighted imaging[J]. Magn Reson Imaging, 2013, 31:1318-1324. |
| [16] | Le Bihan D. The 'wet mind': water and functional neuroimaging[J]. Phys Med Biol, 2007, 52:R57-R90. |
| [17] | Park S Y, Kim C K, Park B K, Kwon G Y. Comparison of apparent diffusion coefficient calculation between two-point and multipoint B value analyses in prostate cancer and benign prostate tissue at 3 T: preliminary experience[J]. AJR Am J Roentgenol, 2014, 203:W287-W294. |
 2015, Vol. 36
2015, Vol. 36


