Graves眼病又称甲状腺相关性眼病(thyroid associated ophthalmopathy,TAO),常存在甲状腺功能亢进或既往有Graves病伴甲状腺功能亢进史,发病年龄通常在20~50岁,女性发病率较男性高[1]。TAO与甲状腺功能异常密切相关,但其发病机制尚不完全清楚。CD40分子是肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)超家族的成员,表达于抗原提呈细胞、T细胞和B细胞。CD40分子可活化介导多条信号通路,参与细胞免疫和体液免疫。研究表明眼眶成纤维细胞(orbital fibroblasts,OFs)可表达CD40,而CD40与其配体CD40L结合后刺激细胞因子如IL-6、IL-8、COX-2、PGE2的产生,提示T细胞参与的重要信号通路可诱导OFs活化和增殖[2, 3, 4, 5]。在对TAO发病机制的研究过程中发现,可溶性CD40L(sCD40L)大量浸润于眼眶组织中,提示sCD40L与眼外肌纤维化相关[6]。另有研究发现,TAO患者血清中sCD40L的表达量明显高于正常人群[7]。
透明质酸(hyaluronan,HA)是一类参与炎症反应的黏多糖,广泛分布于细胞外基质(extracellular matrix,ECM)中。HA不仅参与细胞的迁移、增生和分化,同时还影响淋巴细胞和巨噬细胞的功能以及细胞间的相互作用。HA由透明质酸合成酶(hyaluronan synthase,HAS)催化合成[8]。目前已成功克隆了3种HAS基因,分别编码3种酶蛋白HAS1、HAS2、HAS3[9]。研究发现,TAO患者眼眶组织中HAS1和HAS3 mRNA表达量明显高于正常人[10],但sCD40L对HAS mRNA表达的影响尚未见报道。本研究采用sCD40L刺激体外培养的TAO患者和正常对照的OFs,以MTS比色法测定sCD40L对OFs增殖的影响,并比较sCD40L刺激后OFs中HAS基因表达谱的变化,探讨sCD40L在TAO发病过程中的病理生理作用。
1 材料和方法 1.1 主要试剂与仪器DMEM(Gibco),胎牛血清(Gibco),MTS(Promega),sCD40L(Promega),TRIzol(Invitrogen),RT-PCR试剂盒(TaKaRa),SYBR Premix EX Taq试剂盒(TaKaRa),PCR扩增热循环仪(Perkin Elmer),CO2培养箱(Hereus)、自动酶联免疫测定仪(Bio-Rad)。
1.2 OFs来源OFs来源于5例TAO患者及3例正常对照。5例TAO患者均符合TAO的诊断标准,其中男1例、女4例,暴露性角膜炎3例、压迫性视神经病变2例。患者术前采用甲泼尼龙激素冲击治疗,效果欠佳,因严重的暴露性角膜溃疡和复视等要求手术治疗,并且符合手术指征。患者行开眶减压术时,取眶内结缔组织和部分眼外肌。正常对照组3例,男2例、女1例,为角膜穿通伤并要求义眼植入的患者,于眼球摘除术中取相应组织。以上取材均排除其他免疫性和炎症性疾病。均获得患者知情同意。
1.3 OFs培养和鉴定无菌条件下取眼眶结缔组织及眼外肌,剔除较大的血管和脂肪,将其剪成1 mm× 1 mm×1 mm的小块,均匀地置入培养瓶瓶壁,翻转培养瓶,瓶底向上,瓶内加入含20%胎牛血清的DMEM完全培养液(青霉素10万U/mL、链霉素4万U/mL)10 mL,放入37℃、5% CO2培养箱中。24 h后,组织块贴附于瓶壁上,将培养瓶翻转平放,静置继续培养,每2~3 d换液1次。待单层细胞覆盖大部分瓶壁时,用0.25%胰蛋白酶、0.02% EDTA消化传代,每4~6 d传代1次。传代后细胞以含10%胎牛血清的DMEM完全培养液继续培养。取处于对数生长期、生长良好的细胞,在倒置相差显微镜下观察其活体形态,进行细胞鉴定,并取4~9代作为实验用细胞。
1.4 sCD40L对OFs增殖的影响取同代对数生长期细胞,充分消化后,稀释成1×104个细胞/mL密度的单细胞悬液,接种于96孔培养板,每孔200 μL ( 2 000个细胞) ,5% CO2、37℃下培养24 h,使细胞贴壁生长,然后换为无血清培养液培养24 h,使细胞生长同步化,并消除血清对细胞增殖的影响。实验组分别给予含不同浓度sCD40L(终质量浓度为6.25、12.5、25、50、100、200 ng/mL)的DMEM培养液,对照组不加sCD40L,每个浓度设3个复孔,各孔血清终浓度为5%。继续培养48 h后采用MTS比色法检测,每孔加入10 μL的MTS溶液,继续培养2 h后酶联免疫检测仪测定光密度(D)值,测定波长为450 nm,重复3次。
1.5 sCD40L对OFs中HAS mRNA表达的影响取同代对数生长期细胞,充分消化后,稀释成1×104个细胞/mL密度的单细胞悬液,接种于12孔培养板,每孔2 mL(20 000个细胞),5% CO2、37℃下培养24 h,使细胞贴壁生长,然后换为无血清培养液培养24 h。分别给予含不同浓度sCD40L(终质量浓度为12.5、25、50、100 ng/mL)的DMEM培养液,空白对照不加sCD40L,继续培养3、6、12、24 h后收集细胞。各浓度和(或)时点均设3个复孔。提取细胞总RNA,反转录后用荧光定量PCR仪检测目的基因的表达。所用引物序列(GenePharma)见表1。
|
|
表 1 荧光定量PCR引物序列 |
采用Graphpad prism 5.0统计软件处理数据。数据以x±s表示,组间比较采用配对t检验,检验水准(α)为0.05。
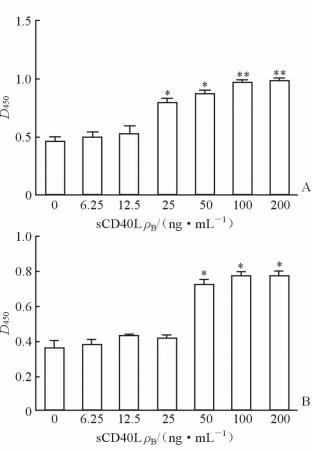
2 结 果 2.1 sCD40L促进TAO患者OFs增殖图1A显示,给予25 ng/mL及以上浓度sCD40L刺激可促进TAO患者OFs增殖,并且该作用存在饱和现象,在100 ng/mL浓度达到最大刺激作用,增大浓度至200 ng/mL细胞数量并无明显增加;图1B显示,50 ng/mL及以上浓度的sCD40L才可以促进正常对照OFs增殖,且该作用较弱并存在饱和现象。以上结果说明sCD40L对TAO患者OFs有更加明显的促增殖作用。
|
图 1 sCD40L对TAO患者(A)和正常对照(B)OFs增殖的影响析 TAO: 甲状腺相关性眼病; OFs: 眼眶成纤维细胞. *P< 0.05, **P< 0.01与空白对照(0 ng/mL)比较. n=3, x±s |
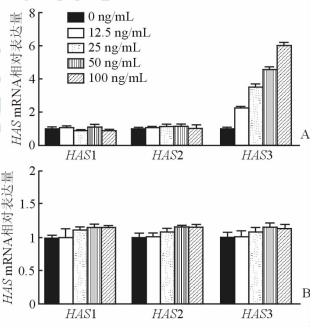
经12.5~100 ng/mL浓度的sCD40L处理24 h后,TAO患者OFs的HAS1和HAS2 mRNA表达无明显变化;而HAS3 mRNA表达量随着sCD40L浓度加大而增加,100 ng/mL sCD40L刺激OFs 24 h可使HAS3 mRNA的表达量增大为对照组的6倍(图2A)。但正常对照OFs经12.5~100 ng/mL的sCD40L处理24 h后,其HAS1、HAS2和HAS3 mRNA的表达均无明显变化(图2B)。
|
图 2 不同浓度的sCD40L作用24 h对TAO患者(A)和正常对照(B)OFs中HAS mRNA表达的影响 TAO: 甲状腺相关性眼病; OFs: 眼眶成纤维细胞; HAS: 透明质酸合成酶. n=3, x±s |
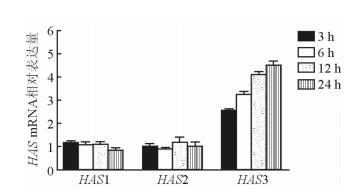
图3显示,经50 ng/mL的sCD40L处理后,TAO患者OFs的HAS1、HAS2 mRNA表达量于各时间点无明显变化,而HAS3 mRNA表达量呈现出明显的时间依赖趋势,24 h时约为空白对照的4.5倍。
|
图 3 50 ng/mL sCD40L处理不同时间后对TAO患者OFs中HAS mRNA表达量的影响 TAO: 甲状腺相关性眼病; OFs: 眼眶成纤维细胞; HAS: 透明质酸合成酶. n=3, x±s |
TAO是一种器官特异性自身免疫性疾病,确切的发病机制目前尚不清楚。早期的病理改变是淋巴细胞、浆细胞以及各种炎性因子局部浸润于眼眶结缔组织,我们前期研究发现反映慢性疾病炎性反应的重要指标红细胞分布宽度与TAO患者病情相关[11],也间接证明炎性反应在TAO的发病中具有重要作用。在探究TAO发病机制过程中发现,OFs既是自身免疫靶细胞又是效应细胞,当受到炎性因子刺激后,不仅参与眼外肌纤维化,同时还参与了眼眶脂肪形成以及透明质酸的堆积;OFs作为靶细胞被激活,活化后分泌氨基葡聚糖(glycosaminoglycans,GAGs),具有亲水性的GAGs能使组织水肿,导致眼球后组织肿胀,严重者导致眼球向前突出[12, 13]。
研究发现当甲状腺功能调节异常时,大量促甲状腺激素受体(TSHR)抗体与TSHR结合,激活下游信号,并通过介导信号通路激活NF-κB、MAPK、ERKs等蛋白激酶,促进细胞因子、生长因子、黏附分子(CD54/CD106)、基质金属蛋白酶等的表达。此时大量免疫细胞(如T细胞、B细胞、巨噬细胞、抗原提呈细胞等)通过体循环浸润眼眶组织并各司其职。当免疫系统被过度激活时,抗原提呈细胞和活化的巨噬细胞能产生IL-1β、TNF-α和TGF-β,不断加重炎性反应过程。T细胞能够产生不同的细胞因子包括干扰素γ和IL-4γ,另外,活化的T细胞可以刺激OFs,使MHCⅡ高表达,呈递自身抗原。其中CD40-CD40L共刺激通路是介导T细胞激活OFs的关键,在TAO发病机制中起着至关重要的作用[2, 3, 4, 5]。本实验发现sCD40L能促进OFs的增殖,提示在眼眶组织纤维化区域集中分布的sCD40L可能是通过刺激OFs的生长,加强OFs在TAO病理过程中的作用。
TAO患者球后组织有大量ECM聚集,而HA是OFs合成的ECM的主要成分,并且血清HA水平与TAO活动度有关[14]。目前为止已经发现并克隆了3种HA合成酶基因,分别编码3种同工酶HAS1、HAS2和HAS3蛋白。虽然这3种同工酶具有同源性,但各自合成的HA相对分子质量不同,且功能也存在差异。高相对分子质量的HA主要由HAS1和HAS2合成,主要参与抑制炎症反应;低相对分子质量的HA则主要由HAS3合成,参与炎症反应,是重要的炎性介质。以上3种HAS基因的表达受多种生长因子和细胞因子的影响,而TAO患者眼眶结缔组织中弥漫浸润多种细胞因子和生长因子,因此有可能通过影响患者眼眶组织中HAS基因的表达参与TAO病理生理过程。有研究表明胰岛素样生长因子1(IGF-1)不影响培养的OFs中HAS 1mRNA的表达,但能明显抑制HAS2 mRNA的表达,增加HAS3 mRNA的表达,提示IGF-1可能通过调节不同HAS mRNA,使OFs合成低相对分子质量HA的比例和数量增高,引起TAO患者眼眶组织HA的堆积和炎性反应过程[15]。本实验发现,在sCD40L作用下,TAO患者OFs中HAS1和HAS2 mRNA的表达无明显变化,而HAS3 mRNA的合成增加,并且呈现出浓度和时间依赖的趋势。由于HAS3主要催化合成低相对分子质量HA,而后者是一种重要的炎症介质,故可能加重TAO患者眼眶局部组织的炎症反应和病情,提示sCD40L可能通过促进HAS3 mRNA的表达来促进TAO患者OFs合成和分泌HA,从而促进TAO的发生和发展。
| [1] | Bahn R S. Graves’ ophthalmopathy[J].N Engl J Med,2010, 362: 726-738. |
| [2] | Hwang C J, Afifiyan N, Sand D, Naik V, Said J, Pollock S J, et al.Orbital fibroblasts from patients with thyroid-associated ophthalmopathy overexpress CD40: CD154 hyperinduces IL-6, IL-8, and MCP-1[J]. Invest Ophthalmol Vis Sci, 2009, 50: 2262-2268. |
| [3] | Sempowski G D, Rozenblit J, Smith T J, Phipps R P. Human orbital fibroblasts are activated through CD40 to induce proinflammatory cytokine production[J]. Am J Physiol, 1998, 274(3 Pt 1): C707-C714. |
| [4] | Aoki-Ota M, Kinoshita M, Ota T, Tsunoda K, Iwasaki T, Tanaka S, et al.Tolerance induction by the blockade of CD40/CD154 interaction in pemphigus vulgaris mouse model[J]. J Invest Dermatol, 2006, 126: 105-113. |
| [5] | Gillespie E F, Raychaudhuri N, Papageorgiou K I, Atkins S J, Lu Y, Charara L K,et al.Interleukin-6 production in CD40-engaged fibrocytes in thyroid-associated ophthalmopathy: involvement of Akt and NF-κB[J]. Invest Ophthalmol Vis Sci, 2012, 53: 7746-7753. |
| [6] | Mys'liwiec J, Waligórski D, Nikoajuk A, Górska M.Soluble CD40 and its ligand CD154 in patients with Graves' ophthalmopathy during combined therapy with corticosteroids and teleradiotherapy[J]. Adv Med Sci, 2007, 52: 104-108. |
| [7] | Pietravalle F, Lecoanet-Henchoz S, Blasey H, Aubry J P, Elson G, Edgerton M D, et al.Human native soluble CD40L is a biologically active trimer, processed inside microsomes[J]. J Biol Chem, 1996, 271: 5965-5967. |
| [8] | Pappa A, Jackson P, Stone J, Munro P, Fells P, Pennock C, et al.An ultrastructural and systemic analysis of glycosaminoglycans in thyroid-associated ophthalmopathy[J]. Eye (Lond), 1998, 12 ( Pt 2): 237-244. |
| [9] | Itano N, Sawai T, Yoshida M, Lenas P, Yamada Y, Imagawa M,et al.Three isoforms of mammalian hyaluronan synthases have distinct enzymatic properties[J]. J Biol Chem, 1999, 274: 25085-25092. |
| [10] | Kaback L A, Smith T J. Expression of hyaluronan synthase messenger ribonucleic acids and their induction by interleukin-1beta in human orbital fibroblasts: potential insight into the molecular pathogenesis of thyroid-associated ophthalmopathy[J].J Clin Endocrinol Metab, 1999, 84: 4079-4084. |
| [11] | 曾程程,魏锐利,牟 旆,王秋红.红细胞分布宽度与甲状腺相关性眼病相关[J].第二军医大学学报,2015,36:680-684.Zeng C C, Wei R L, Mou P, Wang Q H. Red blood cell distribution width is elevated in patients with Grave’s ophthalmopathy[J]. Acad J Sec Mil Med Univ, 2015,36:680-684. |
| [12] | Kazim M, Goldberg R A, Smith T J.Insights into the pathogenesis of thyroid-associated orbitopathy: evolving rationale for therapy[J]. Arch Ophthalmol, 2002, 120: 380-386. |
| [13] | Gould D J, Roth F S, Soparkar C N.The diagnosis and treatment of thyroid-associated ophthalmopathy[J]. Aesthetic Plast Surg, 2012, 36: 638-648. |
| [14] | 何 伟, 刘 英. HA和IGF-1检测对甲状腺相关性眼病活动度的评价[J].标记免疫分析与临床, 2014,21: 401-404. |
| [15] | 杨俊峰. IGF-1和生长抑素对眼眶成纤维细胞增殖和透明质酸合成酶基因表达影响的实验研究[D]. 成都:四川大学,2004. |
 2015, Vol. 36
2015, Vol. 36


