2. 复旦大学附属华东医院心内科, 上海 200040
2. Department of Cardiology, Huadong Hospital Affiliated to Fudan University, Shanghai 200040, China
随着人口的老龄化,骨质疏松症(osteoporosis,OP)的发生率和影响成倍增加[1, 2]。一项中国汉族女性的4年随访研究发现,45~55岁是骨量丢失最常见的阶段[3]。另一项关于中国女性的研究也发现,骨生化标记物水平在45岁之前和60岁之后变化缓慢[4]。这些研究表明,中年过渡时期可能是骨代谢的重要“转折点”,存在若干可能影响骨质流失的因素。因此,在这个年龄段中找出影响骨质流失的潜在因素将有助于为老年人骨质疏松症提供更好的防治手段。
高尿酸血症是包括代谢综合征、肾功能和心血管疾病在内的许多疾病的危险因素[5, 6]。而另一方面,尿酸可清除自由基[7],其抗氧化作用约占人血浆中所有抗氧化能力的一半[8]。因此,有学者提出尿酸可促进骨折愈合的假说[9]。一系列流行病学研究也报道了尿酸对骨质疏松的可能影响[10, 11, 12]。基于中年男性的CHAMP研究表明,高血清尿酸水平的研究对象具有较高的骨密度(bone mineral density,BMD)[12]。新近一项对绝经后妇女的研究也证实尿酸对骨代谢具有保护作用[10]。然而,在中国人群中,血尿酸浓度与BMD和骨转换指标(bone turnover markers,BTMs)的相关性尚未明了。因此,本研究对45~65岁骨量流失最快的中年人群进行研究,探讨该群体尿酸与BMD及骨代谢标记物间的关系,为后续研究奠定基础。
1 资料和方法 1.1 研究对象选取2010年1月至2013年12月在我院体检的214例中年人群(45~65岁)进行研究,其中男性117例,女性97例。排除患有癌症、类风湿性关节炎、痛风或尿路结石;存在肝、肾和甲状腺功能异常的研究对象。排除过去12个月内服用双膦酸盐、全身糖皮质激素或雌激素等可能会影响骨代谢的药物者。此外,亦排除近期服用降尿酸药(如别嘌呤醇或苯溴马隆等)者。
1.2 生化指标的测定入选者空腹8 h后抽取静脉血,用全自动生化分析仪进行尿酸、肌酐、碱性磷酸酶(alkaline phosphatase,ALP)、钙、磷、超敏C-反应蛋白(hypersensitive C-reactive protein,hsCRP)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、载脂蛋白A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein B,ApoB)、溶血磷脂酸(lysophosphatidic acid,LPA)、糖化血红蛋白(hemoglobin A1c,HbA1c)、空腹血糖(fasting blood glucose,FBG)、餐后2 h血糖(2-hour blood glucose,2HBG)、空腹C肽(fasting C-peptide,FC)、餐后2 h C肽(2-hour C-peptide,2HC)、空腹胰岛素(fasting insulin,FINS)、2 h胰岛素(2-hour insulin,2HINS)、尿白蛋白/肌酐比值(urinary albumin to creatinine ratio,UACR)、尿β2-微球蛋白(β2 microglobulin,β2-MG)等指标检测。用慢性肾脏病流行病学协作(CKD-EPI)公式估算肾小球滤过率[eGFR; mL/(min·1.73 m2)]。用公式“空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5”计算胰岛素抵抗指数(HOMA-IR)。自动化分析仪ELECSYS 2010电化学发光免疫测定甲状旁腺激素 (parathormone,PTH),25-hydroxycholecalciferol (25-OHD3)和BTMs的血清浓度(罗氏诊断有限公司,德国)。BTMs包括骨形成标记物N-MID-骨钙素(osteocalcin,OC)、Ⅰ型原胶原氨基末端前肽(procollagen type Ⅰ N-terminal propetide,PⅠNP)和骨吸收标记物β-CrossLaps(β-CTX)。
1.3 BMD测量区域BMD,包括腰椎(L1~4)、左股骨颈、全髋关节和全身BMD均采用双能X线骨密度仪(Hologic Inc公司)测量,所有扫描和分析由同一研究者进行。腰椎BMD变异度为0.86%,股骨颈为1.86%,全髋部为1%,全身为0.95%。据世界卫生组织,骨量减少定义为任何部位-2.5标准差(SD)<T值<-1.0 SD,骨质疏松症定义为T值≤-2.5 SD。在本研究中,患有骨量减少或骨质疏松的受试者被归类为“至少骨量减少(T值<-1.0 SD)”。
1.4 统计学处理采用SPSS 19.0软件进行统计分析。连续和分类变量分别以x±s 或百分比表示。研究对象根据血尿酸 (uric acid,UA) 水平分为3组(T1:UA<47 mg/L;T2:47 mg/L≤UA<60 mg/L; T3:UA≥60 mg/L)。采用方差分析(ANOVA)比较3组研究对象的临床变量和BMD差异。应用线性回归分析计算血尿酸水平分组变量与各临床变量间关联关系的趋势P值。临床变量中趋势P值<0.05被定义为“潜在的混杂因素”。因血清25-OHD3和PTH有偏态分布,对其取对数后进行分析。应用Pearson相关系数进行连续变量间相关性研究。使用多元回归分析研究血清尿酸水平与BMD、BTMs、log25-OHD3和logPTH水平的相关性。回归分析前校正以下潜在的混杂因素:模型1包括体质指数(BMI)和eGFR,模型2在模型1基础上还包括调整TG、HDL,模型3在模型2基础上还包括调整FBG、2HC、FINS和HOMA-IR。单因素方差分析比较3组尿酸水平中研究对象BMD和T值的差异。多因素logistic回归分析计算T1和T2组较T3组研究对象发生骨质疏松和发生至少骨量减少(包括骨量减少和骨质疏松)的比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)。最后,将测定过BMD的165名研究对象按较高的UA组(UA≥60 mg/L)和较低UA组(UA <60 mg/L)进行分组,采用独立样本t检验研究BTMs的差异。检验水准(α)为0.05。
2 结 果 2.1 血尿酸浓度与临床变量间的关系 临床变量按尿酸水平分为3组后如表1所示。|
|
表 1 研究对象根据尿酸水平分组的临床数据比较 Tab 1 Comparison of clinical data of groups with different levels of uric acid |
由表1可见,混杂因素包括BMI、TG、FBG、2HC、FINS、HOMA-IR在3个组中均有差异(趋势P<0.05),这些混杂因素与血清尿酸水平呈正相关(r=0.309,P<0.001;r=0.383,P<0.001;r=0.261,P<0.001;r=0.204,P<0.001;r=0.147,P=0.033;r=0.176,P=0.012)。eGFR与HDL和血尿酸水平呈负相关(r=-0.232,P=0.001和r=-0.249,P<0.001)。
2.2 血尿酸浓度和BMD的相关性按尿酸水平分组后,T1组BMD和T值均低于T3组(除全身T值外,其余指标均P<0.05;表2)。根据Pearson相关分析,血尿酸浓度与腰椎、全髋、股骨颈和全身BMD值正相关(r=0.278,P<0.001;r=0.344,P<0.001;r=0.291,P<0.001;r=0.288,P=0.001)。
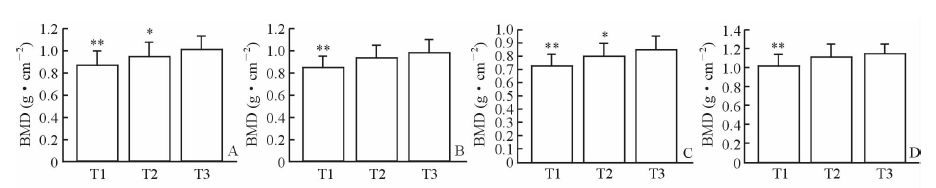
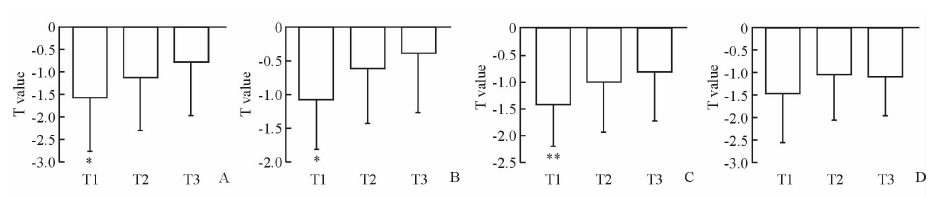
在多元回归分析中分别调整可能的混杂因素(BMI、eGFR、TG、HDL、FBG、2HC、FINS、HOMA-IR)后,模型1、2和3中,血尿酸浓度仍与腰椎、总髋部和全身BMD正相关(表3,P<0.05)。所有部位的BMD值(图1)和T值(图2)随着尿酸水平呈剂量依赖性地增加(趋势P<0.05)。方差分析表明:最低尿酸组(T1) BMD最低(图1),在最高尿酸组(T3)中所有位置BMD均增高(P<0.05);腰椎、全髋和股骨颈T值(图2)在最低尿酸组(T1)也比最高尿酸组(T3)降低(P<0.05)。
|
|
表 2 研究对象根据尿酸水平分组的BMD比较 Tab 2 Comparison of BMD of groups with different levels of uric acid |
|
|
表 3 尿酸与骨密度以及骨代谢标记物的多元回归分析 Tab 3 Multiple regression analysis of uric acid and bone mineral density and bone metabolism markers |
|
图 1 所有部位的骨密度值 Fig 1 Bone mineral density (BMD) of each part A,B,C,and D are the bone mineral density of the lumbar spine,total hip,femoral neck and whole body,respectively. T1: Uric acid (UA) < 47 mg/L; T2: 47 mg/L≤UA < 60 mg/L; T3: UA≥60 mg/L. *P < 0.05,**P < 0.01 vs T3. n=40 for T1,n=121 for T2,n=53 for T3;x±s |
|
图 2 所有部位T值 Fig 2 T value of each part A,B,C,and D are the T values of the lumbar spine,total hip,femoral neck and whole body,respectively. T1: Uric acid (UA) < 47 mg/L; T2: 47 mg/L≤UA < 60 mg/L; T3: UA≥60 mg/L. *P < 0.05,**P < 0.01 vs T3. n=40 for T1,n=121 for T2,n=53 for T3;x±s |
尿酸水平对其发病风险的影响 骨质疏松症和至少骨量减少的整体发病率分别为16.4%和63.6%。骨质疏松症在最低尿酸组(T1)至最高尿酸组(T3)的比例分别为20.0、15.7%和15.1%,至少骨量减少在最低尿酸组(T1)至最高尿酸组(T3)的比例分别为72.5%、66.1%、50.9%。调整潜在的混杂因素后,多因素logistic回归分析显示:以T3组研究对象为参照,T1组研究对象“骨质疏松症”和“至少骨量减少”的OR值分别为1.41(95% CI:0.48~4.14)和2.58(95% CI:1.04~6.37),T2组OR值分别为1.05(95%CI:0.43~2.57)和1.78(95% CI:0.91~3.47)。
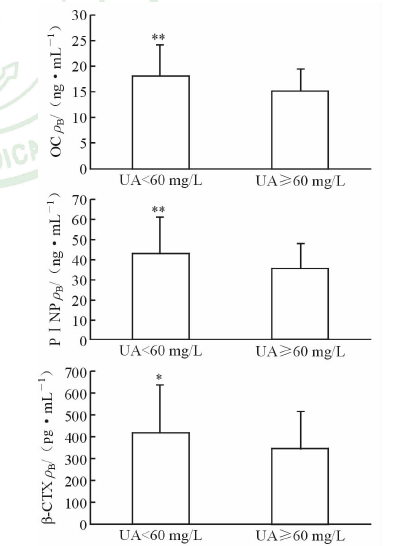
2.4 血尿酸浓度和骨代谢标记物间的相关性Pearson相关系数显示血尿酸浓度与OC负相关(r=-0.149,P=0.029),与logPTH和log25-OHD3正相关(r=0.142,P=0.039;r=0.150,P= 0.032)。多元线性回归分析表明:血尿酸与血清OC水平与log25-OHD3、BMI、eGFR、TG和HDL独立相关(表3)。不同血尿酸浓度BTMs水平见图3,血清OC、PⅠNP和β-CTX水平在低尿酸组(<60 mg/L)高于高尿酸组(≥60 mg/L)。
|
图 3 尿酸浓度与骨代谢标记物的相关性 Fig 3 Correlation between uric acid (UA) concentration and bone metabolism markers *P<0.05,**P<0.01 vs the group of high UA (UA≥60 mg/L). OC: Osteocalcin; PⅠNP: Type Ⅰ amino-terminal propeptide; β-CTX: β-Cross Laps. n=38 for the group of high UA (UA≥60 mg/L),n=127 for the group of low UA (UA<60 mg/L);x±s |
本研究显示,较高的血清尿酸水平与腰椎、总髋部和全身BMD成正比。血尿酸水平与骨钙素水平负相关,与logPTH和log25-OHD3正相关。较低尿酸组(UA<60 mg/L)中血清OC、PⅠNP和β-CTX水平高于高尿酸组(UA≥60 mg/L)。这些证据表明,血尿酸可能对骨代谢发挥保护作用。
尿酸对骨代谢的作用新近才被关注。2011年,Nabipour等[12]首次报道,在1 705例男性人群中发现,血清高尿酸浓度与高BMD值、低骨吸收标记物以及低骨折发病率有密切联系。Makovey等[11]和Ahn等[10]在绝经前后的妇女中证实了尿酸的骨保护作用。然而,这些研究中参与者年龄跨度大,且没有把重点放在“中年”这个关键的转折点[3, 4]。本研究发现,虽然血清尿酸水平与BMD值和骨标记物水平的显著相关性在所有研究对象中表现明显,但当对男性和女性进行性别亚组研究时,该相关性消失。此前也有类似报道,Sritara等[13]研究在1 320例年轻和中年男性中发现血清尿酸水平与骨密度正相关,但在485例年轻和中年女性(包括绝经前和绝经后)中却发现了相反的结果。
BTMs是指与BMD密切相关的血清标记物水平,可有效地反映骨转换率。PⅠNP是由成骨细胞分泌的骨形成最敏感的标记物。另一种成骨细胞来源的分子OC也是骨形成标记物之一。临床研究表明,2型糖尿病、代谢综合征[14]和冠心病[15]患者有着较低的骨钙素水平。在中年男性中,高血清骨钙素水平被证实与较低的腹主动脉钙化的较长的10年生存率相关[16]。本研究发现在低尿酸组(<60 mg/L)中PⅠNP和OC水平较高尿酸组(≥60 mg/L)中水平增高。此外,我们注意到尿酸与OC水平负相关,即使在调整许多混杂因素的影响后,这种相关性仍然存在,与Ahn等[10]在韩国绝经后妇女中的研究结果一致。这些结果表明低尿酸水平的研究对象有着较高的骨形成率。除了骨形成之外,人骨组织连续地通过骨吸收的方式进行改造。随着骨老化,α型C-末端肽(CTX)转化为β型(β-CTX),β-CTX在骨再吸收过程中被释放入血液,可反映骨吸收的增加状态。在本研究中,较低尿酸组β-CTX较高尿酸组β-CTX增高,进一步表明低尿酸组存在较高的骨转换率。
尿酸抑制骨转换的机制目前尚未明确。Ahn等[10]研究认为尿酸的保护作用与其抗氧化作用有关。一些研究报道血尿酸和PTH水平之间存在正相关[12, 17, 18],重组人PTH可引起高尿酸血症[19]。本研究观察到尿酸与logPTH水平正相关,然而,这种相关性较弱,当调整潜在的混杂因素后,相关性消失。但当单独研究其中男性参与者(数据未显示)后发现,PTH浓度在低尿酸水平组(<60 mg/L)高于高尿酸水平组(≥60 mg/L)。PTH可能通过影响肾脏对尿酸的清除[20]而发挥作用,但其具体机制需要进一步阐明。
血清尿酸也可能通过调节1α-羟化酶的活性影响骨代谢[21]。因1,25-(OH)2D3极不稳定,我们未能检测1,25-(OH)2D3的水平,而检测相对稳定的25-OHD3水平。我们发现,log25-OHD3水平与血尿酸水平正相关,调整混杂因素后,这种相关性仍然存在。目前,国内外关于尿酸与维生素D水平之间的相关性结果有所矛盾。在最近1篇侧重于绝经后的中国女性的研究报道中,绝经后妇女的25-OHD3水平和尿酸无显著相关性,然而,他们发现维生素D不足与尿酸升高密切相关[22]。在我们的研究中,虽然尿酸与log25-OHD3在所有研究对象中显著相关,但当研究对象被分为男、女性别亚组时,该相关性消失。有趣的是,当女性研究对象的25-OHD3水平根据尿酸水平分组后,25-OHD3在中间组的尿酸(正常范围)表达最高,该发现可能可以解释25-OHD3和尿酸水平间的不同相关性结果的差异。
综上所述,本研究表明在中国中年健康体检人群中,血清尿酸水平与BMD正相关。高血清尿酸水平的研究对象有着较低的骨质疏松症和骨量减少的发病风险,并具有较低的骨转化水平,提示尿酸具有一定的骨保护作用。由于本研究是横断面研究,故该结论仍有待进一步研究加以明确。
| [1] | O'Neill S, MacLennan A, Bass S, Diamond T, Ebeling P, Findlay D, et al. Guidelines for the management of postmenopausal osteoporosis for GPs[J]. Aust Fam Physician, 2004,33:910-919. |
| [2] | Grzibovskis M, Pilmane M, Urtane I. Today's understanding about bone aging[J]. Stomatologija, 2010,12:99-104. |
| [3] | Cheung E,Tsang S,Bow C,Soong C,Yeung S,Loong C,et al. Bone loss during menopausal transition among southern Chinese women[J]. Maturitas, 2011,69:50-56. |
| [4] | Pi Y Z, Wu X P, Liu S P, Luo X H, Cao X Z, Xie H, et al. Age-related changes in bone biochemical markers and their relationship with bone mineral density in normal Chinese women[J].J Bone Miner Metab,2006,24:380-385. |
| [5] | Johnson R J, Nakagawa T, Jalal D, Sánchez-Lozada L G, Kang D H, Ritz E. Uric acid and chronic kidney disease: which is chasing which?[J].Nephrol Dial Transplant, 2013,28:2221-2228. |
| [6] | Kanbay M, Segal M, Afsar B, Kang D H, Rodriguez-Iturbe B, Johnson R J. The role of uric acid in the pathogenesis of human cardiovascular disease[J]. Heart,2013,99:759-766. |
| [7] | Sautin Y Y, Johnson R J. Uric acid: the oxidant-antioxidant paradox[J].Nucleosides Nucleotides Nucleic Acids,2008,27:608-619. |
| [8] | Masseoud D, Rott K, Liu-Bryan R, Agudelo C. Overview of hyperuricaemia and gout[J].Curr Pharm Des, 2005, 11: 4117-4124. |
| [9] | Donghui M M. Moderate levels of plasma uric acid could promote fracture healing[J]. Med Hypotheses,2010,75:682. |
| [10] | Ahn S H, Lee S H, Kim B J, Lim K H, Bae S J, Kim E H, et al. Higher serum uric acid is associated with higher bone mass, lower bone turnover, and lower prevalence of vertebral fracture in healthy postmenopausal women[J]. Osteoporos Int,2013,24: 2961-2970. |
| [11] | Makovey J, Macara M, Chen J S, Hayward C S, March L, Seibel M J, et al. Serum uric acid plays a protective role for bone loss in peri- and postmenopausal women: a longitudinal study[J]. Bone,2013,52:400-406. |
| [12] | Nabipour I, Sambrook P N, Blyth F M, Janu M R, Waite L M, Naganathan V, et al. Serum uric acid is associated with bone health in older men: a cross-sectional population-based study[J].J Bone Miner Res, 2011,26:955-964. |
| [13] | Sritara C, Ongphiphadhanakul B, Chailurkit L, Yamwong S, Ratanachaiwong W, Sritara P. Serum uric acid levels in relation to bone-related phenotypes in men and women[J]. J Clin Densitom,2013,16:336-340. |
| [14] | Yang R, Ma X, Pan X, Wang F, Luo Y, Gu C, et al. Serum osteocalcin levels in relation to metabolic syndrome in Chinese postmenopausal women[J]. Menopause,2013,20:548-553. |
| [15] | Bao Y, Zhou M, Lu Z, Li H, Wang Y, Sun L, et al. Serum levels of osteocalcin are inversely associated with the metabolic syndrome and the severity of coronary artery disease in Chinese men[J]. Clin Endocrinol (Oxf),2011,75:196-201. |
| [16] | Confavreux C B, Szulc P, Casey R, Boutroy S, Varennes A, Vilayphiou N, et al. Higher serum osteocalcin is associated with lower abdominal aortic calcification progression and longer 10-year survival in elderly men of the MINOS cohort[J]. J Clin Endocrinol Metab, 2013,98:1084-1092. |
| [17] | Hui J Y, Choi J W, Mount D B, Zhu Y, Zhang Y, Choi H K. The independent association between parathyroid hormone levels and hyperuricemia: a national population study[J]. Arthritis Res Ther, 2012,14:R56. |
| [18] | Dalbeth N, Horne A, Gamble G D, Ames R, Mason B, McQueen F M, et al. The effect of calcium supplementation on serum urate: analysis of a randomized controlled trial[J]. Rheumatology (Oxford), 2009,48:195-197. |
| [19] | Miller P D. Safety of parathyroid hormone for the treatment of osteoporosis[J]. Curr Osteoporos Rep,2008,6:12-16. |
| [20] | Collazo R, Fan L, Hu M C, Zhao H, Wiederkehr M R, Moe O W. Acute regulation of Na+/H+ exchanger NHE3 by parathyroid hormone via NHE3 phosphorylation and dynamin-dependent endocytosis[J]. J Biol Chem,2000,275:31601-31608. |
| [21] | Takahashi S,Yamamoto T,Moriwaki Y,Tsutsumi Z,Yamakita J,Higashino K.Decreased serum concentrations of 1,25(OH)2-vitamin D3 in patients with gout[J]. Adv Exp Med Biol, 1998,431:57-60. |
| [22] | Peng H, Li H, Li C, Chao X, Zhang Q, Zhang Y. Association between vitamin D insufficiency and elevated serum uric acid among middle-aged and elderly Chinese Han women[J]. PLoS One,2013,8:e61159. |
 2015, Vol. 36
2015, Vol. 36


