2. 济南军区青岛第一疗养院, 青岛 266071;
3. 青岛大学附属医院急诊神经内科, 青岛 266071
2. Qingdao First Sanatorium, PLA Jinan Military Area Command, Qingdao 266071, Shandong, China;
3. Department of Neurology Emergency, The Affiliated Hospital of Qingdao University, Qingdao 266071, Shandong, China
脑梗死是最常见的脑血管病,梗死后脑组织缺血坏死,再生困难。目前对脑梗死导致的神经功能损伤缺乏有效的治疗手段,仍采取以支持治疗为主的综合治疗方法来改善患者神经功能障碍。间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化潜能的干细胞,近年来,MSCs移植治疗脑梗死已成为重要的研究方向。Nogo-A在髓鞘损伤后具有强烈的抑制轴突生长作用[1]。Nogo-A与其受体NgR结合,介导神经生长抑制作用,是影响神经修复的重要通路[2]。已有实验证实下调Nogo-A或NgR均可促进脑梗死后神经恢复[3]。骨髓间充质干细胞(BMSCs)移植可降低脊髓梗死模型中Nogo-A及NgR的表达,从而减轻神经损伤[4, 5]。但是受到其体积及迁徙能力的影响,MSCs在移植过程中易形成血栓,通过微循环到达病灶发挥作用的细胞数量有限,故其临床应用仍有局限性。
研究发现三维(3-D)水平培养所得球体MSCs能够明显减小MSCs的细胞体积,通过静脉途径移植未发现血管栓塞现象,并且3-D球体培养细胞较普通MSCs归巢效应明显,具有更强的多潜能分化能力[6, 7]。本研究将3-D球体MSCs应用于大鼠大脑中动脉缺血再灌注损伤模型,观察大鼠脑缺血区(海马区)Nogo-A及其受体NgR的变化规律,探讨胎盘来源MSCs移植对脑缺血再灌注损伤大鼠神经功能恢复的作用,以及对大鼠脑缺血区Nogo-A及其受体NgR的影响。
1 材料和方法 1.1 主要仪器及试剂胎盘来源的3-D球体MSCs为清华大学深圳研究生院培养并传代[7, 8],用红色荧光染料DiL标记;Nogo-A、NgR PCR引物及兔抗大鼠Nogo-A、NgR单克隆抗体(南京金斯瑞生物科技有限公司);蛋白质印迹化学发光试剂盒(北京康为生物科技公司)。Centrifuge 5804R型冷冻离心机(德国艾本德生命科学公司);PCR仪(美国Bio-Rad T100 Thermal Cycler);Leica CM1860/1860UV冰冻组织切片机(德国Leica公司)。
1.2 动物分组及处理随机选取健康雄性Wistar大鼠54只,体质量(300±50) g,由山东青岛实验动物中心提供。普通颗粒饲料喂养,饮用自来水。室温控制在14~25℃。随机分为:假手术组(Sham组)、MSCs治疗组(MSCs组)、溶剂处理对照组(Vehicle组),每组再分为移植后1、3、7 d 3个亚组(n=6)。MSCs组和Vehicle组根据改良Longa等[9]的方法制备大脑中动脉闭塞(MCAO)模型,造模前大鼠禁食水24 h,10%水合氯醛腹腔注射麻醉,正中颈部切口,分离并暴露左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),结扎ECA及CCA,夹闭ICA远心端。于CCA近分叉处用眼科剪剪一小口。线栓入ICA,深18.0~20.0 mm。缝合皮肤,以插入鱼线成功开始计时,缺血后2 h给予再灌注处理[鱼线外拉约10 mm恢复大脑中动脉(MCA)供血]。Sham组除鱼线不插入颈内动脉外,其余处理同上。对大鼠进行神经功能评分后选取手术成功的模型,MSCs组于再灌注24 h后腹腔注射移植MSCs,细胞含量5×106个;Vehicle组腹腔注射等容量培养液;Sham组不予处理。
1.3 神经功能评分再灌注清醒时及移植后1、3、7 d测定大鼠神经运动功能并评分,评分标准如下:0分,无明显神经功能缺损;1分,不能伸展右前肢;2分,行走时向右侧旋转;3分,行走时向右侧倾倒;4分,不能自发行走,意识丧失。再灌注清醒时神经功能评分1~3分者为手术成功模型。
1.4 脑组织获取及尼氏染色各组大鼠在移植后1、3、7 d进行神经功能评分后,10%水合氯醛腹腔麻醉,打开胸腔,暴露心脏,剪开右心耳,从左心室快速灌注生理盐水,至流出液透明、动物肝脏及肠系膜苍白,继续以4%多聚甲醛灌注,待动物出现四肢肌肉抽搐后停止灌注,开颅取脑,脑组织固定于多聚甲醛中。自大鼠前囟后4.3 mm处向后切取1.5 mm 脑组织(相当于大脑海马区)制作冰冻切片(厚度20 μm),切片用蒸馏水洗2 min,置于尼氏染液中15 min,双蒸水洗涤2次(数秒),95%乙醇分化约5 s,在显微镜下观察到尼氏体(呈蓝紫色颗粒状或斑片状)后用双蒸水终止分色,常规脱水透明,中性树胶封片。
1.5 RT-PCR测定脑组织Nogo-A、NgR mRNA表达按照RNA提取试剂盒说明书(康为世纪)制备总RNA,反转录反应按照试剂盒说明书操作,采用三步RT-PCR法测定Nogo-A、NgR mRNA含量。Nogo-A引物序列:上游5′-CGC TGG TGC TTC TGT AGT GC-3′,下游5′-CTT TGT GCT GGG CTA CTG-3′(扩增产物470 bp)。NgR引物序列:上游5′-ACA GTC TTG ACC GTC TCC TCT TGC-3′,下游5′-TGG CTA CGG GTG CGG TTC TT-3′(扩增产物679 bp)。Nogo-A及NgR扩增条件:95℃预变性3 min;94℃变性1 min、56℃退火40 s、72℃延伸1 min,进行30个循环。β-actin引物序列:上游5′-CCT TCC TGG GCA TGG AGT CCT G-3′;下游5′-GGA GCA ATG ATC TTG ATC TTC-3′(扩增产物208 bp)。β-actin扩增条件:94℃预变性5 min; 94℃变性40 s、55℃退火40 s、72℃延伸40 s,进行30个循环。最后72℃延伸10 min。1%琼脂糖凝胶电泳,凝胶成像分析系统成像,ID Image Analysis Software半定量分析。
1.6 蛋白质印迹法测定脑组织Nogo-A、NgR蛋白表达取冰冻脑组织梗死区用生理盐水匀浆后,加入蛋白裂解液,离心后取上清液定量,上样量为20 μg,以10% SDS凝胶进行电泳分离,然后将蛋白转移至PVDF膜上。5%脱脂牛奶封闭1 h,加入一抗(1∶100),4℃孵育过夜,TBST溶液充分洗膜3次后,加入辣根过氧化物酶标记的二抗(1∶10 000),37℃孵育1 h,TBST溶液洗膜。ECL法发光,放入X线夹片中曝光,显影,然后进行拍照;用Image J软件分析各组蛋白相对比值。
1.7 统计学处理采用SPSS 17.0软件进行数据处理,数据以x±s表示,所得数据经正态分析和方差齐性检验后,组间比较采用单因素方差分析,检验水准(α)为0.05。
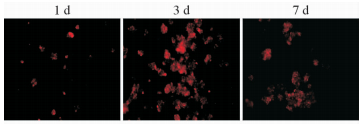
2 结 果 2.1 MSCs在脑组织中的分布冰冻切片荧光显微镜观察DiL标记的移植MSCs细胞,结果(图 1)可见,MSCs组在脑损伤大鼠海马CA1区有红色荧光信号表达,表明MSCs移植入脑组织并存活良好。
|
图 1 大鼠脑组织海马区标记MSCs分布 Fig 1 Rat hippocampus brain tissue distribution of labeled MSCs MSCs: Mesenchymal stem cells. Original magnification:×100 |
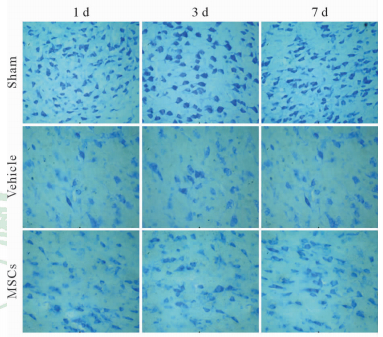
Sham组神经细胞形态完好,大小一致,分布较密集,细胞内尼氏体含量丰富,分布均匀;Vehicle组神经细胞内尼氏体消失,仅少量细胞可见残留尼氏体;MSCs组较Vehicle组胞内尼氏体增多,肿胀细胞内可见尼氏体分布(图 2)。
|
图 2 大鼠脑组织海马区神经元尼氏染色 Fig 2 Nissl staining of neurons in rat hippocampus MSCs: Mesenchymal stem cells. Original magnification:×100 |
Sham组大鼠神经运动功能正常,Vehicle组、MSCs组大鼠均出现右侧肢体功能异常,向右侧(瘫痪侧)旋转、倾倒,提尾悬空可出现右前肢伸展异常。与Vehicle组相比,MSCs组移植后1、3 d神经功能无明显改善,移植后7 d神经功能明显改善,差异有统计学意义(P<0.05,表 1)。
|
|
表 1 各组大鼠不同时间点神经运动功能评分 Tab 1 Neuromotor function score of each group rats at different time points |
结果(表 2)表明:Sham组移植后1、3、7 d Nogo-A mRNA和蛋白表达量均较低;Vehicle组Nogo-A mRNA和蛋白表达量的变化规律为移植3 d后表达量较Sham组增多(P<0.05),7 d回归正常水平;MSCs组移植后1、3、7 d Nogo-A mRNA和蛋白表达量均低于Vehicle组(P<0.05)。Sham组移植后1、3、7 d NgR mRNA和蛋白表达量均较低;Vehicle组表达量在各时间点均较Sham组增多(P<0.05);MSCs组的表达量在各时间点均低于Vehicle组(P<0.05)。
|
|
表 2 各组大鼠脑组织不同时间点Nogo-A及NgR mRNA和蛋白的表达量 Tab 2 mRNA and protein expression of Nogo-A and NgR at different time points in each group |
近年来脑梗死后的神经再生及功能恢复问题备受关注。本研究结果提示胎盘来源的3-D球体MSCs可以改善大鼠脑梗死后的神经功能恢复,机制可能涉及多方面,其中Nogo-A的作用不容忽视。早期神经元再生失败的主要原因是存在Nogo、髓鞘相关糖蛋白(MAG)、少突胶质细胞髓鞘糖蛋白(OMgp)等髓磷脂抑制物的过表达[10, 11]。这3种抑制因子均与相同的受体Nogo受体(NgR)结合[12]。而Nogo-A是已知最强的轴突再生抑制蛋白[1]。因此,Nogo-A及其受体NgR的研究已成为热点。Cajal[13]研究发现,中枢神经系统轴突损伤后开始发芽,但很快发生退变,推测中枢神经系统中存在抑制轴突生长的因子。Nogo-A是中枢神经系统髓鞘磷脂中最重要的一种抑制轴突生长的因子,广泛表达于成年大鼠神经元和少突胶质细胞中。Nogo-A 通过结合NgR激活细胞内RhoA信号通路,抑制神经轴突的生长和诱导生长锥塌陷[14]。许多研究已证明,应用Nogo-A和NgR拮抗剂降低其表达可以改善神经功能。Liebscher等[15]发现,应用Nogo-A特异性抗体(IL-1)可以促进脊髓损伤模型恢复。Fischer等[16]应用NgR阻断剂阻断大鼠Nogo受体后发现可促进轴突再生。
干细胞移植技术是近年来神经再生研究的热点。MSCs具有向外胚层来源的神经系细胞定向分化的潜能,并能分泌多种神经营养因子以促进神经再生[17, 18, 19];且具有来源广泛,易于采集、制备及保存,避免免疫排斥反应,不涉及社会、伦理及法律等问题的优点[20]。本研究应用3-D球体MSCs更是克服了普通干细胞体积过大的缺点,使MSCs能够更顺利通过肺循环和血脑屏障,到达病变部位,发挥更强的修复作用。
本研究观察了3-D球体MSCs移植对脑缺血再灌注后脑组织Nogo-A及NgR的表达水平及对缺血再灌注损伤大鼠神经功能的作用。结果显示,移植MSCs出现在大鼠脑组织内,表明3-D球体MSCs顺利通过肺循环及血脑屏障,进入脑组织发挥作用,改善了大鼠神经功能。RT-PCR法和蛋白质印迹法检查结果显示,在Vehicle组的多个时间点Nogo-A表达水平较Sham组增加,其趋势为移植后1 d开始增加,移植后3 d增加较明显,移植后7 d恢复到正常水平,与闫凤霞等[21]的研究结果一致;而NgR的表达水平在移植后1 d开始增加,移植后3 d增加明显,移植后7 d仍处于较高水平。Nogo-A和NgR的表达水平不同步的原因可能为NgR同时为Nogo、MAG、OMgp的受体。而MSCs组海马中Nogo-A及NgR水平在移植后1、3、7 d均较Vehicle组下降,差异有统计学意义(P<0.05)。结果提示MSCs进入大鼠脑组织后通过下调Nogo-A及NgR的表达从而达到了改善大鼠神经功能的效果。
综上所述,胎盘来源的3-D球体MSCs可以有效保护脑缺血再灌注损伤脑组织,改善神经运动功能,其可能的机制是下调脑梗死后脑组织Nogo-A及其受体NgR的表达。
| [1] | Chen M S, Huber A B, van der Haar M E, Frank M, Schnell L, Spillmann A A, et al. Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1[J].Nature,2000,403:434-439. |
| [2] | Budel S, Padukkavidana T, Liu B P, Feng Z, Hu F, Johnson S, et al. Genetic variants of Nogo-66 receptor with possible association to schizophrenia block myelin inhibition of axon growth[J].J Neurosci,2008,28:13161-13172. |
| [3] | Wang T,Wang J,Yin C,Liu R,Zhang J H,Qin X.Down-regulation of Nogo receptor promotes functional recovery by enhancing axonal connectivity after experimental stroke in rats[J].Brain Res,2010,1360:147-158. |
| [4] | Tohda C,Kuboyama T.Current and future therapeutic strategies for functional repair of spinal cord injury[J].Pharmacol Ther, 2011, 132:57-71. |
| [5] | Shen L H, Li Y, Chen J, Cui Y, Zhang C, Kapke A, et al. One-year follow-up after bone marrow stromal cell treatment in middle-aged female rats with stroke[J]. Stroke, 2007, 38: 2150-2156. |
| [6] | Bartosh T J, Ylostalo J H, Mohammadipoor A, Bazhanov N, Coble K, Claypool K, et al.Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties[J]. Proc Natl Acad Sci USA,2010,107:13724-13729. |
| [7] | Guo L, Ge J, Zhou Y, Wang S, Zhao R C, Wu Y. Three-dimensional spheroid-cultured mesenchymal stem cells devoid of embolism attenuate brain stroke injury after intra-arterial injection[J]. Stem Cells Dev, 2014, 23: 978-989. |
| [8] | Li Z, Liu C, Xie Z, Song P, Zhao R C, Guo L, et al. Epigenetic dysregulation in mesenchymal stem cell aging and spontaneous differentiation[J].PLoS One, 2011, 6: e20526. |
| [9] | Longa E Z,Weinstein P R,Carlson S,Cummins R.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84-91. |
| [10] | Mueller B K, Mack H, Teusch N. Rho kinase, a promising drug target for neurological disorders[J].Nat Rev Drug Discov,2005,4:387-398. |
| [11] | Yamashita T, Fujitani M, Yamagishi S, Hata K, Mimura F. Multiple signals regulate axon regeneration through the Nogo receptor complex[J].Mol Neurobiol,2005,32:105-111. |
| [12] | Schimmele B, Plückthun A. Identification of a functional epitope of the Nogo receptor by a combinatorial approach using ribosome display[J].J Mol Biol,2005,352:229-241. |
| [13] | Cajal S R. Degeneration & regeneration of the nervous system (History of Neuroscience, No 5) [M].London:Oxford University Press, 1991:478-484. |
| [14] | Woolf C J, Bloechlinger S. It takes more than two to Nogo[J].Science,2002,297:1132-1134. |
| [15] | Liebscher T,Schnell L,Schnell D,Scholl J,Schneider R,Gullo M,et al.Nogo-A antibody improves regeneration and locomotion of spinal cord-injured rats[J].Ann Neurol,2005,58:706-719. |
| [16] | Fischer D, He Z, Benowitz L I. Counteracting the Nogo receptor enhances optic nerve regeneration if retinal ganglion cells are in an active growth state[J].Neurosci,2004,24:1646-1651. |
| [17] | Peng J, Wang Y, Zhang L, Zhao B, Zhao Z, Chen J, et al. Human umbilical cord Wharton's jelly-derived mesenchymal stem cells differentiate into a Schwann-cell phenotype and promote neurite outgrowth in vitro[J].Brain Res Bull, 2011,84:235-243. |
| [18] | Lim J Y, Park S I, Kim S M, Jun J A, Oh J H, Ryu C H, et al. Neural differentiation of brain-derived neurotrophic factor-expressing human umbilical cord blood-derived mesenchymal stem cells in culture via TrkB-mediated ERK and-catenin phosphorylation and following transplantation into the developing brain[J].Cell Transplant, 2011, 20: 1855-1866. |
| [19] | 曲学彬,王 贝,罗梦娇,郭 瑞,王会平,张 强,等. 过表达少突胶质细胞转录因子2加速小鼠胚胎干细胞分化为神经元-胶质细胞抗原2阳性少突胶质祖细胞样细胞[J]. 解剖学杂志,2014,37:480-481,486. |
| [20] | Ringden O, Le Blanc K. Mesenchymal stem cells for treatment of acute and chronic graft-versus-host disease, tissue toxicity and hemorrhages[J].Best Pract Res Clin Haematol,2011,24:65-72. |
| [21] | 闫凤霞, 李永刚, 王守彪.局灶性脑缺血再灌注大鼠 Nogo-A mRNA 的表达[J].神经解剖学杂志,2004,4:394-398. |
 2015, Vol. 36
2015, Vol. 36


