铜绿假单胞菌(Pseudomonas aeruginosa),又称绿脓杆菌,是一种条件致病菌,在正常人的皮肤、呼吸道和肠道等均有此菌存在,是医院内感染的主要病原菌之一。当机体抵抗力下降、重大疾病创伤、免疫缺陷以及烧伤后极易诱发感染,严重时可导致威胁生命的感染性休克[1]。目前,该菌感染的治疗方法主要采用抗生素,但存在耐药性不断提高的问题,因此,人们一直在寻找有效的防治对策[2]。已知的铜绿假单胞菌外膜蛋白(outer membrance protein,Opr)有20多种,其中免疫原性高的有OprH、OprF和OprI 3种。OprH具有由8个β片层组成的跨膜桶状结构和4个大小不等的胞外环,与脂多糖存在直接的相互作用,并与细菌外膜的稳定性和抗生素耐药性相关[3]。OprH免疫兔产生的抗体可与不同菌株的铜绿假单胞菌发生特异性的凝集反应,表明其可能是一种重要的免疫保护抗原,在疫苗研发上有很好的应用前景[4, 5, 6]。
本实验通过获得铜绿假单胞菌OprH蛋白的重组高表达菌株,纯化OprH蛋白,制备小鼠OprH抗血清,然后对小鼠免疫OprH蛋白,攻毒铜绿假单胞菌,考察OprH的免疫保护功能。并采用正交试验筛选OprH最适的培养与诱导表达条件,为OprH工业化生产、蛋白亚单位疫苗研究奠定基础。
1 材料和方法 1.1 材料铜绿假单胞菌PAO1、E.coli DH5α菌株、E.coli BL21、pET-32a质粒均由陕西理工学院生化与分子菌种中心保存;引物、基因测序由北京鼎国生物技术有限公司完成;昆明小鼠由西安交通大学动物实验中心提供,合格证号:SCXK(陕)2010-001;Taq 酶、T4 DNA 连接酶、限制性内切酶BamHⅠ与XhoⅠ、DNA Marker与Protein Marker购于大连宝生物公司;质粒提取试剂盒和胶回收试剂盒购于西安沃尔森生物技术有限公司;酵母提取物、蛋白胨以及异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)购于美国MP公司。
1.2 OprH重组菌株的构建依据NCBI公布的铜绿假单胞菌PAO1 OprH基因序列,使用Primer软件设计引物。 引物1: 5′-ACA GGA TCC ATG AAA GCA CTC AAG ACT-3′,引物2: 5′-ACT CTC GAG TTA GAA CTT GTA GTT GGC-3′,下划线为内切酶BamHⅠ和XhoⅠ的酶切位点。PCR反应体系及条件与作者前期研究[7, 8]一致。将PCR产物与pET-32a质粒双酶切,经连接酶连接后,转化E.coli DH5α菌株,构建重组OprH克隆菌株。培养重组菌株,提取获得重组质粒,再经过双酶切及序列测序检测后,转化E.coli BL21菌株,最终获得OprH表达菌株。
1.3 OprH蛋白的表达鉴定与纯化于培养皿中选取重组子培养16 h,转接培养至D600约0.8 h,加入适量的IPTG诱导,培养7 h后,将获得的菌体进行蛋白电泳检测。待检测正确表达后,大量培养OprH菌株,超声破碎细菌,结合蛋白电泳切胶的方法,按照作者前期研究的方法[8]对OprH蛋白进行纯化。
1.4 OprH蛋白原核表达条件的筛选利用L9(34)正交试验设计方法[9],筛选OprH最适培养条件与诱导表达条件。OprH菌株培养条件正交试验主要步骤为:取单菌落入LB培养液中,培养16 h后,以1∶100转接菌体入含LB培养基的250 mL培养瓶中,并按照正交试验设计的要求对菌体进行培养,记录获得的菌液D600值[10]。OprH菌株诱导表达条件正交试验主要步骤为:依据OprF菌株的最适培养条件[11],培养菌液浓度至不同D600值,再按照正交试验模型的要求,加入不同浓度的IPTG诱导,收集沉淀加入适量的蛋白上样缓冲液,并加样10 μL进行蛋白电泳检测。最后,将获得的电泳图谱经Phoretix 1D软件分析OprH蛋白D值。
1.5 小鼠OprH多克隆抗体制备选取健康的5周龄雄性昆明小鼠15只,按照作者前期研究的方法[8]进行OprH蛋白的小鼠免疫。每只小鼠每次免疫50 μg,共免疫3次。最后眼部取血获得OprH抗血清。
1.6 ELISA和蛋白质印迹法检测OprH抗血清效价与特异性将纯化的OprH蛋白溶解至5 μg/μL,在对应的96孔板中加入100 μL作为抗原,37℃ 孵育3 h;倒空液体,PBS洗涤,加入适量的封闭液,充分孵育2 h;然后,每孔加100 μL不同稀释度的OprH抗血清,室温孵育1 h,洗涤后加入100 μL二抗(1∶3 000),室温孵育1 h。最后,显色液显色10 min后,加入终止液终止显色,450 nm处读取D值[12]。
通过蛋白质印迹法[7]检测OprH抗血清特异性,步骤为:将OprH表达菌株进行SDS-PAGE,转NC膜,封闭液封闭后,于OprH抗血清中孵育,并加入二抗,最后DAB显色。
1.7 重组OprH蛋白对小鼠的免疫保护实验实验组和对照组各选用15只雄性昆明小鼠,按照作者前期研究的方法[8]进行免疫。第3次免疫7 d后,以1.0×107 CFU单位的铜绿假单胞菌进行小鼠腹腔攻毒实验,记录小鼠的死亡情况。依据公式:保护率(%)= (1-实验组死亡率/对照组死亡率) ×100%,计算OprH蛋白的免疫保护作用[13]。
1.8 统计学处理应用SPSS 13.0软件进行统计学分析,菌株培养条件与蛋白诱导表达图谱的光密度值正交实验数据以x±s表示,组间比较采用单因素方差分析。计数资料采用χ2检验。检验水准(α)为0.05。
2 结 果 2.1 OprH重组质粒的构建以提取的铜绿假单胞菌基因组DNA为模板进行PCR扩增。图 1A中显示PCR获得与预期大小一致的目的基因片段。将PCR获得的OprH基因连接入pET-32a质粒,转化E. coli DH5α菌株;提取质粒,用BamH Ⅰ和Xho Ⅰ双酶切重组质粒获得603 bp片段(图 1B),与OprH基因大小一致。重组基因的序列测定结果与NCBI公布的OprH基因相同。
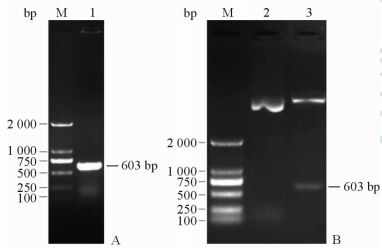
|
图 1 铜绿假单胞菌OprH重组质粒构建 Fig 1 Construction of recombinant plasmid of P. aeruginosa OprH gene A: OprH gene by PCR; B: OprH recombinant plasmid testing. OprH: Outer membrane protein H; P.aeruginosa: Pseudomonas aeruginosa; M: DNA marker; 1: OprH gene 2: Recombinant plasmid of OprH gene; 3: OprH recombinant plasmid digested with BamH Ⅰ and Xho Ⅰ |
重组表达菌株经IPTG诱导后,获得大小为42 000的条带:OprH (21 574),pET-32a质粒蛋白标签(20 400)。OprH重组蛋白的表达结果与预期一致,并通过蛋白电泳切胶纯化获得OprH重组蛋白(图 2)。
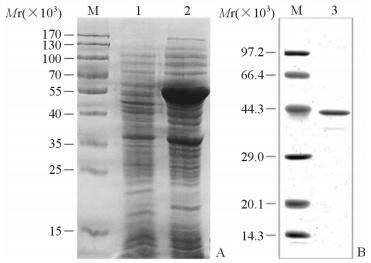
|
图 2 铜绿假单胞菌OprH蛋白表达(A)与纯化(B) Fig 2 Expression (A) and purification (B) of P. aeruginosa OprH protein OprH: Outer membrane protein H; P.aeruginosa: Pseudomonas aeruginosa; IPTG: Isopropy-β-D-thiogalactoside. M: Protein marker; 1: Not induced; 2: IPTG induced; 3: OprH protein purification |
依据L9(34) 正交实验设计,获得OprH表达菌株培养条件的实验结果见表 1。结果可知各因素对培养条件的影响程度依次为C>A>B,葡萄糖浓度、转速及装液量因子对培养条件的影响均具有统计学意义(F=26.404,P<0.01;F=10.512,P<0.01;F=70.916,P<0.01)。通过比较表 1中获得的K1、K2和K3各个试验组合,获得OprH表达菌株最佳培养条件为组合A1B3C1,即培养液中葡萄糖浓度为0,转速230 r/min,装液量50 mL。
|
|
表 1 铜绿假单胞菌OprH重组菌株培养条件试验 Tab 1 Culturing condition of P. aeruginosa OprH recombinant strain |
通过正交试验设计,结合SDS-PAGE蛋白电泳检测OprH的表达情况,3次重复,获得OprH蛋白表达图谱;然后利用Phoretix 1D软件分析蛋白条带,获得OprH蛋白条带的光密度值实验结果(表 2)。结果可知各因素对OprH表达的影响程度依次为H>G>E>F;菌液浓度、IPTG诱导终浓度、诱导温度及诱导时间4个因素对OprH表达的影响均具有统计学意义(F=72.354,P<0.01;F=40.721,P<0.01;F=79.707,P<0.01;F=229.273,P<0.01)。
通过比较表 2中获得的K1、K2和K3各个试验组合,获得OprH最佳诱导表达条件为E2F2G1H2,即菌液D600值0.8,IPTG诱导终浓度为0.3 mmol/L,诱导时间3 h,诱导温度32℃。
|
|
表 2 铜绿假单胞菌OprH表达诱导条件 Tab 2 Inducing condition of P. aeruginosa OprH expression |
通过酶联法发现OprH抗血清效价达1∶1 600(图 3)。利用蛋白质印迹法,发现不同稀释度的OprH抗血清均有对应的条带出现,而对照未检测到相应的条带(图 4)。证明获得的重组OprH蛋白抗血清与OprH蛋白可以特异性地结合。
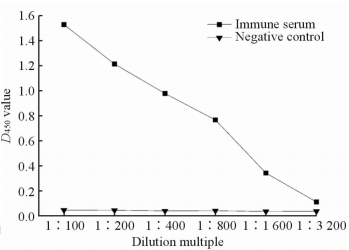
|
图 3 铜绿假单胞菌OprH抗血清效价的鉴定 Fig 3 Identification of P. aeruginosa OprH antiserum titer OprH: Outer membrane protein H; P.aeruginosa: Pseudomonas aeruginosa |

|
图 4 铜绿假单胞菌OprH抗血清特异性的蛋白质印迹法检测 Fig 4 Identification of the specificity of P. aeruginosa OprH antiserum by Western blotting analysis OprH: Outer membrane protein H; P.aeruginosa: Pseudomonas aeruginosa |
小鼠经3次OprH蛋白免疫后,攻毒绿脓杆菌致病菌,发现48 h内小鼠死亡率最高,且活动呆滞、毛发蓬松、拒绝进食;4 d后,小鼠死亡率明显下降。结果显示,OprH免疫小鼠激活的特异性免疫对小鼠绿脓杆菌感染的保护率达到46.15 %,与对照组相比较差异具有统计学意义(P<0.05,表 3)。
|
|
表 3 小鼠免疫铜绿假单胞菌OprH及攻毒铜绿假单胞菌致病菌 Tab 3 Immunity of P.aeruginosa OprH and challenging P.aeruginosa pathogenic bacteria in mice N=15 |
OprH是铜绿假单胞菌的主要外膜蛋白,具有很强的免疫原性[4],研究发现铜绿假单胞菌感染患者中OprH抗血清具有普遍性[14],有人还将OprH和OprF构建融合蛋白,获得的抗血清可与不同种类铜绿假单胞菌发生特异性的凝集反应,为疫苗研究奠定基础[5]。本实验对小鼠免疫OprH蛋白,小鼠在饮食、精神状态上也无较大变化,表明重组蛋白对小鼠的毒害作用很小。制备的OprH小鼠多克隆抗体效价达到1∶1 600,效价偏低,可能是采用小鼠免疫获得的抗血清缘故[10]。实验也证实OprH蛋白对小鼠铜绿假单胞菌感染具有免疫保护作用,为OprH蛋白免疫学功能研究提供依据。
鉴于OprH重要的免疫学功能,有必要通过基因工程手段获得高表达的工程菌株[15, 16]。本研究采用正交试验设计方法,进行铜绿假单胞菌OprH蛋白的原核表达研究,结果证实OprH表达菌株最佳培养条件为:培养液无需添加葡萄糖,转速230 r/min,装液量50 mL;最佳OprH蛋白诱导条件为:加IPTG菌液D600值0.8,IPTG诱导终浓度0.3 mmol/L,诱导时间3 h,诱导温度32℃。有实验发现提高培养液转速可促进氧气与营养的供给,利于菌体的生长[9, 17],本实验也认为提高培养液的转速利于菌体生长。有研究发现长时间诱导可抑制目的蛋白产物的生成,且长时间诱导提高生产成本,因而实际生产中需要采用合适的诱导时间[18]。IPTG有细胞毒性,不利于菌体蛋白表达,生产中应采用低浓度IPTG诱导。低温诱导利于活性蛋白形成,也利于包涵体的形成[9],与本研究结果一致,生产中应采用低温诱导。因而,OprH工程菌蛋白发酵可按两步法进行:(1)IPTG诱导前,尽量增加培养液的转速,从而提高菌体生长的速度;(2)IPTG诱导时,选取菌体对数生长期诱导,低温、低浓度IPTG诱导,且选择适当的诱导时间。
| [1] | 邵圣文, 杨红霞, 徐伯赢, 张建国, 张 慧, 陈 亮. 铜绿假单胞菌生物膜致豚鼠下呼吸道感染分析[J]. 中国公共卫生, 2010, 26:1388-1389. |
| [2] | Krylov V N. Bacteriophages of Pseudomonas aeruginosa: long-term prospects for use in phage therapy[J]. Adv Virus Res, 2014, 88: 227-278. |
| [3] | Edrington T C, Kintz E, Goldberg J B, Tamm L K. Structural basis for the interaction of lipopolysaccharide with outer membrane protein H (OprH) from Pseudomonas aeruginosa[J]. J Biol Chem, 2011, 286: 39211-39223. |
| [4] | Michelim L, Medeiros G S, Zavascki A P. Current status of Pseudomonas aeruginosa vaccine[J]. Curr Pharm Biotechnol, 2014, 14: 951-959. |
| [5] | 徐 波, 曹郁生, 陈 燕, 郭兴华. 乳酸乳球菌食品级诱导表达系统的构建及异源蛋白的表达[J]. 微生物学报, 2007, 47: 604-609. |
| [6] | Soldatenkova A V, Geǐderova L A, Akhmatova N K, Mikhaǐlova N A. [Pseudomonas aeruginosa recombinant proteins: effect on mice cytokine profile] [J]. Zh Mikrobiol Epidemiol Immunobiol, 2013, 6: 80-87. |
| [7] | 刘 祥, 陈春琳, 牟 欢, 吴三桥, 张 涛, 张晓娟. 重组人骨硬化蛋白的表达、纯化及多克隆抗体制备[J]. 生物技术, 2014, 24: 68-72. |
| [8] | 刘 祥, 陈春琳, 王杨科, 俱 雄, 吴三桥, 张 涛. 小鼠骨桥蛋白的原核表达及多克隆抗体的制备与鉴定[J]. 中国畜牧兽医, 2015, 42: 1069-1075. |
| [9] | 刘 祥, 李 惠. 大肠埃希菌外膜蛋白OmpA表达质粒构建和诱导条件优化[J]. 生物技术, 2013, 23: 32-36. |
| [10] | 刘 祥. 溶藻弧菌附着定植因子ACFA原核载体构建、表达条件优化及多克隆抗体制备[J]. 华北农学报, 2015, 30: 35-41. |
| [11] | 刘 祥. 铜绿假单胞菌外膜蛋白 F 原核载体构建、表达条件优化及免疫保护作用研究[J]. 中国现代医学杂志, 2015, 25: 12-16. |
| [12] | 刘 祥. 福氏志贺菌2型外膜蛋白A的原核表达及多克隆抗体的制备[J]. 动物医学进展, 2015, 36: 6-10. |
| [13] | 俱 雄, 陈春琳, 刘 祥, 张 涛, 吴三桥, 张晓娟. 大肠埃希菌外膜蛋白OmpC的原核表达与免疫保护作用研究[J]. 生命科学研究, 2015, 19: 131-136. |
| [14] | Montor W R, Huang J, Hu Y, Hainsworth E, Lynch S, Kronish J W, et al. Genome-wide study of Pseudomonas aeruginosa outer membrane protein immunogenicity using self-assembling protein microarrays[J]. Infect Immun, 2009, 77: 4877-4886. |
| [15] | 刘 祥. 小鼠骨形成蛋白BMP3的原核表达及多克隆抗体制备与鉴定[J]. 华北农学报, 2015, 30: 8-13. |
| [16] | 刘 祥, 俱 雄, 陈春琳. 重组大肠埃希菌外膜蛋白OmpT的载体构建和表达条件优化及多克隆抗体制备[J]. 湖南农业大学学报(自然科学版), 2015, 41: 350-355. |
| [17] | Xu M, Sun Q, Su J, Wang J F, Xu C, Zhang T, et al. Microbial transformation of geniposide in Gardenia jasminoides Ellis into genipin by Penicillium nigricans[J]. Enzyme Microb Tech, 2008, 42: 440-444. |
| [18] | Studier F W. Protein production by auto-induction in high density shaking cultures[J]. Protein Expr Purif, 2005, 41: 207-234. |
 2015, Vol. 36
2015, Vol. 36


