2. 解放军411医院影像科, 上海 200081;
3. 第二军医大学长海医院病理科, 上海 200433
2. Department of Radiology, No.411 Hospital of PLA, Shanghai 200081, China;
3. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
Castleman病 (Castleman disease,CD) 又称巨淋巴结增生症或血管滤泡性淋巴结增生,是一种原因未明的以淋巴组织增生为特点的淋巴结病[1, 2, 3]。该病可发生在全身淋巴结存在的任何部位,因为临床少见、缺乏特异性并且国内相关文献报道较少,所以术前误诊、漏诊率较高。本研究回顾性分析了2012年11月至2014年2月第二军医大学长海医院收治的20例CD患者的影像学、病理和临床资料,并结合文献复习加以分析,以提高对此病的认识。
1 资料和方法 1.1 一般资料回顾性分析2012年11月至2014年2月经病理确诊的CD患者20例,其中男性11例,女性9例;年龄20~74岁,平均(47±13)岁。
1.2 扫描设备和方法20例患者术前进行影像学检查,其中12例行CT检查,8例行MRI检查。所有患者检查前均签署知情同意书,接受CT检查的患者于检查前20~30 min行碘对比剂过敏试验。
CT扫描设备为德国西门子64层螺旋CT扫描机。扫描条件:120 kV,180 mA。扫描参数:准直0.6 mm,层厚0.6 mm,重建间隔3.0 mm,螺距为1.0,矩阵512×512,视野348 mm×348 mm。对比剂为碘海醇,300 mgI/mL,总量90~95 mL,注射流率3.0~4.0 mL/s,经前臂静脉由高压注射器团注,继之注射98 mL生理盐水以同样流率冲洗。采用3期增强扫描,分别于注射对比剂后20~25 s、60~70 s、110~130 s行动脉期、静脉期和延迟期3期扫描。
MRI扫描设备为德国西门子Avanto 1.5 T MRI扫描仪,用体线圈进行扫描。扫描序列包括:(1)横轴面脂肪抑制T1WI:TR 2~600 ms,TE 5~11 ms,层厚5 mm,层间距1 mm,FOV 300 mm×400 mm,采集矩阵178×320。(2)横断面脂肪抑制T2WI:TR 4 000~6 500 ms,TE 60~100 ms,层厚5 mm,层间距1 mm,FOV 300 mm×400 mm,采集矩阵(200~300)×(380~512)。(3)胸腹部采用三维容积内插块快速扰相梯度回波(three-dimensional volumetric interpolated breath-hold examination,3D-VIBE) T1WI序列:TR 2.58~2.65 ms,TE 1.18~5.77 ms,层厚5 mm,无层间距,FOV 300 mm×400 mm,采集矩阵178×320。对比剂为Gd-DTPA,0.1 mL/kg,注射流率2 mL/s,经前臂静脉由高压注射器注入,继之以同样流率注射20 mL生理盐水冲洗。颈部增强采用于注射对比剂后25~30 s、60~70 s行动脉期、静脉期的两期扫描;胸腹部增强采用于注射对比剂后15 s、20 s、40 s行动脉期、静脉期和延迟期3期扫描。
1.3 图像分析阅片由两位从事影像诊断工作10年以上的放射科医生共同完成,对于分析结果不一致者共同讨论取得一致意见。主要记录病灶的大小、形态、数量(单发肿块、多发肿块)、边界(清楚光整、清楚并分叶、不清楚)、密度或信号(均匀、不均匀),有无钙化,有无伴发其他病变(胸水、腹水),动态增强后强化的程度、方式(与同层面主动脉比较,并绘制出时间信号曲线)、强化后病灶内部均匀程度,病灶内外有无供血血管。强化程度分为无强化(0~10 HU)、轻度强化(11~20 HU)、中度强化(21~40 HU)、明显强化(41~60 HU)和显著强化(61 HU以上)。
2 结 果 2.1 肿瘤影像学表现CT平扫呈等密度,MRI平扫T1WI呈等信号、T2WI呈高信号,未见到钙化、出血和坏死;增强后CT和MRI强化方式相同(表1、表2)。2例典型患者的影像学和病理表现见图1、图2。
|
|
表 1 CD各亚型患者影像学平扫特征 |
|
|
表 2 CD各亚型患者影像学增强特征 |
|
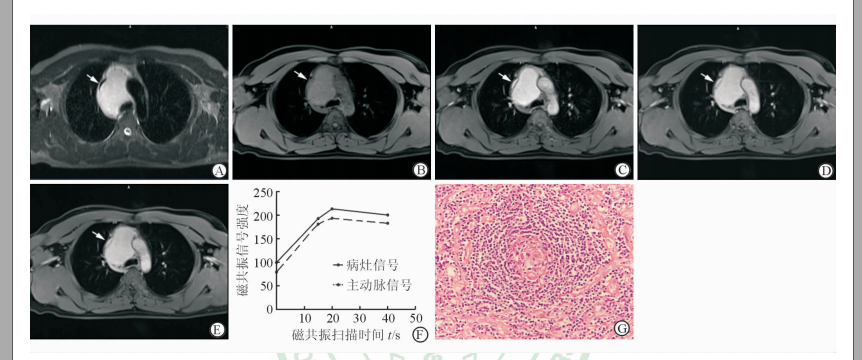
图 1 单中心透明血管型CD患者的MRI和病理表现 34岁男性患者,纵隔肿块. A,B:分别为MRI平扫横断面T2WI和T1WI图,可见前纵隔有一枚大小约4.1 cm × 7.2 cm的均质的软组织块影,肿块呈浅分叶状,边缘光整,与周围结构分界清楚,T1WI呈等信号,T2WI呈高信号,T2WI上在肿块边缘可见流空的血管影(白色箭头所示);C~E:分别为横断面T1WI三期增强图,可见肿块明显均匀强化,动脉期显著强化,延迟后持续强化,病灶边缘可见增粗的供血血管影(白色箭头所示);F:病灶和同层面主动脉的时间信号曲线,两者强化方式相同;G:镜下滤泡周围淋巴细胞增生显著,呈多层环形排列形成洋葱皮样结构,中央可见玻璃样变的血管(H-E染色. Original magnification:×400) |
|
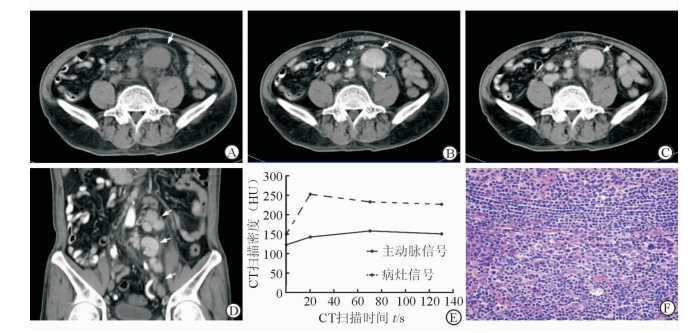
图 2 多中心浆细胞型CD患者的CT和病理表现 68岁男性患者,腹腔多发肿块。A:横断面CT平扫图,可见腹膜后有多枚大小不等的软组织块影,内部均匀,边缘光整,边界清楚(白色箭头所示); B~D:CT增强图,可见肿块均匀强化,延迟后持续渐进强化,病灶后缘可见供血血管影(白色箭头所示); E:病灶和同层面主动脉的时间密度曲线,两者强化方式相同; F:镜下淋巴组织和滤泡间小血管增生,并伴有大量浆细胞(H-E染色. Original magnification:×400) |
20例CD患者中6例位于颈部,6例位于腹腔,3例位于纵隔,2例位于腹膜后,2例多部位,1例位于左锁骨下。病灶大小:横径1.1~4.9 cm,平均值(2.77±1.04)cm;纵径2.5~7.2 cm,平均值(4.01±1.30)cm。按临床类型分:17例单中心型(unicentric variand,UCD),3例多中心型(multicentric variand,MCD);按病理类型分:16例透明血管型(hyaline-vascular type,HV),3例浆细胞型(plasma cell type,PC),1例混合型(mixed cell type,MIX)。与病理诊断结果对照,影像学诊断正确的有6例,诊断不正确的有14例。患者接受手术切除的有15例,化疗的有3例,术后辅以化疗的有1例,仅穿刺的有1例。
3 讨 论CD是一种罕见的淋巴结病,Castleman等[1]在1956年首次报道了13例局限于纵隔的透明血管型病例。此后Festen等 [2]在1969年报道了另外一种以浆细胞增生为主的病例。Keller等[3]将这2型进行了全面的描述和鉴别。该病的病因和发病机制尚不明确,大量文献报道IL-6的高表达、人类疱疹病毒8型(HHV-8)感染与该病相关[4, 5],免疫缺陷调节或免疫调节异常在该病的发病中也有一定作用[6]。该病发病年龄在2~85岁,平均23岁,常见部位依次为胸部(70%)、颈部(14%)、腹部和盆腔(12%)、腋窝(4%)[7]。
3.1 临床病理特征CD临床上根据淋巴结受累范围可分为UCD和MCD,组织病理学上可分为HV、PC和MIX[8]。CD共同的病理特征为淋巴结基本结构保持完整,淋巴滤泡增生,滤泡间有大量变性的毛细血管增生;HV-CD的主要特征是滤泡周围有多层环形排列的淋巴细胞,形成特殊的洋葱皮样结构;PC-CD的主要特征是滤泡间质中有大量成片增生的成熟浆细胞,滤泡周围的淋巴细胞增生和滤泡间的毛细血管增生远不及HV明显,一般无典型的洋葱皮样结构;MIX-CD兼有两者的表现,或以一种成分为主[9]。
UCD以良性病程多见,预后较好;而MCD以恶性、侵袭性更多见,预后较差,两者病理类型有所交叉[10]。HV-CD占CD的90%,其中90%为UCD,男女发病情况相似,平均年龄30~40岁,常发生于全身淋巴结存在的任何部位,以纵隔、颈部、腋窝和腹部为多见,临床上仅表现为单个淋巴结的增大,手术切除效果好[11];HV-CD极少数是以MCD侵润性生长,预后较差。PC-CD占CD的10%以下,其中约9%~24%为UCD,其余大部分为MCD,患者平均年龄约为60岁,临床上以发热、盗汗、乏力、贫血、红细胞沉降率上升、高球蛋白血症、脾肿大等全身表现和免疫系统异常为特征,其预后较HV-CD差,常用的治疗方法有化疗、IL-6受体疗法、CD20抗体疗法等[12, 13, 14]。另外文献报道了疾病相关的CD,病理上基本都为PC-CD,包括HHV-8感染、艾滋病、淋巴瘤、POEMS(polyneuropathy,organomegaly,endocrinopathy,M protein and skin changes)综合征、副肿瘤性天疱疮、浆细胞疾病等,其预后均较差[15]。MIX-CD临床较少见,以MCD为主,可同时具有上述两者的特征。本组中单中心型HV-CD有15例,在体检时被发现,手术切除效果较好;多中心型PC-CD有2例,MIX-CD有1例,其全身症状明显,采取化疗或手术后辅以化疗,以上特征与文献报道相符。
3.2 影像学表现和临床病理联系CD的影像学表现与临床、病理类型密切相关。国内外文献报道CD在影像上主要有3种形态特征,最多见为边界清楚的无浸润肿块,肿块呈圆形、类圆形,均质(约占50%);其次为边界不清的浸润性肿块,周围伴有子灶(约占40%);较少无明显肿块显示,仅表现为大量增大杂乱的淋巴结(约占10%)[15]。肿块内部极少出现出血或坏死,其中约有30%的病灶内部可见点状、分枝状或条形钙化,并认为病灶内部的钙化为此类型的特征性表现[16]。但是本组患者中均未见到明显特征性钙化,可能与样本量小和MRI对小钙化不敏感有关。结合其病理,肿瘤质地均匀并且很少发生出血、坏死与增多的淋巴组织和丰富的血管密切相关[17];而肿瘤内部的钙化为其内部增生的小血管的退变、玻璃样变所致[18]。
UCD强化的主要特征为动脉期强化明显,延迟期持续强化,部分病例病灶周边或内部可见到增粗、迂曲的供血血管,增强早期肿块边缘明显强化的镶边征[10]。HV-CD常呈明显或显著强化,PC-CD因其血管成分较HV-PC减少,影像学上呈轻、中度强化;MIX-CD强化介于上述两者之间,强化的程度取决于内部血管成分所占的比例。肿瘤之所以明显强化主要是与瘤体内淋巴滤泡之间丰富的毛细血管后微静脉增生和周边较多的血供滋养动脉有关[17]。Kim等[19]认为较大病灶内部放射状或裂隙状的纤维组织是导致病灶强化不均匀并且强化程度减低的主要原因。本组20例CD患者中有19例患者肿块强化方式与主动脉相似,有17例病灶边缘可见供血血管,有6例肿块出现不均匀强化,与文献报道一致。
根据文献报道,MCD在胸部主要表现为双肺门和纵隔淋巴结肿大,两肺小叶中心多发结节影,可伴有空洞或支气管扩张征像[20];在腹部表现为弥漫的淋巴结肿大、肝脾肿大、腹水、腹后筋膜增厚[21]。在本组病例中,3例MCD均表现为多发、弥漫的淋巴结肿大,其中有2例伴有胸腹水,与文献报道的影像表现类似。
CD因其罕见而极易误诊,影像学上需要与淋巴瘤、淋巴转移瘤、感染、炎症性疾病所致的淋巴结肿大以及所发生部位血供丰富的常见疾病(异位甲状腺、腮腺混合瘤、胃肠间质瘤、胰腺内分泌肿瘤、间叶组织源性肿瘤等)鉴别。
总之,虽然CD确诊依赖病理,但它的影像学表现也具有一定的特征,掌握其影像学特征有助术前了解病变的大小、部位、形态、数量、瘤体血供,以及与周围血管关系,从而初步判断瘤体性质和制定合适的治疗方案。
| [1] | Castleman B, Iverson L, Menendez V P. Localized mediastinal lymphnode hyperplasia resembling thymoma[J]. Cancer, 1956, 9: 822-830. |
| [2] | Festen C, Flendrig J A, Schillings P H. Giant lymphomas[J]. Ned Tijdschr Geneeskd, 1969, 113: 1918-1919. |
| [3] | Keller A R, Hochholzer L, Castleman B. Hyaline-vascular and plasma-cell types of giant lymph node hyperplasia of the mediastinum and other locations[J]. Cancer, 1972, 29: 670-683. |
| [4] | Oksenhendler E, Boutboul D, Beldjord K, Meignin V, de Labarthe A, Fieschi C, et al. Human herpesvirus 8+ polyclonal IgMλ B-cell lymphocytosis mimicking plasmablastic leukemia/lymphoma in HIV-infected patients[J]. Eur J Haematol, 2013, 91: 497-503. |
| [5] | 赖玉梅, 李 敏, 刘翠苓, 黄 欣, 于国华, 王小燕,等. IL-6在Castleman病中的表达及其临床病理学意义分析[J]. 中华血液学杂志, 2013, 34: 404-409. |
| [6] | Nagao A, Nakazawa S, Hanabusa H. Short-term efficacy of the IL6 receptor antibody tocilizumab in patients with HIV-associated multicentric Castleman disease: report of two cases[J]. J Hematol Oncol, 2014, 7: 10. |
| [7] | Collins G L, Wallis-Crespo M C, Gilbert-Barness E. Pathology teach and tell: Castleman disease[J]. Fetal Pediatr Pathol, 2004, 23: 65-69. |
| [8] | Bower M, Pria A D, Coyle C, Nelson M, Naresh K. Diagnostic criteria schemes for multicentric Castleman disease in 75 cases[J]. J Acquir Immune Defic Syndr, 2014, 65: e80-e82. |
| [9] | Soumerai J D, Sohani A R, Abramson J S. Diagnosis and management of Castleman disease[J]. Cancer Control, 2014, 21: 266-278. |
| [10] | 马 强, 贺 文. Castleman病的临床和影像学研究进展[J]. 山西医药杂志, 2013, 42: 149-150. |
| [11] | Tey H L, Tang M B. A case of paraneoplastic pemphigus associated with Castleman's disease presenting as erosive lichen planus[J]. Clin Exp Dermatol, 2009, 34: e754-e756. |
| [12] | Ecsedy M, Schneider M, Nemes J, Nemeth J, Recsan Z. Optical coherence tomography features of POEMS dyndrome and Castleman disease-associated papillopathy[J]. Ocul Immunol Inflamm, 2014, 22: 454-460. |
| [13] | Szturz P, Adam Z, Moulis M, Smardová L, Klincová M, Slaisová R, et al. Our experience in treatment of multicentric plasma-cell Castleman disease associated with vasculitis manifestations-case report and literature review[J]. Vnitr Lek, 2012, 58: 679-690. |
| [14] | Karapinar T H, Tüfekçi Ö, Gözmen S, Yilmaz S, rken G, Ören H. Multicentric plasma cell type of Castleman disease in a child: difficulty in diagnosis and treatment[J]. J Pediatr Hematol Oncol, 2013, 35: e306-e308. |
| [15] | Bonekamp D, Horton K M, Hruban R H, Fishman E K. Castleman disease: the great mimic[J]. Radiographics, 2011, 31: 1793-1807. |
| [16] | 罗雪芬, 张玉琴, 林闽江. CT诊断腹膜后局限型透明血管型Castleman病的价值研究[J]. 现代实用医学杂志, 2014, 26: 426-444. |
| [17] | 王仁贵, 那 佳, 宾怀有, 朱学俊, 王仪生, 唐光健, 等. 局限性Castleman病特征性钙化的CT表现和病理学对照[J]. 中华放射学杂志, 2002, 36: 354-456. |
| [18] | Kwon S, Lee K S, Ahn S, Song I, Kim T S. Thoracic Castleman disease: computed tomography and clinical findings[J]. J Comput Assist Tomogr, 2013, 37: 1-8. |
| [19] | Kim M H, Hwang S, Choi Y B, Oh S T, Kim S C, Choi G M, et al. Castleman disease of the abdomen--single-center experience of 13 surgically treated patients over 11 years[J]. Hepatogastroenterology, 2010, 57: 1060-1063. |
| [20] | Johkoh T, Müller N L, Ichikado K, Nishimoto N, Yoshizaki K, Honda O, et al. Intrathoracic multicentric Castleman disease: CT findings in 12 patients[J]. Radiology, 1998, 209:477-481. |
| [21] | Lu Z H, Wu M. Localized Castleman disease of plasma cell type in the abdomen[J]. Chin Med J (Engl), 2011, 124: 2789-2791. |
 2015, Vol. 36
2015, Vol. 36


