2. 第二军医大学长海医院心血管内科, 上海 200433;
3. 南京政治学院上海校区干休所卫生所, 上海 20043
2. Department of Cardiology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Health Clinic, Cadres Sanatoriums, PLA Nanjing Political College (Shanghai Campus), Shanghai 200433, China
近年来,随着氯吡格雷等新型抗血小板药物与阿司匹林的联合应用,经皮冠状动脉介入治疗(PCI)术后支架内血栓并发症进一步减少[1, 2],术后常规应用肝素已不被指南推荐。但是新指南中关于PCI术后停用肝素抗凝仅局限于无并发症、简单病变,而对于较复杂的冠脉病变,术后仍推荐肝素抗凝,如2011年、2012年美国心脏病学会基金会/美国心脏协会(ACCF/AHA)关于不稳定性心绞痛和非ST段抬高心肌梗死治疗的修订指南中指出对无并发症、简单病变的患者,PCI后停用抗凝治疗(ⅠB)[3, 4],《中国经皮冠状动脉介入治疗指南(2009)》建议对于行非复杂性PCI者术后不应常规应用普通肝素(Ⅰ类推荐,证据水平A)[5]。由于不论是低分子肝素还是普通肝素,都有激活血小板活性、诱导血栓形成、增加出血以及诱发血小板减少等并发症,特别是出血可以增加患者的病死率[6, 7],也可以增加包括死亡、心肌梗死、脑卒中、支架血栓等不良事件的风险[8, 9, 10, 11, 12] ,为避免肝素抗凝带来的不良后果,许多临床医师在实际工作中已将PCI术后停用肝素抗凝的对象突破了目前指南所推荐的范围,即便是复杂的冠脉病变,除非术后出现无复流、冠脉夹层等并发症,术后均停用肝素抗凝,但对于复杂病变PCI术后肝素抗凝效果的研究却很少。本研究旨在明确复杂病变PCI术后肝素抗凝的有效性与安全性,为PCI术后合理抗凝治疗进一步提供依据。
1 资料和方法 1.1 病例选择本研究是一项随机、对照、前瞻性试验。2012年3月至2013年7月连续在第二军医大学长海医院、解放军411医院入选复杂冠脉病变(B2、C型病变)行PCI术后无特殊并发症的患者293例,根据计算机产生的随机数字号将入选患者随机分为2组:低分子肝素抗凝组和非抗凝组。纳入标准:(1)年龄18~80岁;(2)临床诊断为稳定型心绞痛、不稳定型心绞痛、非ST段抬高心肌梗死和ST段抬高心肌梗死;(3)愿意而且能够接受规定的访视、治疗、实验室检查以及其他的研究活动;(4)择期手术者。排除标准:(1)严重肝、肾功能损害的患者[肾小球滤过率(GFR)<30 mL/(min·1.73 m2)];(2)未能控制的高血压(≥180/110 mmHg,1 mmHg=0.133 kPa);(3)血红蛋白<90 g/L;(4)血小板计数<100×109/L;(5)严重左心室功能不全[左室射血分数(LVEF)<30%]或心源性休克患者;(6)正在服用其他抗凝药物如华法林;(7)股动脉穿刺部位血肿直径>5 cm;(8)3个月内有出血性卒中史;(9)对阿司匹林、氯吡格雷、肝素及依诺肝素或其他低分子肝素过敏,有低分子肝素诱导的血小板减少症史(以往有血小板计数明显下降);(10)不能耐受抗血小板治疗者;(11)术后出现冠脉夹层、无复流、侧支血管闭塞等并发症以及需使用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂者。
1.2 用药方案术前已接受长期阿司匹林冶疗的患者在PCI术前服用阿司匹林100~300 mg;以往未服用阿司匹林的患者在24 h前给予阿司匹林300 mg。术前6 h或更早服用氯吡格雷者,给予氯吡格雷300 mg负荷剂量;如果术前6 h未服用氯吡格雷,给予600 mg。术前8~12 h用低分子肝素者,PCI术前静脉追加伊诺肝素0.3 mg/kg,如PCI术前8 h内接受过标准剂量伊诺肝素皮下注射,无需追加伊诺肝素。术中使用普通肝素,穿刺成功并置入动脉鞘后经鞘管侧壁注射肝素2 500 U,决定介入治疗者在插入导引导管前静脉内追加注射5 000~7 000 U肝素(或达到总量70~100 U/kg),以后每小时酌情追加1 000~2 000 U,使活化凝血时间(ACT)保持在300~350 s。术后所有患者常规服用阿司匹林100 mg/d、氯吡格雷75 mg/d,抗凝组于术后2 h加用伊诺肝素(患者体质量<60 kg者用量40 mg,体质量≥60 kg者用量60 mg,均1次/12 h,皮下注射,共用3 d),非抗凝组术后不用肝素。根据患者实际情况,给予血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂、β阻滞剂、硝酸酯类、钙离子拮抗剂和他汀类治疗,并加强对高危因素的控制。
1.3 PCI方法由两名有丰富介入经验的医师严格按规程进行操作,按常规经桡动脉和股动脉行冠状动脉造影检查,采用定量冠状动脉造影(QCA)法测定冠状动脉病变处狭窄程度,参照1988年ACC/AHA的病变分型标准对靶病变分型,靶病变直径狭窄≥70%,参考直径2.5~4.0 mm,按标准方法行冠状动脉内支架置入术,据病变情况选择不同支架。PCI 成功标准[5]:支架置入后残余狭窄<20%,前向血流达到心肌梗死溶栓试验(TIMI) 3级,无严重并发症。
1.4 研究终点及定义主要终点是PCI术后住院期间以及术后1个月、1年内主要心血管不良事件(MACEs),包括心源性死亡、非致死性再次心肌梗死、靶血管再次血运重建术(TVR)。安全性终点是住院期间内发生出血事件。
TVR:任何原因对靶血管行再次血运重建,包括PCI术或冠状动脉旁路移植术(CABG)。心肌梗死[13]:PCI相关性心肌梗死是指基线肌钙蛋白(cTn)水平正常的患者,在接受PCI治疗后48 h内cTn水平升高至超过参考值上限(URL)第99百分位的5倍;或者基线水平升高的患者,cTn水平上升超过20%,且保持稳定或逐渐下降,同时还要求出现下列事件中的1种:症状提示心肌缺血;新出现缺血性心电图改变;血管造影结果与PCI并发症相吻合;或者有存活心肌新损失或新出现局部心壁运动异常的影像学证据。急性心肌梗死是指检测到心脏生物标记物水平上升和(或)下降超过URL第99百分位,且符合下列条件中的至少1项:有缺血症状;新出现或很可能新出现ST段显著抬高/T波改变或新出现左束支传导阻滞(LBBB);心电图出现病理性Q波;有存活心肌新损失或新出现局部心壁运动异常的影像学证据;血管造影或尸检发现冠状动脉内血栓。出血事件:根据TIMI出血分级分为严重出血和小出血(包括较少出血、轻微出血)。TIMI 出血分级标准分为以下3类:(1)严重出血:颅内出血或临床可见出血(包括影像学)伴血红蛋白浓度下降≥50 g/L;(2)较少出血:临床可见出血伴血红蛋白浓度下降30~50 g/L;(3)轻微出血:临床可见出血伴血红蛋白浓度下降<30 g/L。
1.5 统计学处理采用SPSS 18.0统计软件进行数据分析。分类变量用频数(%)表示,组间比较采用χ2检验;计量资料用x±s表示,符合正态分布且方差齐性者组间比较采用t检验,否则用非参数检验。住院期间小出血的影响因素采用logistic多因素回归分析。检验水准(α)为0.05。
2 结 果 2.1 两组患者基线资料的比较抗凝组147例患者中,失访1例,退出1例,共145例纳入分析;非抗凝组146例患者中,失访2例,退出1例,共143例纳入分析。两组间的一般临床资料、冠状动脉造影及PCI结果差异均无统计学意义。
2.2 两组患者术前、术后用药的比较两组间术前伊诺肝素、血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂、β阻滞剂、硝酸酯类、钙离子拮抗剂和他汀类等药物使用比例差异无统计学意义,术后阿司匹林、氯吡格雷、替格瑞洛、质子泵抑制剂、血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂、β阻滞剂、硝酸酯类、钙离子拮抗剂和他汀类等药物使用比例差异无统计学意义。
2.3 两组住院期间出血事件的比较抗凝组的平均住院天数为(6.04±1.64)d,非抗凝组的住院天数为(5.43±1.54) d,非抗凝组的住院天数少于抗凝组(P=0.001)。住院期间抗凝组与非抗凝组严重出血发生率分别是4.8%(7/145)和2.8%(4/143),差异无统计学意义(P=0.369);小出血发生率分别是26.2%(38/145)和16.1%(23/143),差异有统计学意义(P=0.036)。Logistic回归分析显示,PCI术后使用肝素以及≥75岁的高龄患者是小出血的危险因素(表 1)。
|
|
表 1 住院期间小出血的多因素回归分析 Tab 1 Binary logistic analysis of minor bleeding and related variables during hospitalization |
住院期间共5例(1.7%)发生MACEs(均为PCI相关性心肌梗死),其中抗凝组3例(2.1%)、非抗凝组2例(1.4%);1个月时共有8例(2.8%)发生MACEs,其中抗凝组4例(2.8%),非抗凝组4例(2.8%);1年时共有17例(5.9%)发生MACEs,其中抗凝组8例(5.5%),非抗凝组9例(6.3%)。两组间MACEs累计发生率差异无统计学意义(HR=0.875,95%CI:0.337~2.273;P=0.79)。具体见图 1。
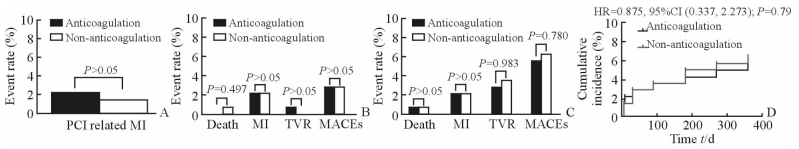
|
图 1 两组患者住院期间及术后1个月、1年MACEs发生率的比较 Fig 1 Rate of MACEs during hospital, days 1-30,days 1-365 A: MACEs during hospital; B: MACEs during days 1-30; C: MACEs during days 1-365; D: Kaplan-Meier curves representing the estimated cumulative incidence of two groups. MACEs: Major adverse cardiac events; PCI: Percutaneous coronary intervention; MI: Myocardial infarction; TVR: Target vessel revascularization |
PCI术后抗凝、抗血小板治疗被认为是术后预防支架血栓的经典治疗方法。近年来,随着氯吡格雷、替格瑞洛等新型抗血小板药物与阿司匹林的联合应用,PCI术后支架内血栓并发症进一步减少,术后常规应用肝素已不被指南推荐。但是新指南中关于PCI术后停用肝素抗凝仅局限于无并发症、简单病变。而对于较复杂的冠脉病变,PCI术后仍推荐肝素抗凝。对于PCI术后是否使用肝素抗凝以及肝素剂量等问题一直存有争议,近几年发表的大规模临床试验方案中,也有建议术后允许根据医生的判断用小剂量的抗凝剂肝素[14, 15, 16],但不论普通肝素还是低分子肝素都会带来剂量依赖性的出血并发症[17, 18, 19]。复杂病变更是增加了PCI术后出血的风险[20]。 因此,研究复杂病变PCI术后是否需低分子肝素抗凝具有十分重要的临床意义。
本研究通过对288例冠脉复杂病变患者在PCI术后是否使用肝素抗凝治疗进行对照研究,结果发现住院期间、术后1个月、术后1年两组MACEs的发生率差异无统计学意义,1年时MACEs的累计发生率差异无统计学意义。非抗凝组住院时间短于抗凝组(P=0.001),住院期间小出血发生率也较抗凝组低(P=0.036)。Logistic回归分析显示,PCI术后使用肝素以及≥75岁的高龄患者与小出血有相关性(P<0.05)。由此可见,即使是复杂病变,PCI术后不予肝素抗凝治疗也不增加缺血事件,而且缩短住院时间、减少住院期间出血发生率。
多个研究已证实,PCI术后不予以肝素抗凝治疗较肝素抗凝治疗不但不增加缺血性事件,而且减少出血的发生率[21, 22],在这些研究中,入选的患者不乏有复杂冠脉病变以及高血栓风险患者。ATLAST研究[23]是关于肝素抗凝治疗安全性和有效性的较大规模研究,入选的病例中含有较多的冠脉复杂病变患者 (包含血管直径≤2.5 mm、真性分叉病变、弥漫性病变等复杂病变)以及PCI术后血栓高危患者,该研究对2 000例PCI术后患者随机分为伊诺肝素抗凝组与非抗凝组,通过对1 102例患者1个月的随访,发现两组间主要终点事件总发生率差异无统计学意义(1.8% vs 2.7%,P=0.30);两组间心肌梗死的发生率虽然差异有统计学意义(0.4% vs 1.6%,P=0.037),但由于发生率较低,临床意义不大;小出血的发生率抗凝组高于非抗凝组(25% vs 5.1%,P<0.001)。该研究认为对大多数PCI术后患者,即便有支架血栓高危因素,抗血小板药预防支架血栓已经足够。本研究结果显示PCI术后不予肝素抗凝治疗不增加缺血事件,而且减少住院期间出血发生率,与ATLAST研究[23]结果一致,1个月时MACEs发生率2.8%,也与以上研究相接近。
Li等[24]在比较低分子肝素和普通肝素对PCI术患者有效性与安全性的研究中收集了2 397例非ST段抬高型心肌梗死患者,1 219例为肝素组(用药时间:自患者入院后者术后至少48 h),1 178例为低分子肝素组(用药时间:自患者入院后至术后3~5 d),随访8个月时两组MACCs的发生率分别为7.5%和7.6%,总发生率7.5%。本研究中随访1年时总MACCs的发生率5.9%,略低于前者。两个研究中入选病例不同(Li等[24]研究中入选的患者全为非ST段抬高型心肌梗死)可能是导致两者MACCs略有差异的主要因素。
本研究PCI术过程中均使用了普通肝素,存在交叉使用肝素的问题,根据SYNERGY 研究,交叉使用肝素会增加出血风险[17],近年的指南也不推荐PCI术中、术后交叉使用肝素(Ⅲ类推荐)[25],但指南只是参考了SYNERGY单个研究,该研究中PCI术经股动脉途径进行,并且患者对Ⅱb/Ⅲa受体拮抗剂具有较高的使用率,出血发生率显然较高。近年来,随着经桡动脉途径的增多,PCI术后出血的并发症已有明显减少[26, 27]。Sciahbasi等[28]也在近年的研究中证实,经桡动脉行PCI术时普通肝素与低分子肝素交叉使用并不增加出血事件。本研究中74%的患者经桡动脉行PCI术,因此可以认为肝素交叉使用对两组间出血事件的影响是极其微弱的。
在本研究中PCI术后不予肝素抗凝治疗非但不增加缺血事件,而且减少住院期间出血发生率、减少住院天数。提示即便是复杂冠脉病变,除非有冠脉夹层、无复流等并发症,PCI术后不予以肝素抗凝是安全、有效的。虽然本研究中入选的病例数较少,对研究结果可能会产生一定的影响,但仍对PCI术后的抗凝特别是复杂病变PCI术后的抗凝治疗具有指导意义。
| [1] | Swanson N, Hogrefe K, Stephens Lloyd A, Gershlick A. Current perspectives on British use of adjunctive therapies during coronary interventions[J]. Int J Cardiol, 2001,79(2-3):119-127. |
| [2] | Gregorini L, Marco J, Fajadet J, Bernies M, Cassagneau B, Brunel P, et al. Ticlopidine and aspirin pretreatment reduces coagulation and platelet activation during coronary dilation procedures[J]. J Am Coll Cardiol, 1997, 29: 13-20. |
| [3] | Wright R S, Anderson J L, Adams C D, Bridges C R, Casey D E Jr, Ettinger S M, et al. 2011 ACCF/AHA focused update of the guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction (updating the 2007 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines developed in collaboration with the American College of Emergency Physicians, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons[J]. J Am Coll Cardiol, 2011, 57: 1920-1959. |
| [4] | Jneid H, Anderson J L, Wright R S, Adams C D, Bridges C R, Casey D E Jr, et al. 2012 ACCF/AHA focused update of the guideline for the management of patients with unstable angina/non-ST-elevation myocardial infarction (updating the 2007 guideline and replacing the 2011 focused update): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol, 2012, 60: 645-681. |
| [5] | 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 经皮冠状动脉介入治疗指南(2009)[J].中华心血管病杂志,2009,37:4-25. |
| [6] | Feit F, Voeltz M D, Attubato M J, Lincoff A M, Chew D P, Bittl J A, et al. Predictors and impact of major hemorrhage on mortality following percutaneous coronary intervention from the REPLACE-2 trial[J]. Am J Cardiol, 2007, 100: 1364-1369. |
| [7] | Manoukian S V, Feit F, Mehran R, Voeltz M D, Ebrahimi R, Hamon M, et al. Impact of major bleeding on 30-day mortality and clinical outcomes in patients with acute coronary syndromes: an analysis from the ACUITY Trial[J]. J Am Coll Cardiol, 2007, 49: 1362-1368. |
| [8] | Kinnaird T D, Stabile E, Mintz G S, Lee C W, Canos D A, Gevorkian N, et al. Incidence, predictors, and prognostic implications of bleeding and blood transfusion following percutaneous coronary interventions[J]. Am J Cardiol, 2003, 92: 930-935. |
| [9] | Eikelboom J W, Mehta S R, Anand S S, Xie C, Fox K A, Yusuf S. Adverse impact of bleeding on prognosis in patients with acute coronary syndromes[J]. Circulation, 2006, 114: 774-782. |
| [10] | Rao S V, O'Grady K, Pieper K S, Granger C B, Newby L K, Van de Werf F, et al. Impact of bleeding severity on clinical outcomes among patients with acute coronary syndromes[J]. Am J Cardiol, 2005, 96:1200-1206. |
| [11] | Rao S V, Eikelboom J A, Granger C B, Harrington R A, Califf R M, Bassand J P. Bleeding and blood transfusion issues in patients with non-ST-segment elevation acute coronary syndromes[J]. Eur Heart J, 2007, 28:1193-1204. |
| [12] | Doyle B J, Rihal C S, Gastineau D A, Holmes D R Jr. Bleeding, blood transfusion, and increased mortality after percutaneous coronary intervention: implications for contemporary practice[J]. J Am Coll Cardiol, 2009, 53: 2019-2027. |
| [13] | Costa F M, Ferreira J, Aguiar C, Dores H, Figueira J, Mendes M. Impact of ESC/ACCF/AHA/WHF universal definition of myocardial infarction on mortality at 10 years[J]. Eur Heart J, 2012, 33: 2544-2550. |
| [14] | Stone G W, McLaurin B T, Cox D A, Bertrand M E, Lincoff A M, Moses J W, et al. Bivalirudin for patients with acute coronary syndromes[J]. N Engl J Med, 2006, 355: 2203-2216. |
| [15] | Stone G W, Ware J H, Bertrand M E, Lincoff A M, Moses J W, Ohman E M, et al. Antithrombotic strategies in patients with acute coronary syndromes undergoing early invasive management: one-year results from the ACUITY trial[J]. JAMA, 2007, 298: 2497-2506. |
| [16] | Stone G W, Witzenbichler B, Guagliumi G, Peruga J Z, Brodie B R, Dudek D, et al; HORIZONS-AMI Trial Investigators. Bivalirudin during primary PCI in acute myocardial infarction[J]. N Engl J Med, 2008, 358: 2218-2230. |
| [17] | Ferguson J J, Califf R M, Antman E M, Cohen M, Grines C L, Goodman S; SYNERGY Trial Investigators. Enoxaparin vs unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial[J]. JAMA, 2004, 292: 45-54. |
| [18] | Alexander K P, Chen A Y, Roe M T, Newby L K, Gibson C M, Allen-LaPointe N M, et al; CRUSADE Investigators. Excess dosing of antiplatelet and antithrombin agents in the treatment of non-ST-segment elevation acute coronary syndromes[J]. JAMA, 2005, 294: 3108-3116. |
| [19] | Ashby D T, Dangas G, Aymong E A, Farkouh M E, Mehran R, Lansky A J, et al. Relation between the degree of procedural anticoagulation and complications after coronary stent implantation[J]. Am J Cardiol, 2003, 92: 319-322. |
| [20] | Goto K, Lansky A J, Ng V G, Pietras C, Nargileci E, Mehran R, et al. Prognostic value of angiographic lesion complexity in patients with acute coronary syndromes undergoing percutaneous coronary intervention (from the acute catheterization and urgent intervention triage strategy trial)[J]. Am J Cardiol, 2014, 114: 1638-1645. |
| [21] | Harjai K J, Stone G W, Grines C L, Cox D A, Garcia E, Tcheng J E, et al. Usefulness of routine unfractionated heparin infusion following primary percutaneous coronary intervention for acute myocardial infarction in patients not receiving glycoprotein Ⅱb/Ⅲa inhibitors[J]. Am J Cardiol, 2007, 99: 202-207. |
| [22] | Karrillon G J,Morice M C,Benveniste E,Bunouf P,Aubry P,Cattan S,et al. Intracoronary stent implantation without ultrasound guidance and with replacement of conventional anticoagulation by antiplatelet therapy. 30-day clinical outcome of the French Multicenter Registry[J]. Circulation, 1996, 94: 1519-1527. |
| [23] | Batchelor W B, Mahaffey K W, Berger P B, Deutsch E, Meier S, Hasselblad V, et al; ATLAST Trial Investigators. A randomized, placebo-controlled trial of enoxaparin after high-risk coronary stenting: the ATLAST trial[J]. J Am Coll Cardiol, 2001, 38:1608-1613. |
| [24] | Li Y J, Rha S W, Chen K Y, Jin Z, Wang L, Ramasamy S, et al. Low molecular weight heparin versus unfractionated heparin in patients with acute non-ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention with drug-eluting stents[J]. J Cardiol, 2012, 59: 22-29. |
| [25] | Hamm C W, Bassand J P, Agewall S, Bax J, Boersma E, Bueno H, et al; ESC Committee for Practice Guidelines. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: the Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2011, 32: 2999-3054. |
| [26] | Feldman D N, Swaminathan R V, Kaltenbach L A, Baklanov D V, Kim L K, Wong S C, et al. Adoption of radial access and comparison of outcomes to femoral access in percutaneous coronary intervention: an updated report from the national cardiovascular data registry (2007-2012)[J]. Circulation, 2013, 127: 2295-2306. |
| [27] | Romagnoli E, Mann T, Sciahbasi A, Pendenza G, Biondi-Zoccai G G, Sangiorgi G M. Transradial approach in the catheterization laboratory: pros/cons and suggestions for successful implementation[J]. Int J Cardiol, 2013, 163: 116-124. |
| [28] | Sciahbasi A, Rigattieri S, Calcagno S, Mancone M, Pendenza G, Cera M, et al. Heparins crossover in percutaneous coronary interventions: a real issue with increasing rate of transradial procedures?[J]. J Cardiovasc Med (Hagerstown), 2015, 16: 507-511. |
 2015, Vol. 36
2015, Vol. 36


