2. 贵州省人民医院心血管内科, 贵阳 550002;
3. 复旦大学附属中山医院心血管内科, 上海 200023
2. Department of Cardiovasology, Guizhou Provincial People's Hospital, Guiyang 550002, Guizhou, China;
3. Department of Cardiovasology, Zhongshan Hospital, Fudan University, Shanghai 200023, China
随着老龄化社会的到来,主动脉瓣膜疾病已逐渐成为最常见的心脏病之一[1]。严重的主动脉瓣疾病内科治疗往往效果不佳,外科开胸主动脉瓣置换术是最有效的治疗手段[2]。但是,许多患者因为高龄或多种合并症等原因而无法耐受外科手术,成为治疗无望的患者[3]。近年来,经导管主动脉瓣置入术(transcatheter aortic valve implantation,TAVI)成功应用于临床并成为一种可替代外科的严重主动脉瓣狭窄患者的治疗方法[4],但是主动脉瓣关闭不全(aortic regurgitation,AR)仍被列为TAVI的禁忌证[5]。要实现AR患者也能通过TAVI得到治疗这一目标,开展相应的动物实验研究很有必要,但是目前国际上还没有成熟的经导管AR大动物模型的建立方法。
本实验通过经导管的方法使用冠状动脉导丝穿透并损伤主动脉瓣,成功建立了犬急性AR模型,为下一步研究主动脉瓣反流的介入治疗提供实验基础。
1 材料和方法 1.1 实验动物及术前准备健康清洁级实验犬10只,体质量(18.5±3.1)kg,雌雄不限,由海军医学研究所提供。术前心电图、心脏彩超检查无异常。禁食8 h后,氯胺酮(10 mg/kg)肌内注射麻醉,术中静脉注射丙泊酚[0.2 mg/(kg·min)]维持麻醉,接心电监护。所有实验犬的处置均符合国家科学技术委员会于1988年颁布的《实验动物管理条例》。
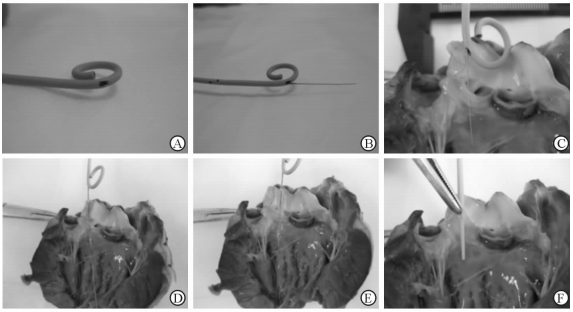
1.2 AR犬离体模型的建立取1个完整新鲜的犬心脏标本,沿升主动脉切开心脏露出主动脉瓣膜;取一根6F猪尾巴导管,在其导管圈起始部的外侧缘剪开一个直径约3.5 mm的小孔(图 1A);经猪尾巴导管送入冠状动脉介入用导丝的硬头端,通过小孔送出(图 1B);操作导丝刺穿主动脉瓣膜(图 1C);沿导丝分别将2.0 mm×15 mm和3.5 mm×15 mm的球囊送至主动脉瓣膜(图 1D),扩张球囊损伤瓣膜(图 1E),观察瓣膜损伤情况(图 1F)。
|
图 1 主动脉瓣关闭不全犬离体模型的建立 Fig 1 Aortic regurgitation canine model established in vitro A: A hole with a diameter of 3.5 mm was made at the beginning of the circle of pigtail catheter; B: The hard tip of a guide wire was sent out through the hole just made; C: Aortic valve was perforated by the tip of guide wire; D: Balloon was sent to the aortic valve; E: Aortic valve was injured by dilated balloon; F: The injury of aortic valve was evaluated |
取实验犬穿刺左右侧股动脉和右侧股静脉,分别置入6F鞘管。犬取右侧卧位,经左侧股动脉鞘管送入5F猪尾巴导管。行主动脉瓣上造影,证实犬主动脉瓣没有反流,并测量主动脉瓣环的大小(图 2A)。经右侧股动脉鞘管送入剪有小孔的6F猪尾巴导管至主动脉窦底,顶住主动脉瓣叶(图 2B)。将原5F猪尾巴导管送入左心室作为定位标志。经6F猪尾巴导管送入冠状动脉介入用导丝的硬头端,通过前端外侧缘小孔送出,刺穿主动脉瓣膜(图 2C)。经5F导管注射少量造影剂以确定导丝进入左心室(图 2D)。经导丝送入2.0 mm×15 mm的球囊至主动脉瓣膜位置,确定在位后扩张球囊损伤瓣膜(图 2E)。导丝和球囊后撤至6F猪尾巴导管内。5F猪尾巴导管拉至主动脉瓣上并造影观察主动脉瓣反流情况(图 2F)。确定反流效果理想后退出导丝、球囊和猪尾巴导管。拔除股动脉、股静脉的鞘管,压迫两侧股动脉穿刺点10 min。手术结束前10 min停止使用丙泊酚,结束后给予青霉素160万U抗感染。待犬自主呼吸、角膜放射恢复,血压、心律稳定后拔除气管导管,自然体位下观察30 min。术后即刻行人工主动脉瓣上数字减影血管造影(DSA)及经胸超声检查观察主动脉瓣反流情况。术后给予青霉素预防感染,共5 d;呋塞米10 mg/d肌注3 d,此后口服呋塞米10 mg/d共30 d。

|
图 2 主动脉瓣关闭不全犬在体模型的建立 Fig 2 Aortic regurgitation canine model established in vivo A: Preoperative aortography; B: A pigtail catheter with a hole in the tip was sent to the aortic valve; C: Aortic valve was perforated by the tip of guide wire sent out from the pigtail catheter; D: Angiography was made through the pigtail catheter to make sure that guide wire was insert into the left ventricular; E: The aortic valve was injured by dilated balloon; F: Angiography was made to make sure the aortic regurgitation was established |
计量资料以x±s表示。
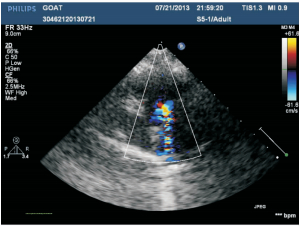
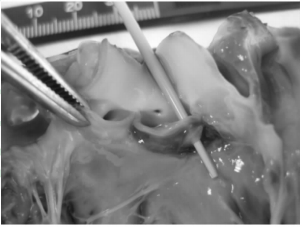
2 结 果离体犬主动脉瓣穿刺损伤实验显示瓣膜损伤适中,过程顺利且易操作。在此基础上建立AR犬在体模型,结果显示10只实验犬急性AR模型均成功建立,其中2只因主动脉瓣大量反流导致急性左心衰而当场死亡。存活的8只犬经术后即刻DSA主动脉瓣上造影和经胸超声检查见6只为主动脉瓣中量反流(图 3),2只为少量反流,存活时间均超过1个月。手术时间为(56.2±12.6) min,X线透视时间为(13.5±5.2) min。2只主动脉瓣大量反流犬死后解剖心脏,肉眼观察可见主动脉瓣叶穿孔,见图 4。
|
图 3 主动脉瓣中量反流超声图 Fig 3 Ultrasound showing moderate aortic regurgitation |
|
图 4 主动脉瓣叶穿孔解剖图 Fig 4 Anatomy of aortic valve perforation |
近年来,TAVI已成为心脏病领域的最重要的进展。其微创、安全、操作简单等优点使其很快在临床上得到推广,目前已成为严重钙化型主动脉瓣狭窄患者的一种重要治疗手段。然而,由于解剖学复杂、无钙化的主动脉瓣支架无法准确定位等原因,目前AR仍是TAVI的禁忌证。AR的介入治疗研究目前仍处于初步阶段[6],建立理想的AR大动物模型对于进行AR介入治疗的研究极为重要。以往成熟的大动物主动脉反流模型多采用动物体外循环下开胸直视术破坏主动脉瓣的无冠瓣的方法来建立,最终达到AR的目的[7]。此方法创伤大,操作复杂,不易推广。因此,研究出一套简单、安全、效果明确的经导管AR大动物模型的建立方法非常重要。
本研究首先通过建立AR犬离体模型证实了介入方法建立AR模型的可操作性,再通过经皮冠状动脉介入的方法建立了一套AR犬在体模型,该方法操作简单、安全可靠、重复性好,且可以通过应用不同大小的球囊控制主动脉瓣的反流程度。
关于操作方面的注意事项:(1)将原5F猪尾巴导管送入左心室可起到一个路标的作用,此时送导丝穿刺主动脉瓣膜的时候需要沿在左心室的猪尾巴导管的方向穿刺,这样会提高穿刺的准确率。(2)主动脉瓣叶有较强的韧性,导丝穿刺时会有突破感。所以当导丝很顺利并无感觉的进入左心室时,可能是经过主动脉瓣口进入了左心室而并未刺破瓣膜,此时可以回撤导丝稍微调整一下导丝方向后重复上一步的操作。因为导丝为0.014 inch (0.36 mm)的PTCA导丝,一般不会对心脏组织造成很大的损伤。(3)将导丝经主动脉窦刺入室间隔时会明显感觉到导丝前进受阻,且在透视下可以见到导丝偏离5F猪尾巴导管的方向,此时只需要回撤导丝并稍微调整一下导丝方向重新穿刺瓣膜即可。(4)当导丝顺利穿过主动脉瓣叶后,需要通过对在左心室的猪尾巴导管进行造影来证实导丝在左心室,然后再送入球囊对瓣膜进行扩张。(5)主动脉瓣反流量的大小可以通过送入球囊的大小来决定。经离体及在体的动物实验证实,如送入直径为1.5~2.0 mm的球囊扩张瓣膜穿刺孔通常会造成小量的主动脉瓣反流,而送入直径为3.0~3.5 mm的球囊扩张瓣膜穿刺孔可能会造成大量的主动脉瓣反流。
该方法的最大优点在于只要耐心操作,一定可以实现主动脉瓣叶的损伤而达到主动脉瓣反流的效果。
该方法的不足之处在于有时需要反复多次操作才能成功实现导丝的瓣膜穿刺,可能需要花费较长的透视时间。另外同样的实验方法用在羊上却成功率不高,可能是因为羊的升主动脉段较短且主动脉弓的弯曲度较平,带剪孔的猪尾巴导管送进窦底时侧小孔通常会抵住右冠窦,而且由于主动脉弓较为平直使猪尾巴导管的旋转操作较为困难而无法调整侧小孔的方向,此时送入导丝时很容易刺入室间隔而不是进入左心室而导致实验失败。
本研究建立AR犬模型的实验方法手术操作简单,效果切实,值得推广。
| [1] | Nkomo V T, Gardin J M, Skelton T N, Gottdiener J S, Scott C G, Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study [J]. Lancet, 2006, 368: 1005-1011. |
| [2] | Bach D S, Siao D, Girard S E, Duvernoy C, McCallister B D Jr, Gualano S K. Evaluation of patients with severe symptomatic aortic stenosis who do not undergo aortic valve replacement: the potential role of subjectively overestimated operative risk [J]. Circ Cardiovasc Qual Outcomes, 2009, 2: 533-539. |
| [3] | Iung B, Baron G, Butchart E G, Delahaye F, Gohlke-Bärwolf C, Levang O W, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survery on Valvular Heart Disease [J]. Eur Heart J, 2003, 24: 1231-1243. |
| [4] | Vahanian A, Alfieri O, Andreotti F, Antunes M J, Barón-Esquivias G, Baumgartner H, et al. Guidelines on the management of valvular heart disease (version 2012) [J]. Eur Heart J, 2012, 33: 2451-2496. |
| [5] | Roy D A, Schaefer U, Guetta V, Hildick-Smith D, Möllmann H, Dumonteil N, et al. Transcatheter aortic valve implantation for pure severe native aortic valve regurgitation [J]. J Am Coll Cardiol, 2013, 61: 1577-1584. |
| [6] | Seiffert M, Diemert P, Koschyk D, Schirmer J, Conradi L, Schnabel R, et al. Transapical implantation of a second-generation transcatheter heart valve in patients with noncalcified aortic regurgitation [J]. JACC Cardiovasc Interv, 2013, 6: 590-597. |
| [7] | Mori Y, Shiota T, Jones M, Wanitkun S, Irvine T, Li X, et al. Three-dimensional reconstruction of the color Doppler-imaged vena contracta for quantifying aortic regurgitation: studies in a chronic animal model [J]. Circulation, 1999, 99: 1611-1617. |
 2015, Vol. 36
2015, Vol. 36


