2. 第二军医大学长海医院超声科, 上海 200433
2. Department of Ultrasonography, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
男性患者,19岁。因“肉眼血尿1个月,发热1周,肌酐升高5 d”入院。患者1个月前突发全程血尿,呈浓茶色,无血凝块,未诊治。1周前畏寒、发热,体温最高38.9℃,无系统症状。至当地医院就诊,实验室检查发现:白细胞(WBC)12.8×109/L、中性粒细胞(GRAN)0.89、血小板(PLT)342×109/L、血红蛋白(HGB)77 g/L,白蛋白28.6 g/L、球蛋白35.3 g/L,肌酐229 μmol/L,红细胞沉降率(ESR)134 mm/1 h。予“头孢西丁钠”抗感染。并转入我院。病程中除胃纳差外,无明显异常。16年前因“法洛三联症(永存动脉干)”曾在上海中山医院行“同种异体带瓣管道移植永存动脉干纠治术”治疗。术中曾输血,术后恢复可。否认家族遗传病史。体格检查:体温(T)36.0℃,脉博(P)80次/min,呼吸18次/min,血压(BP)120/80 mmHg(1 mmHg=0.133 kPa)。其中异常所见:(1)慢病容,贫血颜貌;(2)心前区隆起,心尖搏动位于锁骨中线外,可触及抬举样搏动,心浊音界向左下扩大,心率80次/min,律齐,肺动脉瓣区可闻及4/6级全收缩期吹风样杂音,并向其他瓣膜区传导,无心包摩擦音。血常规:WBC 9.83×109/L,GRAN 0.852,PLT 333×109/L,HGB 68 g/L。血培养(多次)均阴性。肝功能:白蛋白25 g/L,球蛋白40 g/L,肝酶谱均正常。肾功能: 血尿素氮(BUN)11.0 mmol/L,肌酐247 μmol/L,胱抑素C(CysC)2.7 g/L,二氧化碳结合力(CO2cp) 21 mmol/L;基于MDRD方程的估计肾小球滤过率[eGFR(MDRD)] 23.8 mL/(min·1.73 m2)。 血脂中仅高密度脂蛋白胆固醇低于正常(0.50 mmol/L),余均正常。ESR>140 mm/1 h;C-反应蛋白(CRP)96.8 mg/L。乙肝五项阴性;抗-HCV-IgG阳性,HCV-RNA低于最低检出限。梅毒、抗HIV抗体阴性。自身免疫抗体(抗GBM抗体、p-ANCA、c-ANCA、MPO-ANCA、PR3-ANCA、抗ENA抗体、 抗核抗体、ds-DNA、ss-DNA抗体)均阴性;类风湿因子(RF)及抗链球菌溶血素“O” (ASO)抗体均未见异常。 IgG 17.50 g/L; C3 0.81 g/L。血免疫固定电泳:正常。尿常规:红细胞(手工)满视野/HP、白细胞500.0/μL、蛋白质0.75 g/L;尿蛋白定量:2.72 g/24 h,尿白蛋白/尿肌酐1 157 mg/g。尿β-N-乙酰氨基葡萄糖苷酶(NAG) 70.0 U/L,尿本周蛋白阴性。胸部X线片检查(2011-07-12)示法洛三联症术后改变,右心增大。心电图示窦性心律,左心室高电压。腹部B超示双肾形态饱满,右肾大小11.5 cm×4.4 cm,左肾大小11.7 cm×4.9 cm,肾实质略厚,位置正常;皮质回声略增强,包膜光整,皮髓质分界清,集合系统无分离。心动超声图(第1次)示法洛三联症术后:(1)肺动脉内置管内径正常(瓣口Vmax: 320 cm/s,压差约40 mmHg);(2)右心略增大、右室肥厚;(3)主动脉瓣少量反流(瞬间反流量1 mL);(4)左、右房室瓣少量反流(瞬间反流量1 mL、3 mL);(5) 左心室收缩功能正常。
2 临床讨论
肾内科主治医师A 青年男性;以肉眼血尿起病,且持续至今;有发热史,目前已退;实验室检查提示:蛋白尿和肾功能减损。因病史仅1个月,双肾不小,应为急性肾损伤。尿蛋白量为2.72 g/24 h,且尿白蛋白/尿肌酐比值为1 157 mg/g,应为急性肾小球疾病所致之急性肾损伤。根据青年男性,肉眼血尿、蛋白尿,肾功能减损,并有发热史,首先考虑急性感染后肾炎。但发热于血尿后出现,ASO不高、C3不低,肾损伤过重[eGFR(MDRD) 23.8 mL/(min·1.73 m2)],故高度怀疑急进性肾炎。虽球蛋白(40 g/L)、IgG (17.50 g/L)高于正常水平,但自身抗体均阴性,未提示风湿免疫性疾病。拟待病理报告后,争取尽早进行相应治疗,以免肾功能继续恶化。
肾内科主治医师 B 该患者虽然年轻,但有先天性心脏病“法洛三联症(永存动脉干)”,及曾行“同种异体带瓣管道移植永存动脉干纠治术”等病史;加之有输血史,且抗-HCV阳性;故应谨慎排除感染性心膜炎所致之肾损害,及丙型肝炎病毒相关性肾炎。由于“凡器质性心脏病患者(包括术后患者)出现不明原因的发热1周以上时”,均应疑及感染性心内膜炎的存在;虽本例入院前已行抗感染治疗,入院时体温已正常,血培养阴性,诊断途径遭遇瓶颈,但如超声心动图证实心瓣膜有赘生物形成,肾脏病理示局灶节段增生肾小球肾炎,特别是经有效抗感染治疗血尿、蛋白尿缓解,肾功能恢复,则感染性心内膜炎肾损害仍可成立。至于丙型肝炎病毒相关性肾炎,由于目前尚不能以“是否在肾小球中检出HCV抗原”来确定或否定其诊断。故应在排除感染性心膜炎肾损害后,再根据其临床表现及实验室检查结果综合分析其存在的概率。
肾脏科病理医师 光镜(图 1):全片不同切片可见14~19个肾小球,2个细胞纤维性大新月体。个别肾小球体积略大,包曼囊壁不规则增厚、断裂,周围纤维组织、炎细胞浸润。系膜细胞及基质轻度局灶增生,节段加重、硬化,球囊粘连。上皮细胞明显肿胀、增生。偶见嗜酸性粒细胞浸润。上皮下、内皮下及系膜区未见嗜复红蛋白沉积。毛细血管壁无明显增厚。肾小管上皮细胞胞质肿胀,颗粒、空泡变性,坏死脱落,可见红细胞、蛋白管型;萎缩的肾小管呈灶状分布。肾间质灶性水肿,片状炎细胞浸润伴纤维组织增生,面积小于25%。小动脉壁未见明显增厚。免疫荧光:4~5个小球,IgM+和C1q+沿节段硬化系膜区及毛细血管壁颗粒样沉积;CoⅣ+沿包曼囊壁及小管壁沉积。而IgG、IgA、C3、C4、Fib、κ、λ均阴性。免疫酶标:HBsAg阴性。电镜(图 2):肾小球囊壁不厚,毛细血管襻系膜基质节段轻度增生,基底膜不厚,较均匀,未见沉积物,上皮细胞可见胞质脱落,足突节段融合半绒毛化。肾小管间质区域性增宽,有较多的炎细胞,部分肾小管上皮细胞变性或萎缩。印象:上皮病变,系膜增生(轻度)。肾脏病理诊断:局灶节段增生性肾炎,请结合临床排查继发性疾病。
 | 图 1 肾脏标本光镜下检查结果 A:H-E染色示肾小球系膜细胞及基质局灶轻度增生;B:PAS染色示细胞纤维性大新月体形成;C: Masson染色未见明显嗜复红蛋白沉积;D:PASM染色示肾小球缺血皱缩;E,F:免疫荧光示IgM(E)、C1q(F)沿节段硬化、系膜区及毛细血管壁沉积.Original magnification: ×200 (A),×400 (B~F) |
 | 图 2 肾脏标本电镜下检查结果 A:肾小球血管襻基膜基本均匀,上皮细胞可见空泡结构、绒毛较多;B:系膜区轻度硬化,上皮细胞局部剥脱,足突融合;C:系膜区轻度硬化,上皮细胞足突绒毛化,血管襻管腔内可见细胞碎片;D:血管襻管腔闭塞,上皮细胞足突融合. Original magnification: ×3 500 (A、B),×2 000 (C),×4 000 (D) |
超声科医师 经再次超声心动图检查(图 3),示法洛三联症术后:(1)肺动脉人工管中-重度狭窄(瓣口Vmax:419 cm/s,压差约70 mmHg)伴瓣口赘生物样回声,大小约0.7 cm×0.4 cm;(2)右心略增大、右室肥厚;(3)主动脉瓣少量反流(瞬间反流量1 mL);(4)左、右房室瓣少量反流(瞬间反流量1 mL、3 mL);(5)左心室收缩功能正常。
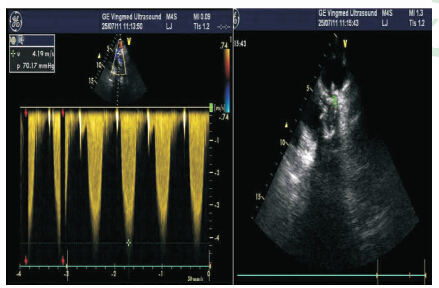 | 图 3 再次超声心动图检查结果 肺动脉人工管中-重度狭窄伴瓣口赘生物样回声,大小约0.7 cm×0.4 cm; 右心略增大、右室肥厚;主动脉瓣少量反流; 左、右房室瓣少量反流 |
肾内科主诊医师 右心感染性心内膜炎的主要诊断标准有二:(1)超声心动图证实右房室瓣和(或)肺动脉瓣有赘生物;(2)发热和感染征象。凡符合上述两项主要诊断标准者,即可诊断右心感染性心内膜炎。本例患者经第2次超声复查,肺动脉人工管中-重度狭窄,伴瓣口赘生物样回声,大小约0.7 cm×0.4 cm;且病史提供具有1周左右的发热,当时白细胞及中性粒细胞升高,中度贫血,抗感染治疗有效(热退),发热和感染征象俱在。加之患者有“法洛三联症(永存动脉干)”及曾行“同种异体带瓣管道移植永存动脉干纠治术”治疗史,右心感染性心内膜炎的诊断成立。
肾内科主任 同意主诊医师意见,本例患者的诊断为:(1)急进性肾炎综合征,感染性心内膜炎肾损害,局灶节段增生性肾炎;(2)尿路感染;(3)亚急性右心感染性心内膜炎;(4)法洛三联症“同种异体带瓣管道移植永存动脉干纠治术”后。经过大家的不懈努力,全面仔细了解病史,反复检查,诊断依据确切,资料完整,是一个非常经典的病例,值得总结见解。作为肾内科的医生,需要有全面的内科学基础,在诊疗过程中不要只考虑原发性肾小球疾病,要善于发现问题,临床与病理需紧密结合,肾脏病理对临床有很好的提示作用,综合分析,全面考虑,方可避免漏诊误诊。
3 讨 论
感染性心内膜炎临床并不罕见,随着心脏手术、血管内介入治疗、静脉营养、血透插管的广泛开展,以及吸毒人数增加,感染性心内膜炎的发病率有所增加,近年来,引起感染性心内膜炎的致病菌有很大变化,且临床特征不典型,由于抗生素的应用,细菌培养的阳性率下降,在临床上容易误诊、漏诊[1, 2]。
本例以肉眼血尿、蛋白尿、急性肾损伤为突出临床表现,入院时患者体温正常,而发热症状并不突出典型,且呈间断性,如果没有仔细询问病史,非常容易遗漏。患者虽然有先天性心脏病史,但多次血培养均为阴性,入院第1次心脏超声[3, 4]并没有发现赘生物,因肾活检提示为局灶节段增生性肾炎,继发性肾小球疾病可能性大,再次结合临床表现,考虑为感染性心内膜炎,进一步心脏超声检查,方才获得诊断关键依据。按照感染性心内膜炎的诊断标准[5, 6],该患者符合1条主要标准+3条次要标准,即心脏彩色超声有阳性发现,既往有先天性心脏病的基础,体温超过38℃,肾脏病理证实为局灶增生性肾炎,故临床诊断感染性心内膜炎成立。
经过积极有效的抗感染治疗,患者肉眼血尿、蛋白尿消失,肾功能基本恢复正常,预后非常理想,如果没有及时发现继发性原因,诊断错误,蛋白尿、血尿按慢性肾小球肾炎给以免疫抑制治疗则后果不堪设想。
患者为青年男性,临床表现血尿、蛋白尿、发热、急性肾损伤,首先应与感染后肾小球肾炎、IgA肾病、急进性肾炎综合征等原发性肾小球疾病相鉴别,如出现皮疹、腹痛等还需与过敏性紫癜性肾炎鉴别,当然其他病毒、微生物感染也可引起局灶增生性肾炎,在临床上也要注意鉴别。
肾脏病理诊断在疾病诊治过程中具有重要参考价值,在明确诊断指导治疗方面是不可替代的。从病理切片(图 1)看,免疫荧光除IgM、C1q 沿节段硬化、系膜区及毛细血管壁沉积,余阴性,光镜下病变分布不均匀,部分肾小球病变较轻,部分病变较重,有2个细胞纤维性大新月体形成,但所占比例小于50%,增生的细胞以系膜细胞、上皮细胞为主,偶见嗜酸性粒细胞浸润,基底膜无明显增厚。肾间质有水肿,有较明显的炎细胞浸润,面积小于25%。电镜下未见电子致密物沉积(图 2),提示毛细血管襻系膜基质节段轻度增生,上皮细胞轻度病变,肾间质水肿,有较多的炎细胞浸润。这与毛细血管内增生性肾炎、局灶节段性肾小球硬化(FSGS)、IgA肾病及新月体肾炎等病理改变不同。综上所述,本例患者病理诊断为局灶增生性肾炎,并且继发性疾病引起的可能性较大,反馈临床,继续寻找病因,最终确诊。
感染性心内膜炎肾损害可以表现为局灶增生性肾炎、肾局灶梗死、急性间质性肾炎、急性肾小管坏死及新月体形成等[7, 8, 9]。局灶节段增生性肾炎的临床表现多样,既可表现为血尿、白细胞尿;也可表现为蛋白尿、肾功能减损;少数患者则表现为急进性肾炎综合征,如本例。其仍属免疫复合物致病,始动因素为感染的细菌。根据本例的病情、病程,以亚急性感染性心内膜炎可能性大。致病菌以草绿色链球菌最为常见,D族链球菌(如肠球菌)和表皮葡萄球菌次之。感染性心内膜炎的肾损害多在有效抗感染后得以恢复。糖皮质激素和其他免疫抑制剂虽可抑制免疫反应,但同时也可使感染恶化。
肾活检病理诊断并不是万能的,不能单纯依赖病理检查作出疾病诊断,必须整合临床及病理检查结果,综合分析判断,才能得到正确的结论。本例诊疗经过说明,内科学基础在肾脏病诊治中具有重要意义;既往史在诊治中常具有不可忽视的价值,主要诊断依据必要时需重复检测; 诊断的基础应基于对患者的全面了解,综合病史、体检、辅助检查分析后进行,并根据病情及时修正。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Baluta M M, Benea E O, Stanescu C M, Vintila M M. Endocarditis in the 21(st) Century[J]. Maedica (Buchar), 2011, 6: 290-297. |
| [2] | Slipczuk L, Codolosa J N, Davila C D, Romero-Corral A, Yun J, Pressman G S, et al. Infective endocarditis epidemiology over five decades: a systematic review[J]. PLoS One,2013,8:e82665. |
| [3] | Cecchi E, Chirillo F, Faggiano P, Imazio M, Cecconi M, Moreo A, et al. The diagnostic utility of transthoracic echocardiography for the diagnosis of infective endocarditis in the real world of the Italian Registry on Infective Endocarditis[J]. Echocardiography, 2013,30:871-879. |
| [4] | Sedgwick J F, Burstow D J. Update on echocardiography in the management of infective endocarditis[J]. Curr Infect Dis Rep, 2012,14:373-380. |
| [5] | Prendergast B D. Diagnostic criteria and problems in infective endocarditis[J]. Heart,2004,90:611-613. |
| [6] | Westphal N, Plicht B, Naber C. Infective endocarditis-- prophylaxis, diagnostic criteria, and treatment [J]. Dtsch Arztebl Int, 2009, 106(28-29):481-490. |
| [7] | Mantan M, Sethi G R, Batra V V. Post-infectious glomerulonephritis following infective endocarditis: amenable to immunosuppression [J]. Indian J Nephrol, 2013, 23: 368-370. |
| [8] | Khalighi M A, Nguyen S, Wiedeman J A, Palma Diaz M F. Bartonella endocarditis-associated glomerulonephritis: a case report and review of the literature [J]. Am J Kidney Dis, 2014,63:1060-1065. |
| [9] | Majumdar A, Chowdhary S, Ferreira M A, Hammond L A, Howie A J, Lipkin G W, et al. Renal pathological findings in infective endocarditis [J]. Nephrol Dial Transplant, 2000,15:1782-1787. |
 2015, Vol. 36
2015, Vol. 36


