2. 解放军153中心医院泌尿外科, 郑州 450042;
3. 第二军医大学长征医院泌尿外科, 上海 200003
2. Department of Urology, No. 153 Hospital of PLA, Zhengzhou 450042, Henan, China;
3. Department of Urology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
保留肾单位手术治疗早期肾癌在控制肿瘤复发、降低术后肾功能不全发生率方面具有良好的疗效,《欧洲泌尿外科指南》(2014年6月版)推荐对于T1期肾癌应尽可能实施保留肾单位手术。目前,用于保留肾单位的手术方式主要包括开放性肾部分切除术和经腹腔镜肾部分切除术,开放手术仍是保留肾单位手术的标准术式[1]。虽然腹腔镜肾部分切除术治疗早期肾癌远期疗效满意[2],且具有创伤小、恢复快等优势,但现阶段仍难以完全取代开放手术。这主要是因为肾脏肿瘤的解剖特点多样,当手术对象是靠近肾门生长、位于肾脏深部或直径大于4 cm(T1b期)的复杂性肿瘤时,经腹腔镜手术的难度将明显增大,手术风险也相应增加,这些因素都限制了经腹腔镜手术在保留肾单位手术中的应用。因此,在选择肾部分切除术处理解剖学特征复杂的T1期肾癌时,如何兼顾手术安全、手术疗效并且最大程度地减少手术创伤,成为泌尿外科医生亟待解决的问题。第二军医大学长海医院泌尿外科自2010年7月至2013年12月间采用后腹腔镜辅助经腰小切口肾部分切除技术治疗复杂性T1期肾癌28例,手术创伤较小,疗效满意,现报告如下。 1 资料和方法 1.1 研究对象
回顾性分析2010年7月至2013年12月在我科行后腹腔镜辅助经腰小切口肾部分切除术治疗的T1期肾癌患者的围手术期及术后随访资料。本组患者共28例,男18例,女10例;年龄22~71岁,平均年龄(47.11±14.85)岁;体质指数18.11~27.78 kg/m2,平均体质指数(23.76±2.81)kg/m2。因腰痛就诊1例,体检发现27例。所有患者术前均无血尿症状,其中5例既往有腹部大手术史,术前ASA评分1~3分,平均ASA评分(1.82±0.48)分。28例均为单侧单发肿瘤,左侧15例,右侧13例,肿瘤直径1.5~6.5 cm,平均直径(3.76±1.28)cm,其中内生性肾癌13例,T1b期肾癌12例,近肾门肾癌7例,解剖性孤立肾肾癌2例(1例为先天性孤立肾,另1例既往因对侧肾癌曾行对侧肾癌根治术)。肾肿瘤复杂程度的评价由两名住院医师分别依据术前影像学(CT或MRI)资料,按照文献中描述的肾肿瘤解剖学特征PADUA评分系统规则进行评分[3],评分有争议者由上级医师裁决。本组肿瘤PADUA评分为7~12分,平均评分(9.07±1.25)分(典型病例见图 1、图 2)。本研究经第二军医大学长海医院医学伦理委员会批准后实施,所有患者术前均详细告知手术风险,患者知情同意后实施手术。
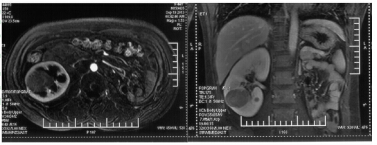 | 图 1 右侧孤立肾内生性T1b期肾癌CT图像(典型病例1) |
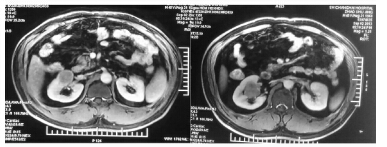 | 图 2 右侧肾门区T1a期肾癌CT图像(典型病例2) |
患者术前常规行血常规、尿常规、凝血功能、肝肾功能、血电解质、心电图、胸片、腹部超声等检查,排除手术禁忌证及远处转移灶,行双肾增强CT或MRI明确肾癌诊断,行肾脏动静脉CT增强造影了解患肾血管分布和变异情况以及肿瘤与肾主要血管的相对位置关系。所有患者术前均行肾脏核素扫描(ECT)以确定患侧肾脏肾小球滤过率(GFR)基线。术后第1年每3个月复查血常规、肾功能、胸片、腹部超声或双肾CT,此后每6个月复查1次,所有患者在手术后第1个月复查肾ECT了解患肾GFR下降情况。 1.3 手术方法
患者采用全身麻醉,健侧卧位,腰部抬高,头部及下肢放低,取腋中线髂前上棘上2 cm长约1.5 cm切口,逐层分离至后腹膜间隙,手指钝性推开腹膜后采用球囊扩张法建立后腹腔间隙,置入12 mm Trocar及30°腹腔镜,气腹压力维持在12~14 mmHg(1 mmHg=0.133 kPa),腹腔镜直视下分别于肋缘下腋前线和腋后线交点切口,置入12 mm(惯用手侧)和5 mm Trocar以及腹腔镜器械。清除腹膜外脂肪,近腰大肌侧纵性切开Gerota筋膜,于肾脂肪囊外肾背侧游离至肾蒂,暴露患肾动脉长约1~2 cm并用丝线圈套标记,待阻断。根据影像学资料所示肿瘤位置确定肾脏游离的范围,上极或肾门侧的肿瘤须游离肾脏上极和肾内侧面以获得较满意的肾脏游离度。剔除肾肿瘤及周边正常肾组织表面的脂肪,撤除腹腔镜器械。根据肿瘤位置,延长其中一个穿刺孔,长度以方便操作为限,进入腹膜后腔,湿纱布垫高并牵引已充分游离的患肾至腰部小切口,亚甲蓝标记肿瘤边界,肿瘤大部分内生至完全性内生者使用术中超声检查帮助确定肿瘤边界及深度。阻断患肾动脉并立即于肾周放置冰屑降温,冷缺血条件下距肿瘤边界约0.2~0.5 cm切除肿瘤,2-0薇乔线连续或“8”字缝合裸露的肾创面血管和集合系统残端,1-0薇乔线距创缘0.5 cm以缘对缘连续缝合的方式关闭肾脏创面,肾表面出针处以Hem-o-lok夹适当加压固定。恢复患肾动脉血供,记录阻断时间,同时移除冰屑并用温水复温肾脏,确认术区无活动性出血后,于腹膜后腔放置引流管1根,逐层关闭各手术切口。 2 结 果
28例患者均顺利完成手术,手术时间135~280 min,平均手术时间(213.82±40.04)min;肾脏冷缺血时间11~33 min,平均冷缺血时间(23.88±5.98)min;手术出血量50~400 mL,平均出血量(191.07±94.33)mL;手术切口长度5~12 cm,平均(9.48±1.56)cm。术中冰冻病理示肿瘤切缘均为阴性,术后病理检查示肾透明细胞癌19例、乳头状癌2例、嫌色细胞癌2例、未分类肾细胞癌5例。术后2例患者出现短暂性高热,经对症处理后体温恢复正常。术后患者切口疼痛评分1~2分,平均疼痛评分(1.11±0.31)分。患者术后住院时间7~25 d,平均(11.54±3.98)d,均正常出院。所有患者术中、术后均未输血,住院期间无继发出血、尿漏等严重手术并发症发生。术后随访3~44个月,平均随访时间(21.46±12.15)个月。随访期间,所有患者均未出现肾癌局部复发或远处转移,术后患侧肾脏GFR下降0.71%~50.72%,平均下降(21.71±11.48)%。 3 讨 论
保留肾单位的开放性肾部分切除术和经腹腔镜肾部分切除术各具优势。开放手术的优点在于可以用双手直接进行操作,手术过程灵活、便捷、易于掌握,能够显著降低肿瘤切除和创面重建过程中的技术难度,几乎适用于所有适合行保留肾单位手术的肾肿瘤,其缺点是手术创伤大,为了游离肾蒂和肾周,通常需要较大的手术切口,有时甚至需切除部分肋骨。腹腔镜手术在这方面具有绝对的微创优势[4],然而其多用于解剖特征相对简单的肾肿瘤。本研究将肾部分切除术的操作过程进行主动分解,先通过后腹腔镜游离肾脏及肾血管,再经腰部小切口开放操作完成低温环境下的肿瘤切除和肾单位重建,成功完成28例复杂性T1期肾肿瘤的肾部分切除术。其中PADUA评分8~9分和≥10分者分别为19例和7例,而评分较低的6~7分者1例为肾脏中极肿瘤,术前曾考虑为囊性肾癌,另1例为近肾门部肿瘤,既往有腹部大手术史。Ficarra等[3]报道,PADUA评分8~9分和≥10分者被认为是高度复杂的肾脏肿瘤,行肾部分切除术时发生手术并发症的风险分别是6~7分者的14倍和30倍。而本组所有病例术中及术后均未观察到大出血、尿漏等严重手术并发症,不良事件发生率远远低于报道所述,说明该术式在处理解剖结构高度复杂的局限性肾癌时具有较高的可行性和安全性。
在保留肾单位手术中,肾肿瘤自身的解剖学特征是影响手术方式选择、手术进程以及手术结局的重要因素,其中以肿瘤的大小、位置以及生长深度的影响最为明显。研究表明,随着肿瘤体积的增大,肿瘤涉及肾脏集合系统或深部血管的概率相应增加[5]。因此,与T1a期肾肿瘤相比,T1b期肾肿瘤在重建保留肾单位过程中不但需要缝合的创面面积有所增加,其需要进行肾盂集合系统或血管残端修补的概率也明显增加[6]。缝合不严密往往会导致术后出血或尿漏等严重的手术并发症。通过小切口开放代替经腹腔镜缝合手术创面,不但显著降低了手术的操作难度,还能通过触觉感知保证缝合的确切程度,有效降低手术的风险。
对于肾门区或中央型的肿瘤,缝合操作也是其技术难点。肾门肿瘤与肾血管或其主要分支关系密切,术中误伤肾血管的机会增加,而靠近中极的肿瘤切除后,受肾脏张力的影响,缝合的创面容易对合不良。这两个部位肾肿瘤术中、术后出血的风险均较大。所以在直视下充分进行创面缝合,选择恰当的进针和出针位置,避开主要的血管分支,使手术创缘严密对合是此类肿瘤保留肾单位手术成败的关键。这些特殊部位的肿瘤实施腹腔镜辅助的小切口肾部分切除术,同样能体现小切口在缝合方面的优势。同时,由于小切口手术经腹腔镜操作已充分游离肾血管和肾脏,在无需扩大手术切口的情况下即可获得足够的肾脏活动度,此时再结合较小的切口即可实现满意的肿瘤暴露,手术操作难度并不会因为切口缩短而较传统开放手术有所增加。本组切口平均长度(9.48±1.56)cm,较传统开放手术明显缩短。
与肾门区或中央型肿瘤有所不同,内生性肿瘤手术的难点不光在于手术创面缝合,还在于术中如何判断肿瘤位置、确定手术范围。由于内生性肿瘤位置深在,肾脏轮廓通常没有改变,仅凭影像学资料或肉眼观察无法确定肿瘤的确切部位和涉及范围。因此,在实施此类肿瘤的腹腔镜肾部分切除术时,常需配备特殊的超声探头经穿刺孔探测肿瘤,然而腹腔镜专用的探头价格昂贵,且需专门购置,限制了腹腔镜手术的应用[7]。但在小切口条件下,利用普通高频探头超声即能完成内生性肿瘤的实时定位,术者在切除肿瘤的同时通过触觉还能直观地感知肿瘤与正常组织间的质地差异,有利于随时调整切除的界限和深度,保证肿瘤包膜的完整性,最大限度保留肾功能[8]。纳入本研究的13例内生性肾癌,术中均采用上述普通超声设备探测肿瘤,手术切缘均为阴性,术后随访期内均未发现肿瘤局部复发。
除了防止手术并发症、降低切缘阳性率,保留肾单位手术的另一核心问题是如何缩短肾脏热缺血时间、最大限度地保护肾功能。通常来说,解剖特征越复杂的肾肿瘤,由于操作难度增高,热缺血时间也相应延长,对于孤立肾肾肿瘤患者,这种风险进一步增大。而合理地选择手术技术有助于缩短热缺血时间。Gill等[9]回顾分析了1 800例经腹腔镜和开放性肾部分切除术的平均缺血时间,分别为30.7 min和20.1 min,虽然开放手术组中复杂性肾癌的比例更高,但缺血时间却明显短于腹腔镜手术组,说明开放操作在缩短肾缺血时间方面具有优势。降温措施也有助于肾功能的保护。有研究表明,常温下肾脏对缺血的耐受时间仅为20 min,而低温情况下可延长至30 min[10]。通过经腰的小切口,能够方便地采用冰屑降温等方式低温保护患肾,为严密、确切地缝合操作争取时间。本组手术平均肾脏冷缺血时间为(23.88±5.98)min,略长于Gill等[9]报道的开放手术肾缺血时间,可能原因为研究人群的构成不同,本研究仅以手术操作难度较大的复杂性肾癌作为研究对象。纳入本研究的2例孤立肾肾癌患者,术后及随访期内均未出现少尿和肾功能不全。
值得注意的是,大型医疗机构利用机器人辅助实施的腹腔镜肾部分切除术数量不断增加,其中部分病例也是解剖特征复杂的早期肾肿瘤,同样取得了良好的效果,为难度较大的保留肾单位手术提供了一种新颖的手术方式。通过机械臂控制并完成肿瘤切除和肾脏重建,不但能大大降低手术操作的难度,还能实现手术创伤的最小化,是顺应微创时代手术理念的理想术式[11]。然而,机器人辅助手术设备价格昂贵,手术费用高,尚难以普及,不适合我国当前的国情。本研究旨在从手术技术层面探讨如何利用有限的技术和设备安全有效地实施复杂性T1期肾癌的保留肾单位手术。考虑到后腹腔镜技术在我国泌尿外科领域具有良好的应用基础,而联合经腰小切口又能够在一定程度上降低手术的操作难度,可以较好地平衡手术创伤、安全以及预后之间的矛盾,因此腹腔镜辅助小切口肾部分切除术是一种适合现阶段国内大多数医院开展的保留肾单位术式。
综上所述,后腹腔镜联合经腰小切口肾部分切除术治疗复杂性T1期肾癌疗效满意,技术上安全、可行,在单纯腹腔镜操作困难的条件下能够代替传统开放手术,用于复杂性早期肾癌的保留肾单位手术治疗,具有创伤相对较小、易于操作等优点,值得具备初步腹腔镜手术技能并有开放肾部分切除术经验的医生掌握和使用。本研究的局限性在于研究的性质为回顾性研究,病例选择上可能存在偏倚,样本量相对较小,随访时间较短,其远期疗效尚需大样本随机对照研究和长期随访观察。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Smaldone M C, Kutikov A, Egleston B, Simhan J, Canter D J, Teper E,et al. Assessing performance trends in laparoscopic nephrectomy and nephron-sparing surgery for localized renal tumors[J]. Urology, 2012, 80: 286-291. |
| [2] | Lane B R, Campbell S C, Gill I S. 10-year oncologic outcomes after laparoscopic and open partial nephrectomy[J]. J Urol, 2013, 190: 44-49. |
| [3] | Ficarra V, Novara G, Secco S, Macchi V, Porzionato A, De Caro R, et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery[J]. Eur Urol, 2009, 56: 786-793. |
| [4] | Kaneko G, Miyajima A, Kikuchi E, Nakagawa K, Oya M. The benefit of laparoscopic partial nephrectomy in high body mass index patients[J]. Jpn J Clin Oncol, 2012, 42: 619-624. |
| [5] | Porpiglia F, Fiori C, Bertolo R, Scarpa R M. Does tumour size really affect the safety of laparoscopic partial nephrectomy?[J]. BJU Int, 2011, 108: 268-273. |
| [6] | Porpiglia F, Fiori C, Piechaud T, Gaston R, Guazzoni G, Pansadoro V, et al. Laparoscopic partial nephrectomy for large renal masses: results of a European survey[J]. World J Urol, 2010, 28: 525-529. |
| [7] | Nadu A, Goldberg H, Lubin M, Baniel J. Laparoscopic partial nephrectomy (LPN) for totally intrarenal tumours[J]. BJU Int, 2013, 112: E82-E86. |
| [8] | 纪家涛,王林辉,刘 冰,徐 斌,孙颖浩. 经后腹腔镜辅助小切口超声引导下中心型肾癌部分切除术12例报道[J]. 第二军医大学学报, 2013, 34: 338-340. Ji J T,Wang L H,Liu B,Xu B,Sun Y H.Retroperitoneal laparoscopic partial nephrectomy combined with auxiliary small-incision and real-time B ultrasonic imaging in treatment of central renal cell carcinoma: a report of 12 cases[J].Acad J Sec Mil Med Univ,2013,34:338-340. |
| [9] | Gill I S, Kavoussi L R, Lane B R, Blute M L, Babineau D, Colombo J R Jr, et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors[J]. J Urol, 2007, 178: 41-46. |
| [10] | Thompson R H, Frank I, Lohse C M, Saad I R, Fergany A, Zincke H, et al. The impact of ischemia time during open nephron sparing surgery on solitary kidneys: a multi-institutional study[J]. J Urol, 2007, 177: 471-476. |
| [11] | Rogers C G, Singh A, Blatt A M, Linehan W M, Pinto P A. Robotic partial nephrectomy for complex renal tumors: surgical technique[J]. Eur Urol, 2008, 53: 514-521. |
 2015, Vol. 36
2015, Vol. 36


