2. 同济大学附属上海市肺科医院肺循环心内科, 上海 200433;
3. 中国医学科学院阜外医院心血管内科, 北京 100730
2. Department of Cardio-pulmonary Circulation, Shanghai Pulmonary Hospital, Tongji University, Shanghai 200433, China;
3. Department of Vasculocardiology, Fuwai Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China
肺动脉高压(pulmonary arterial hypertension,PAH)是一类以小肺动脉血管重构为特征的恶性肺血管疾病,往往由于肺血管阻力进行性升高并最终导致右心衰竭而死亡[1]。1992年前由于缺乏特异性PAH靶向治疗药物,特发性PAH成人患者的中位生存时间为2.8年,儿童仅为0.8年[2, 3]。随着对PAH发病机制的研究,包括内皮细胞的失调、血管平滑肌细胞的增生、原位血栓的形成以及血管扩张和收缩的失衡等[4, 5, 6, 7, 8, 9],靶向药物治疗中前列环素途径、NO途径及内皮素途径得到了开发[10],自1995年依前列醇经美国FDA批准上市以后,PAH药物治疗开始进入靶向药物治疗时代。
波生坦是一种双重内皮素受体拮抗剂,既往研究显示波生坦可明显改善PAH 患者的活动耐量及血流动力学指标、推迟临床恶化时间、提高生存率[11, 12, 13, 14]。但是PAH 仍然是进行性进展且有较高死亡率的一类疾病[15, 16, 17, 18],因此3个途径的靶向药物治疗手段之间的联合治疗在临床中得到广泛应用。目前有资料显示波生坦联合治疗较单药治疗可明显改善患者的活动耐量、血流动力学指标、临床恶化时间及生活质量[19, 20, 21, 22]。但对波生坦联合其他靶向药物治疗PAH的长期疗效及安全性的研究有限。本研究对入选的104例PAH患者进行长期随访,评价波生坦联合其他靶向药物长期治疗后的效果及其安全性,并将起始联合与序贯治疗这两种联合方案进行比较,以期进一步指导临床用药。 1 资料和方法 1.1 研究对象
选取自2007年7月至2013年1月在上海市肺科医院肺循环心内科就诊的第一大类PAH患者为研究对象。随访截止时间为2013年6月。对规律服用波生坦并长期随访的患者进行开放性、非对照性研究。本研究经上海市肺科医院医学伦理委员会批准,所有入选患者均签署知情同意书。
入选标准:右心导管检查测得静息状态下肺动脉平均压(mPAP)≥25 mmHg(1 mmHg=0.133 kPa),且肺毛细血管楔压(PCWP)≤15 mmHg;根据2009 ESC/ERS肺高血压临床分类归为第一大类PAH;WHO PAH患者心功能分级Ⅰ~Ⅳ级。排除标准:其他类型PAH;急性肺血管试验阳性患者;服用波生坦的时间<3个月;单用波生坦治疗;mPAP<25 mmHg或PCWP>15 mmHg或肺血管阻力(PVR)<3 Wood U/m2;肾功能不全(血清肌酐Scr>220 mmol/L);肝功能不全[丙氨酸转氨酶(ALT)>120 IU/L]。将吸入伊洛前列环素前后mPAP降低≥20%、心指数(cardiac index,CI)无变化或变化不明显、PVR与体循环阻力(SVR)比值下降或无明显变化定义为急性肺血管阳性。 1.2 研究方法
纳入联合使用波生坦的患者104例,并将患者按起始联合治疗和序贯治疗分成两组进行长期随访。起始联合治疗:开始即为波生坦联合其他靶向药物治疗(如贝前列素钠、西地那非、伐地那非、吸入伊洛前列环素等);序贯治疗:起始单用波生坦治疗,后因病情加重加用其他靶向药物进行治疗。所有患者在进行波生坦治疗前均需进行WHO PAH功能分级评估,根据治疗前后WHO分级变化情况分为改善(较治疗前WHO分级下降)、稳定(治疗前后分级无变化)和恶化(较治疗前WHO分级升高)。患者服用波生坦起始剂量均为靶向剂量的一半,若耐受良好,4周后可加量至靶向剂量,同时可给予吸氧、利尿、抗凝、强心等支持治疗,儿童患者根据国际标准即体质量在10~20 kg之间靶向治疗剂量为31.25 mg、2次/d给药;体质量20~40 kg治疗剂量为62.5 mg、2次/d;体质量>40 kg靶向治疗剂量可至125 mg、2次/d。因波生坦主要经肝脏代谢,可能会引起肝功能的损害,故开始服用波生坦的2个月内需每2周复查1次肝功能指标,此后每月1次。波生坦治疗至少1年再次对肝功能指标[ALT、天冬氨酸转氨酶(AST)]、超声心动图相关指标[肺动脉收缩压(PASP)、右房室瓣瓣环收缩期位移(TAPSE)、偏心指数(EI)、射血分数(EF)、右室横径大小(RV-T size)、右房横径大小(RA-T size)]、血流动力学指标[肺动脉收缩压(sPAP)、mPAP、右房平均压(mRAP)、心排量(CO)、CI、PVR、混合静脉血氧饱和度(SvO2)]进行检测。
按波生坦联合药物的种类分为波生坦+磷酸二酯酶抑制剂(波生坦+西地那非、波生坦+伐地那非)、波生坦+前列环素(波生坦+贝前列素钠、波生坦+伊洛前列环素)、波生坦+磷酸二酯酶抑制剂+前列环素(波生坦+西地那非+贝前列素钠、波生坦+伐地那非+贝前列素钠、波生坦+西地那非+伊洛前列环素、波生坦+伐地那非+伊洛前列环素)三大类。 1.3 统计学处理
应用SPSS 19.0统计软件进行数据处理及分析。计量资料以 x±s或中位数(四分位数间距)表示;计数资料以率(%)表示。 计量资料均进行正态分析,正态分布资料采用配对t检验,非正态分布资料则采用非参数检验(Mann-Whitney U检验或Krusakal-Wallis检验);计数资料采用 χ2检验或Fisher精确概率检验。计算生存率从开始使用波生坦治疗到死亡或截止日期(停药时间或最后随访时间),通过Kaplan-Meier在相关时间点的95%CI进行评估,同时可对不同诊断组进行log-rank检验,比较差异有无统计学意义。检验水准(α)为0.05。
2 结 果 2.1 基线资料特征
104例PAH患者入选此次研究,其中特发性PAH 48例,先天性心脏病相关性PAH 42例,结缔组织疾病相关性PAH 12例,门静脉高压相关性PAH 1例,药物相关性PAH 1例。 70例(67.3%)患者为WHO功能分级Ⅲ~Ⅳ级。年龄3~76岁,平均年龄(30.6±20.2)岁,其中儿童31例。 男女比例为34∶70。起始联合组和序贯治疗组分别为47例和57例。序贯治疗组中WHO PAH功能分级Ⅲ~Ⅳ级患者比例高于起始联合组(75.4% vs 57.4%)。两组的6 min步行试验(6MWD)、N末端-脑钠肽前体(NT-proBNP)、超声心动图及血流动力学指标均较匹配,差异无统计学意义。见表 1。
|
|
表 1 患者的人口学统计及基线特征 Tab 1 Demographic and baseline characteristics of patients |
104例患者平均随访时间(22.6±15.8)个月,失访7例(因随访中与患者及家属联系不上,无法获得患者随访资料);除7例失访患者以外,有6例患者随访中WHO功能分级未详细记录。在91例PAH患者中,WHO肺高压功能分级明显改善的有6例(6.6%),稳定的有56例(61.5%),恶化的有29例(31.9%)。起始联合组和序贯治疗组中无明显恶化(改善及稳定)的患者分别占63.4%(26/41)和72.0%(36/50),两组差异无统计学意义(P=0.74)。随访(22.6±15.8)个月后,患者的6MWD变化不明显[(379.4±89.3)m vs (378.0±83.6)m,P=0.94],同时lgNT-proBNP由2.9±1.1下降至2.8±0.9,但差异均无统计学意义(P=0.15)。 2.3 超声心动图及血流动力学指标变化
65例患者在服药前后进行超声心动图各指标评估,平均随访时间为(25.1±12.7)个月。总体上估测PASP由(95.2±21.3)mmHg降至(88.6±24.4)mmHg,差异有统计学意义(P=0.009);EF由(73.6±9.34)%升至(77.4±9.02)%,差异有统计学意义(P=0.02)。其余各指标如EI等差异均无统计学意义。
48例患者服药前后进行右心导管检查,平均随访时间为(30.8±18.4)个月。服药后患者CO由(3.8±2.0)L/min升至(4.8±2.3)L/min(P=0.04);PVR由(16.4±8.4)Wood U/m2降至(13.9±8.0)Wood U/m2(P=0.06),其他血流动力学指标差异未见统计学意义,具体见表 2。
|
|
表 2 患者治疗前后超声心动图及血流动力学指标的比较 Tab 2 Echocardiography and hemodynamics changes before and after treatment with bosentan for all patients |
97例患者最终完成随访,7例失访(6.7%),其中起始联合组失访2例,序贯治疗组失访5例,最长随访时间为75个月。因右心衰竭死亡15例,其中起始联合组4例,序贯治疗组11例;停用波生坦7例,其中因病情较重更改药物如安立生坦或伊洛前列素等4例(起始联合组2例,序贯治疗组2例),因经济原因停用2例(起始联合组1例,序贯治疗组1例),因颜面部水肿明显停药1例(序贯治疗组1例)。73例(70.2%)患者至少随访1年。因6例患者接受波生坦治疗不足1年但因死亡或病情加重停用波生坦,所以无法对其长期随访结果进行分析。97例患者中仅1例特发性PAH患者出现颜面部水肿明显而停用波生坦,停药后口服利尿剂水肿逐渐消退;其他患者对波生坦耐受性良好,未发现肝酶明显升高等不良反应(表 3)。
|
|
表 3 患者治疗前后肝功能指标的比较 Tab 3 Liver function indices before and after treatment with bosentan for all patients |
对97例患者进行Kaplan-Meier生存分析,估测 1、2、3、4和5年生存率分别为92.5%、83.7%、71.7%、67.2%和57.6%(图 1A)。起始联合组1、2、3和4年生存率分别为95.1%、88.9%、84.2% 和77.7%;序贯治疗组1、2、3和4年生存率分别为92.3%、79.4%、53.3% 和26.6%,两组生存率差异有统计学意义(P=0.038,图 1B)。
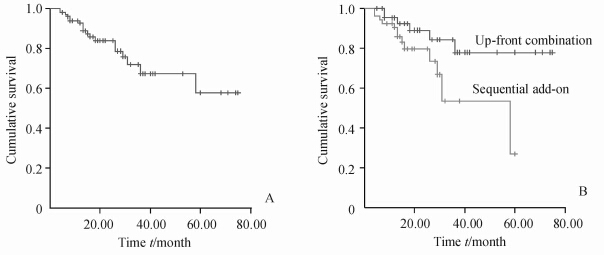 | 图 1 患者长期生存率分析(Kaplan-Meier法) Fig 1 Kaplan-Meier survival analysis of all patients A:Suivival rate of all patients (n=97); B:Suivival rates of patients in the up-front combination therapy (n=45) and sequential add-on therapy (n=52) groups |
目前国外研究已经证实波生坦联合治疗效果明显优于单药治疗[19, 20, 23, 24, 25, 26, 27],但其长期疗效及安全性尚不清楚。我们通过对104例联合使用波生坦的PAH患者进行长期随访发现:治疗后68.1%患者WHO PAH功能分级无明显恶化,6MWD和NT-proBNP较治疗前差异无统计学意义,超声心动图示PASP较治疗前下降,右心导管测得CO增加,这些与国外报道的一些结果类似。BREATHE-2试验[19]是第1项有关波生坦联合治疗的双盲、随机、安慰剂对照试验。所有患者起始即使用波生坦联合依前列素治疗,但试验组与安慰剂组相比,患者的血流动力学指标、活动耐量及WHO PAH功能分级无明显改善,考虑可能是试验样本量偏少(n=33)导致的结果偏倚。然而在STEP研究[23]中,服用波生坦联合吸入伊洛前列素可明显改善患者的临床症状和血流动力学指标。波生坦联合西地那非治疗PAH 3个月后患者的6MWD较治疗前明显改善(P=0.007),摄氧峰值(POU)也明显增加(P=0.006)[20]。另一项在单用波生坦治疗明显恶化的患者时加用西地那非的研究发现治疗特发性PAH患者加用西地那非后6MWD较前有明显改善(P=0.05),但对系统性硬化症患者却无明显改善[26]。2005年Hoeper等[27]进行了一项回顾性对照研究,入选123例NYHA心功能Ⅲ~Ⅳ的PAH患者,并进行goal-oriented治疗[即6MWD超过380 m;POU值大于10.4 mL/(min·kg);活动后的收缩压峰值应大于120 mmHg]。 所有患者首先给予波生坦治疗,若未达到上述指标则加用西地那非联合治疗,联合治疗一段时间后仍不达标则加用吸入伊洛前列素三联治疗,并进行长期随访(约3年),结果显示在完成随访的118例患者中,51例需联合治疗(43.2%),19例最终需三联治疗(16.1%),同时联合治疗后的患者生存率有明显改善(P=0.047)。所以长期波生坦联合治疗可改善PAH患者的症状。
本研究发现联合治疗后患者1、2、3、4和5年生存率分别为92.5%、83.7%、71.7%、67.2%和57.6%,较国外报道单药治疗的患者生存率(1、2、3、4和5年生存率分别为95%、83%、78%、61%和41%)[28]在前3年无明显差异,从第4年开始有所改善。这表明相对于单药治疗,长期联合波生坦治疗对患者的预后更有效。同时我们还发现起始联合组生存率优于序贯治疗组(P=0.038)。目前国内外有关这两种治疗方案的选择尚无报道。在我们的研究中起始联合组45例,序贯治疗组52例,两组基线资料基本匹配。虽然两组PAH功能分级Ⅲ~Ⅳ级患者的比例有一些差别(57.4% vs 75.4%),但随访时间较长,存在选择偏倚可能性较小,所以可以认为对于PAH功能分级为Ⅲ~Ⅳ级的PAH患者,起始联合治疗效果优于序贯治疗。
本研究最后完成随访的97例患者中,仅有1例患者因颜面部水肿明显而停药,停药后口服小剂量利尿剂后水肿明显消退,未出现其他不良反应(如肝酶的升高等)。目前报道的有关波生坦联合治疗后出现的不良反应主要有下肢水肿、头痛、颜面部潮红、腹泻、肝酶升高等[19, 20, 23],尚无因联合使用波生坦而导致的严重不良后果甚至死亡的报道。这说明波生坦长期联合治疗的安全性良好。
本研究结果显示波生坦联合治疗后患者肺动脉压力及肺血管阻力下降不明显,但CO增加,生存率改善,可能原因为:患者肺动脉主干血管狭窄改善不明显而侧生出小血管即侧支循环,导致CO增加。国外很早曾报道过支气管侧支循环可增加心脏的回心血量且不会导致左室舒张末期压力过高[29]。但这些还有待于大量组织病理学研究进一步证实。
本研究也存在一些缺陷:(1)本研究是一项回顾性研究且缺乏对照。(2)由于PAH靶向药物费用较高,且目前没有纳入医保,长期联合使用会导致患者家庭经济负担较重,部分患者可能没有得到充分的治疗,其结果可能存在一定的偏倚。
综上所述,长期联合使用波生坦可维持PAH患者病情的稳定,增加心排出量且安全性良好;起始联合治疗患者生存预后优于序贯治疗。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Rubin L J. Primary pulmonary hypertension [J]. N Engl J Med,1997,336:111-117. |
| [2] | D'Alonzo G E,Barst R J,Ayres S M,Bergofsky E H,Brundage B H,Detre K M,et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry [J]. Ann Intern Med,1991,115:343-349. |
| [3] | Sandoval J, Bauerle O, Gomez A, Palomar A, Martinez Guerra M L,Furuya M E. Primary pulmonary hypertension in children: clinical characterization and survival [J]. J Am Coll Cardiol,1995,25:466-474. |
| [4] | Christman B W, McPherson C D, Newman J H, King G A,Bernard G R,Groves B M, et al. An imbalance between the excretion of thromboxane and prostacyclin metabolites in pulmonary hypertension [J]. N Engl J Med,1992,327:70-75. |
| [5] | Giaid A, Yanagisawa M, Langleben D, Michel R P,Levy R,Shennib H, et al. Expression of endothelin-1 in the lungs of patients with pulmonary hypertension [J]. N Engl J Med,1993,328:1732-1739. |
| [6] | Giaid A, Saleh D. Reduced expression of endothelial nitric oxide synthase in the lungs of patients with pulmonary hypertension [J]. N Engl J Med,1995,333:214-221. |
| [7] | Rubin L J. Pathology and pathophysiology of primary pulmonary hypertension [J]. Am J Cardiol,1995,75:51A-54A. |
| [8] | Humbert M, Morrell N W, Archer S L, Stenmark K R,MacLean M R,Lang I M, et al. Cellular and molecular pathobiology of pulmonary arterial hypertension [J]. J Am Coll Cardiol,2004,43(12 Suppl S):13S-24S. |
| [9] | Budhiraja R, Tuder R M, Hassoun P M. Endothelial dysfunction in pulmonary hypertension[J]. Circulation,2004,109: 159-165. |
| [10] | Humbert M, Sitbon O, Simonneau G. Treatment of pulmonary arterial hypertension [J]. N Engl J Med, 2004,351:1425-1436. |
| [11] | Channick R N, Simonneau G, Sitbon O, Robbins I M,Frost A,Tapson V F,et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension:a randomized placebo-controlled study[J]. Lancet, 2001, 358: 1119-1123. |
| [12] | Rubin L J, Badesch D B, Barst R J, Galie N,Black C M,Keogh A,et al. Bosentan therapy for pulmonary arterial hypertension [J]. N Engl J Med, 2002, 346: 896-903. |
| [13] | Gatzoulis M A, Beghetti M, Galiè N, Granton J,Berger R M,Lauer A,et al. Longer-term bosentan therapy improves functional capacity in Eisenmenger syndrome: results of the BREATHE-5 open-label extension study [J]. Int J Cardiol, 2008, 127: 27-32. |
| [14] | Sitbon O, McLaughlin W, Badesch D B, Barst R J,Black C,Galiè N,et al. Survival in patients with class Ⅲ idiopathic pulmonary arterial hypertension treated with first line oral bosentan compared with an historical cohort of patients started on intravenous epoprostenol [J]. Thorax, 2005, 60: 1025-1030. |
| [15] | Barst R J, Rubin L J, McGoon M D, Caldwell E J,Long W A,Levy P S. Survival in primary pulmonary hypertension with long-term continuous ontravenous prostacyclin [J]. Ann Intern Med,1994,121:409-415. |
| [16] | Provencher S, Sitbon O, Humbert M, Cabrol S,Jaïs X,Simonneau G. Long-term outcome with first-line bosentan therapy in idiopathic pulmonary arterial hypertension [J]. Eur Heart J, 2006, 27:589-595. |
| [17] | Sitbon O, Humbert M, Nunes H, Parent F,Garcia G,Hervé P,et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: prognostic factors and survival [J]. J Am Coll Cardiol,2002,40: 780-788. |
| [18] | McLaughlin V V, Shillington A, Rich S. Survival in primary pulmonary hypertension: the impact of epoprostenol therapy [J]. Circulation,2002, 106: 1477-1482. |
| [19] | Humbert M, Barst R J, Robbins I M, Channick R N, Galiè N, Boonstra A,et al. Combination of bosentan with epoprostenol in pulmonary arterial hypertension: BREATHE-2[J]. Eur Respir J, 2004,24: 353-359. |
| [20] | Hoeper M M, Faulenbach C, Golpon H, Winkler J,Welte T,Niedermeyer J. Combination therapy with bosentan and sildenafil in idiopathic pulmonary arterial hypertension [J]. Eur Respir J,2004,24:1007-1010. |
| [21] | Seyfarth H J, Pankau H, Hammerschmidt S,Schauer J,Wirtz H,Winkler J. Bosentan improves exercise tolerance and Tei index in patients with pulmonary hypertension and prostanoid therapy [J]. Chest,2005,128: 709-713. |
| [22] | Channick R N, Olschewski H, Seeger W, Staub T,Voswinckel R,Rubin L J. Safety and efficacy of inhaled treprostinil as add-On therapy to bosentan in pulmonary arterial hypertension [J]. J Am Coll Cardiol,2006,48:1433-1437. |
| [23] | McLaughlin V V, Oudiz R J, Frost A,Tapson V F,Murali S,Channick R N,et al. Randomized study of adding inhaled iloprost to existing bosentan in pulmonary arterial hypertension [J]. Am J Respir Crit Care Med,2006,174: 1257-1263. |
| [24] | Hoeper M M, Leuchte H,Halank M, Wilkens H, Meyer F J,Seyfarth H J, et al. Combining inhaled iloprost with bosentan in patients with idiopathic pulmonary arterial hypertension [J]. Eur Respir J,2006, 28:691-694. |
| [25] | Benza R L, Rayburn B K, Tallaj J A, Pamboukian S V, Bourge R C. Treprostinil-based therapy in the treatment of moderate-tosevere pulmonary arterial hypertension: long-term efficacy and combination with bosentan [J]. Chest,2008, 134:139-145. |
| [26] | Mathai S C, Girgis R E, Fisher M R, Champion H C,Housten-Harris T,Zaiman A,et al. Addition of sildenafil to bosentan monotherapy in pulmonary arterial hypertension [J]. Eur Respir J,2007,29:469-475. |
| [27] | Hoeper M M, Markevych I, Spiekerkoetter E, Welte T, Niedermeyer J. Goal-oriented treatment and combination therapy for pulmonary arterial hypertension [J]. Eur Respir J,2005,26:858-863. |
| [28] | Avellana P,Segovia J,Sufrate E,Gómez-Bueno M, García-Cosío Carmena M D,García-Pavía P,et al. Long-term (5 years) effects of bosentan in patients with pulmonary arterial hypertension [J]. Rev Esp Cardiol,2011, 64:667-673. |
| [29] | Endrys J,Král B,Eliás J,Hamet A. Left ventricular overload caused by collateral pulmonary circulation in chronic pneumopathies-myth or reality?[J].Cor Vasa,1981,23:121-125. |
 2015, Vol. 36
2015, Vol. 36


