海绵是海洋里最原始的多细胞动物,从2亿年前发展至今已有1万多种,占海洋动物种类的7%,是一个庞大的海洋家族,除针海绵属(Spongilla)约20种为淡水产外,其余均分布在海洋的潮间带到8 500 m深处营固着生活。海绵一直是海洋药物研究的热点,其次生代谢产物拥有丰富的化学结构和生物活性的多样性。目前从海绵中发现的海洋药物有3种已成功上市,为阿糖胞苷、阿糖腺苷和甲磺酸艾日布林,它们分别用于治疗急、慢性淋巴细胞和髓性白血病,单纯疱疹病毒感染,晚期、难治性乳腺癌,疗效显著[1]。
Acanthella属海绵为寻常海绵纲 (Demospongiae)软海绵目(Halichondrida)Axinellidae 科动物。该属海绵的次生代谢产物中富含连有异腈基 (-NC)、异硫氰酸酯 (-NCS) 和甲酰胺(-NHCHO) 等特殊含氮官能团的倍半萜和二萜。此类化合物在天然产物中极为罕见,被认为是Acanthella属海绵化学分类学上的标记成分[2, 3, 4]。这些化合物通常具有显著的生物活性如抗疟、抗虫、抗污损、抗肿瘤及抗菌活性[5, 6, 7, 8, 9, 10]。近年来,我国学者林厚文等[11, 12]从棘体海绵A. cavernosa中发现了27个kailihinene类二萜类化合物,这些化合物显示了显著的抗污损活性和中等的细胞毒活性。郭跃伟等[13, 14]从Acanthella sp.中发现了2个含有异腈基和异硫氰酸酯的新化合物,林文翰等[15]从 A. cavernosa 中发现了3 个新的A环降甾醇类化合物。
本课题组采用体外细胞毒活性追踪分离方法,对棘体的活性成分进行了系统研究。运用硅胶柱色谱、凝胶柱色谱以及高效液相色谱(HPLC)等分离纯化技术,对中国南海棘体海绵的次生代谢产物进分离纯化,得到7个化合物,并运用核磁共振、质谱等现代波谱技术结合文献报道对这7个化合物进行了结构鉴定。 1 材料和方法 1.1 样品
实验用棘体海绵于2011年采自中国南海西沙群岛,由中国科学院青岛海洋研究所李锦和研究员鉴定为Acanthella cavernosa。现保存在第二军医大学药学院海洋药物研究中心,编号为AC-1101。 1.2 主要仪器与试剂
Bruker Varian Avance-400核磁共振仪;Agilent 1100高效液相色谱仪(RID 检测器),Zorba 300-C18柱(250 mm×9.4 mm,5 μm);Sephadex LH-20凝胶由Amersham Pharmacia Biotech生产;TLC薄层板和柱色谱硅胶均由烟台黄务硅胶开发实验厂提供;开放柱色谱所用溶剂为分析纯,HPLC所用试剂为色谱纯,均由国药集团上海化学试剂公司生产。 1.3 次生代谢产物的提取与分离
将棘体海绵(Acanthella cavernosa,湿质量1.2 kg)机械粉碎,用丙酮(3×5 L)在室温下渗漉,渗至滤液由棕红色变到淡黄色; 合并提取液,减压浓缩得到总浸膏。将总浸膏混悬分散于水中,用二氯甲烷萃取4次,浓缩萃取液得到脂溶性浸膏(5 g)。将脂溶性浸膏混悬于90%的甲醇水溶液中,用石油醚萃取3次,浓缩萃取液得到石油醚层浸膏共1.2 g。石油醚层(1.2 g)采用硅胶柱色谱层析,以石油醚-乙醚(100∶0,99∶1,98∶2,95∶5,90∶10,80∶20,78∶22,75∶25,50∶50,0∶100) 和乙醚-甲醇(90∶10,0∶100)梯度洗脱,得到15个馏分ACP1~ ACP15。ACP7 (2 g)经过凝胶柱色谱(正己烷-二氯甲烷-甲醇=10∶10∶1)层析后,运用ODS柱色谱分离,得到24个馏分ACP7-1~24。ACP7-1 (11.5 mg)、ACP7-3 (18.8 mg)、ACP7-5 (30.9 mg)经过硅胶柱色谱层析,用石油醚-乙醚(50∶1,30∶1,20∶1)梯度洗脱,得到化合物 4 (0.7 mg)、 5 (2.0 mg)和 6 (4.0 mg)。 ACP7-6 (70.5 mg)经过凝胶柱色谱(正己烷-二氯甲烷-甲醇=10∶10∶1)和硅胶柱色谱(石油醚-乙醚=50∶1,30∶1,20∶1)分离,得到化合物 7 (8.6 mg)。 ACP13 (500 mg)经过凝胶柱色谱(正己烷-二氯甲烷-甲醇=10∶10∶1)和ODS柱色谱(80%~100% 甲醇)分离,得到5个馏分ACP13-1~5。ACP13-4 (140.7 mg)经过硅胶柱色谱(二氯甲烷-甲醇50∶1,30∶1,15∶1)和HPLC柱色谱(88% 甲醇)分离得到化合物 1 (5.0 mg)、 2 (4.6 mg)、 3 (5.2 mg)。 2 结 果
所得7种化合物的结构见图 1。
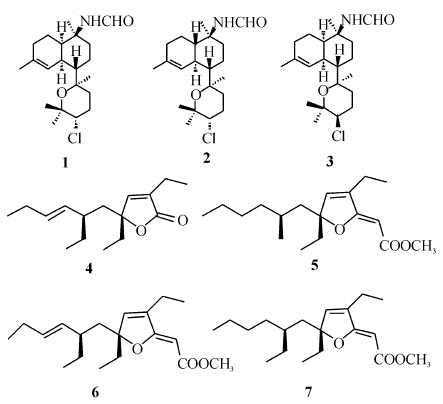 | 图 1 化合物1~7的结构式 1 :Kalihinene X; 2 : Kalihinene Y; 3 : Kalihinene Z; 4 : (R)-3,5-diethyl-5-[(S,E)-2-ethylhex-3-en-1-yl] furan-2(5H)-one; 5 : Methyl (2Z,6R,8S)-4,6-diethyl-3,6-epoxy-8-methyldodeca-2,4-dienoate; 6 : Methyl (2Z,6R,8R,9E)-3,6-epoxy-4,6,8-triethyl-2,4,9-dodecatrienoate; 7 : Methyl (2Z,6R,8S)-3,6-epoxy-4,6,8-triethyldodeca-2,4-dienoate |
无色结晶 (CH2Cl2),10%香草醛-硫酸显紫色,[α]25D +25.7° (c 0.05,CHCl3)。在1HNMR谱中,显示5个甲基氢信号1.21 (3H,s)、1.35 (3H,s)、1.42 (3H,s)、1.56 (3H,s)、1.61 (3H,s),一个连氯质子信号3.69 (1H,dd,J = 4.2,12.2 Hz),一个烯氢质子信号5.65 (1H,brs),一个甲酰胺氢信号8.22 (1H,d,J = 12.4 Hz,CHO)/5.76 (1H,d,J = 12.4 Hz,NH); 在13CNMR和DEPT谱中,显示一个甲酰胺基团信号(162.8),5个甲基,6个亚甲基,5个次甲基和4个季碳信号,包括一个连甲酰胺基团的碳信号(55.2),一个连氯碳信号(65.2),一个三取代烯碳信号(129.6,128.0)和两个连氧季碳信号(75.2,76.0)。碳氢信号归属如下:1HNMR (400 MHz,CDCl3) 反式异构体: 1.21 (3H,s,H3-18),1.35 (3H,s,H3-17),1.42 (3H,s,H3-16),1.56 (3H,s,H3-20),1.61 (3H,s,H3-19),3.69 (1H,dd,J = 4.2,12.2 Hz,H-14),5.65 (1H,brs,H-5),8.22 (1H,d,J = 12.4 Hz,CHO),5.76 (1H,d,J = 12.4 Hz,NH),1.5~2.5复杂; 13CNMR (100 MHz,CDCl3) 反式异构体: 45.9 (C-1),19.1 (C-2),30.6 (C-3),129.6 (C-4),128.0 (C-5),35.0 (C-6),50.8 (C-7),22.5 (C-8),32.7 (C-9),55.2 (C-10),76.0 (C-11),37.0 (C-12),27.5 (C-13),65.2 (C-14),75.2 (C-15),22.8 (C-16),30.5 (C-17),21.0 (C-18),23.2 (C-19),27.2 (C-20),162.8 (10-NHCHO)。以上数据与参考文献[8]对照基本一致,故确定化合物 1 为kalihinene X。 2.2 化合物 2 的结构鉴定
无色结晶(CH2Cl2),10%香草醛-硫酸显紫色,[α]25D +11.3° (c 0.05,CHCl3)。在1HNMR谱中,显示5个甲基氢信号1.21 (3H,s)、1.35 (3H,s)、1.42 (3H,s)、1.61 (3H,s)、1.65 (3H,s),一个连氯质子信号3.71 (1H,dd,J = 3.0,12.5 Hz),一个烯氢质子信号6.34 (1H,brs),一个甲酰胺氢信号8.27 (1H,d,J = 12.5 Hz,CHO)/5.61 (1H,d,J = 12.5 Hz,NH)。氢信号归属如下:1HNMR (500 MHz,CDCl3) 反式异构体: 1.21 (3H,s,H3-18),1.35 (3H,s,H3-17),1.42 (3H,s,H3-16),1.61 (3H,s,H3-20),1.65 (3H,s,H3-19),3.71 (1H,dd,J = 3.0,12.5 Hz,H-14),6.34 (1H,brs,H-5),8.27 (1H,d,J = 12.5 Hz,CHO),5.61 (1H,d,J = 12.5 Hz,NH),1.5~2.5复杂。以上数据与参考文献[8]对照基本一致,故确定化合物 2 为kalihinene Y。 2.3 化合物 3 的结构鉴定
无色结晶(CH2Cl2),10%香草醛-硫酸显紫色,[α]25D +11.6° (c 0.05,CHCl3)。在1HNMR谱中,显示5个甲基氢信号1.23 (3H,s)、1.34 (3H,s)、1.42 (3H,s)、1.43 (3H,s)、1.61 (3H,s),一个连氯质子信号3.95 (1H,t,J = 4.5 Hz),一个烯氢质子信号5.67 (1H,brs),一个甲酰胺氢信号8.23 (1H,d,J = 12.5 Hz,CHO)/5.68 (1H,m,NH); 在13CNMR和DEPT谱中,显示一个甲酰胺基团信号(162.8),5个甲基,6个亚甲基,5个次甲基和4个季碳信号,包括一个连甲酰胺基团的碳信号(56.7)、一个连氯碳信号(64.6)、一个三取代烯碳信号(130.3,128.0)和两个连氧季碳信号(73.8,76.0)。碳氢信号归属如下:1HNMR (400 MHz,CDCl3)反式异构体: 1.23 (3H,s,H3-18),1.34 (3H,s,H3-17),1.42 (3H,s,H3-16),1.43 (3H,s,H3-20),1.61 (3H,s,H3-19),3.95 (1H,t,J = 4.5,H-14),5.67 (1H,brs,H-5),8.23 (1H,d,J = 12.5 Hz,CHO),5.68 (1H,m),1.5~2.5复杂; 13CNMR (100 MHz,CDCl3)反式异构体: 45.8 (C-1),19.5 (C-2),30.6 (C-3),130.3 (C-4),128.0 (C-5),35.1 (C-6),48.6 (C-7),22.9 (C-8),33.5 (C-9),56.7 (C-10),76.0 (C-11),29.2 (C-12),25.7 (C-13),64.6 (C-14),73.8 (C-15),23.8 (C-16),29.3 (C-17),23.2 (C-18),23.2 (C-19),27.2 (C-20),162.8 (10-NHCHO)。以上数据与参考文献[8]对照基本一致,故确定化合物 3 为kalihinene Z。 2.4 化合物 4 的结构鉴定
无色油状(CH2Cl2),10%香草醛-硫酸显紫色,[α]25D +23.8° (c 0.05,CHCl3)。1HNMR谱中,显示4个连在仲碳上的甲基氢信号1.14 (3H,t,J = 7.0 Hz)、0.95 (3H,t,J = 7.2 Hz)、0.81 (3H,t,J = 7.5 Hz)、0.80 (3H,t,J = 7.5 Hz),3个烯氢质子信号6.82 (1H,t,J = 1.5 Hz)、5.25 (1H,dt,J = 6.5,15.0 Hz)、5.02 (1H,dd,J = 8.5,10.5 Hz)。氢信号归属如下:1HNMR (500 MHz,CDCl3) 6.82 (1H,t,J = 1.5 Hz,H-3),5.25 (1H,dt,J = 6.5,15.0 Hz,H-8),5.02 (1H,dd,J = 8.5,10.5 Hz,H-7),1.14 (3H,t,J = 7.0,H3-10),0.95 (3H,t,J = 7.2Hz,H3-12),0.81 (3H,t,J = 7.5 Hz,H3-14),0.80 (3H,t,J = 7.5Hz,H3-16)。以上数据与参考文献[16]对照基本一致,故确定化合物 4 为(R)-3,5-diethyl-5-[(S,E)-2-ethylhex-3-en-1-yl]furan-2(5H)-one。 2.5 化合物 5 的结构鉴定
无色油状(CH2Cl2),10%香草醛-硫酸显紫色,[α]25D +175.6° (c 0.05,CHCl3)。在1HNMR谱中,显示3个连在仲碳上的甲基氢信号0.87 (3H,t,J = 7.5 Hz)、1.17 (3H,t,J = 7.5 Hz)、0.79 (3H,t,J = 6.0 Hz),一个连在叔碳上的甲基氢信号0.88 (3H,d,J = 4.0 Hz),1个连在羰基上的甲基氢信号3.69 (3H,s),两个烯氢质子信号4.83 (1H,s)、6.22 (1H,brs)。氢信号归属如下:1HNMR (500 MHz,CDCl3) 4.83 (1H,s,H-2),6.22 (1H,brs,H-5),1.68 (1H,m,H-7),1.28 (1H,m,H-8),1.22 (1H,m,H-10),1.22 (1H,m,H-11),0.87 (3H,t,J = 7.5 Hz,H3-12),2.19 (1H,dd,J = 1.5,7.5 Hz,H-13),1.17 (3H,t,J = 7.5 Hz,H3-14),1.86 (1H,m,H-15),0.79 (3H,t,J = 6.0 Hz,H3-16),0.88 (3H,d,J = 4.0 Hz,H3-17),3.69 (3H,s,H3-18)。以上数据与参考文献[16]对照基本一致,故确定化合物 5 为methyl (2Z,6R,8S)-4,6-diethyl-3,6-epoxy-8-methyldodeca-2,4-dienoate。 2.6 化合物 6 的结构鉴定
无色油状(CH2Cl2),10%香草醛-硫酸显紫色,[α]25D+178.6° (c 0.05,CHCl3)。在1HNMR谱中,显示4个连在仲碳上的甲基氢信号0.95 (3H,t,J = 7.0)、0.78 (3H,t,J = 7.5 Hz)、0.77 (3H,t,J = 7.2 Hz)、1.15 (3H,t,J = 7.5 Hz),1个连在羰基上的甲基氢信号3.69 (3H,s)和4个烯氢质子信号4.80 (1H,d,J = 0.6 Hz)、6.18 (1H,brs)、5.03 (1H,dd,J = 15.5,8.0 Hz)、5.23 (dt,J = 15.5,6.5,6.0 Hz)。氢信号归属如下:1HNMR (500 MHz,CDCl3) 4.80 (1H,d,J = 0.6 Hz,H-2),6.18 (1H,brs,H-5),1.76(1H,m,H-7a),1.91 (1H,m,H-7b),1.77 (1H,m,H-8),5.03 (1H,dd,J = 15.5,8.0 Hz,H-9),5.23 (dt,J = 15.5,6.5,6.0 Hz,H-10),1.98 (1H,m,H-11),0.95 (3H,t,J = 7.0,H3-12),2.13 (1H,m,H-13),0.77 (3H,t,J = 7.2 Hz,H3-16),1.74 (1H,m,H-15a),1.83 (1H,m,H-15b),0.78 (3H,t,J = 7.5 Hz,H3-18),1.14 (1H,m,H-17a),1.36 (1H,m,H-17b),1.15 (3H,t,J = 7.5 Hz,H3-14),3.69 (3H,s,H3-19)。以上数据与参考文献[17]对照基本一致,故确定化合物 6 为methyl (2Z,6R,8R,9E)-3,6-epoxy-4,6,8-triethyl-2,4,9- dodecatrienoate。 2.7 化合物 7 的结构鉴定
无色油状(CH2Cl2),10%香草醛-硫酸显紫色,[α]25D+170.4° (c 0.05,CHCl3)。在1HNMR谱中,显示4个连在仲碳上的甲基氢信号0.87 (3H,t,J = 7.0 Hz)、1.14 (3H,t,J = 7.5 Hz)、0.79 (3H,t,J = 7.5 Hz)、0.80 (3H,t,J = 7.5 Hz),一个连在羰基上的甲基氢信号3.68 (3H,s)和两个烯氢质子信号4.81 (1H,s)、6.21 (1H,s)。在化合物的13CNMR和DEPT谱中,显示5个甲基碳信号14.1、12.1、8.1、10.6、50.5,两对3取代烯碳信号83.7、171.7、140.1、139.8和一个羰基碳信号166.9。碳氢信号归属如下:1HNMR (500 MHz,CDCl3) 4.81 (1H,s,H-2),6.21 (1H,s,H-5),1.60 (1H,dd,J = 14.5 Hz,5.0 Hz,H-7a),1.80 (1H,m,H-7b),1.23 (1H,m,H-8),1.12 (1H,m,H-9),1.17 (1H,m,H-10),1.28 (1H,m,H-11),0.87 (3H,t,J = 7.0 Hz,H3-12),2.18 (1H,ddd,J = 1.5,7.5,15.5 Hz,H-13),1.14 (3H,t,J = 7.5 Hz,H3-14),1.73 (1H,m,H-15a),1.86 (1H,m,H-15b),0.79 (3H,t,J = 7.5 Hz,H3-16),1.18 (1H,m,H-17),0.80 (3H,t,J = 7.5 Hz,H3-18),3.68 (3H,s,H3-19); 13CNMR (125 MHz,CDCl3) 166.9 (C-1),83.7 (C-2),171.7 (C-3),140.1 (C-4),139.8 (C-5),98.1 (C-6),41.7 (C-7),27.1 (C-8),34.4 (C-9),29.0 (C-10),23.0 (C-11),14.1 (C-12),18.6 (C-13),12.1 (C-14),31.7 (C-15),8.1 (C-16),34.3 (C-17),10.6 (C-18),50.5 (C-19)。以上数据与参考文献[17]对照基本一致,故确定化合物 7 为methyl (2Z,6R,8S)-3,6-epoxy-4,6,8-triethyldodeca-2,4-dienoate。 3 讨 论
本研究是对中国南海棘体海绵次生代谢产物的报道,化合物 4 ~ 7 为首次从Acanthella属海绵中分离得到的聚酮类化合物。
Acanthella属海绵的主要化学成分是含有异腈基、异硫氰酸酯、甲酰胺等基团的倍半萜和二萜类化合物,化合物 1 ~ 3 对藤壶幼虫Balanus amphitrite显示抗污损活性,EC50分别为0.49、0.45和1.1 μg/mL[8]; 对HCT-116、A549、HeLa、QGY-7701和MDA-MB-231细胞株显示中等细胞毒活性,IC50范围为6~18 μmol/L[12]。总结吡喃环上含氯原子的kalihinol类化合物的文献,发现14-Cl原子的相对构型可通过C-12的化学位移决定,当C-12的化学位移为28~33时14-Cl处于竖键上,当C-12的化学位移为37~40时14-Cl处于横键上,这符合γ邻位交叉效应(γ-gauche effect),即在吡喃环中当有较大基团处于竖键时会对γ位的C产生场效应,使其碳化学位移下降4~5,因此判断化合物 1 的Cl原子处于横键,而化合物 3 的Cl原子处于竖键。本次研究首次发现其含有聚酮类化合物,丰富了该属海绵次生代谢产物的多样性,在化学分类学上具有较大的意义。此类成分在棘体海绵化学防御机制中的生态作用还有待进一步研究。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 张书军, 焦炳华. 世界海洋药物现状与发展趋势[J]. 中国海洋药物杂志, 2012, 31:58-60. |
| [2] | Chang C W J, Patra A, Baker J A, Scheuer P J. Kalihinols, multifunctional diterpenoid anntibiotics from marine sponges Acanthella spp[J]. J Am Chem Soc, 1987, 109: 6119-6123. |
| [3] | Clark R J, Stapleton B L, Garson M J. New isocyano and isothiocyanato terpene metabolites from the tropical marine sponge Acanthella cavernosa [J]. Tetrahedron, 2000, 56: 3071-3076. |
| [4] | Bugni T S, Singh M P, Chen L, Arias D A, Harper M K, Greenstein M, et al. Kalihinols from two Acanthella cavernosa sponges, inhibitors of bacterial folate biosynthesis[J]. Tetrahedron, 2004, 60: 6981-6988. |
| [5] | Fusetani N, Yasumuro K, Kawai H, Natori T, Binnen L, Clardy J. Kalihinene and isokalihinol B, cytotoxic deterpene isonitriles from the marine sponge Acanthella klethra [J]. Tetrahedron Lett, 1990, 31: 3599-3602. |
| [6] | Alvi K A, Tenenbaum L, Crews P. Anthelmintic polyfunctional nitrogen-containing terpenoids from marine sponges[J]. J Nat Prod, 1991, 54: 71-78. |
| [7] | Miyaoka H, Shimomura M, Kimura H, Yamada Y. Antimalarial activity of kalihinol A and new relative diterpenoids from the Okinawan sponge, Acanthella sp.[J]. Tetrahedron, 1998, 54: 13467-13474. |
| [8] | Okino T, Yoshimura E, Hirota H, Fusetani N. Antifouling kalihinenes from the marine sponge Acanthella cavernosa [J]. Tetrahedron Lett, 1995, 36: 8637-8640. |
| [9] | Hirota H, Tomono Y, Fusetani N. Terpenoids with antifouling activity against Barnacle larvae from the marine sponge Acanthella cavernosa [J]. Tetrahedron, 1996, 52: 2359-2368. |
| [10] | Okino T, Yoshimura E, Hirota H, Fusetani N. New antifouling kalihipyrans from the marine sponge Acanthella cavernosa [J]. J Nat Prod, 1996, 59: 1081-1083. |
| [11] | Xu Y, Li N, Jiao W H, Wang R P, Peng Y, Qi S H, et al. Antifouling and cytotoxic constituents from the South China Sea sponge Acanthella cavernosa[J]. Tetrahedron, 2012, 68: 2876-2883. |
| [12] | Xu Y, Lang J H, Jiao W H, Wang R P, Peng Y, Song S J, et al. Formamido-diterpenes from the South China Sea Sponge Acanthella cavernosa [J]. Mar Drugs, 2012, 10: 1445-1458. |
| [13] | Sun J Z, Chen K S, Yao L G, Liu H L, Guo Y W. A new kalihinol diterpene from the Hainan sponge Acanthella sp.[J]. Arch Pharm Res, 2009, 32: 1581-1584. |
| [14] | Yan X H, Zhu X Z, Yu J L, Jin D Z, Guo Y W, Mollob E, et al. 3-Oxo-axisonitrile-3, a new sesquiterpene isocyanide from the Chinese marine sponge Acanthella sp.[J]. J Asian Nat Prod Res, 2006, 8: 579-584. |
| [15] | Qiu Y, Deng Z W, Xu M, Li Q, Lin W H. New A-nor steroids and their antifouling activity from the Chinese marine sponge Acanthella cavernosa[J]. Steriods, 2008, 73: 1500-1504. |
| [16] | Stierle D B, Faulkne D J. Metabolites of three marine sponges of the genus Plakortis [J]. J Org Chem, 1980, 45: 3396-3401. |
| [17] | Compagnone R S, Piña I C, Rangel H R, Dagger F, Suárez A I, Reddy M V R, et al. Antileishmanial cyclic peroxides from the Palauan Sponge Plakorth aff. angulospiculatus [J]. Tetrahedron, 1998, 54: 3057-3068. |
 2015, Vol. 36
2015, Vol. 36


