2. 重庆医科大学附属第一医院实验研究中心, 重庆 400016
2. Experiment Research Center, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
近年来,青少年暴力攻击事件逐年增加。暴力攻击即病理性攻击[1],受多种神经递质和激素的调控,其中睾酮起着关键作用。研究发现睾酮在青少年言语、躯体等暴力攻击中具有重要作用[2]。动物实验也证明睾酮水平的升高增加了雄性间攻击行为[3]。去势可使成年大鼠前额叶多巴胺水平降低及依赖于多巴胺功能的空间及其他工作记忆功能受损[4]。前额叶皮质不仅是认知行为控制的关键脑区,也是冲动行为控制的关键脑区,其结构受损[5]或活性降低[6]可导致攻击性增高。但睾酮对青春期大鼠病理性攻击行为及前额叶皮质突触结构可塑性的影响如何,目前国内外未见相关报道。 突触后致密物质95(postsynaptics density-95,PSD-95)是兴奋性突触后致密物(PSD)中的一种支架蛋白,在突触连接的形成和维持过程中具有重要作用,可在一定程度上反映突触发生和突触可塑性的情况。生长相关蛋白43(growth associated protein-43,GAP-43)是神经元发育和再生的一个内在决定因子[7],神经系统发育和损伤再生时,GAP-43表达升高。因此,本实验通过去势处理研究睾酮水平对青春期大鼠病理性攻击行为及前额叶皮质PSD-95和GAP-43的影响,为探索青春期暴力攻击的生物学机制和未来干预策略提供科学依据。 1 材料和方法 1.1 动物和试剂
出生21 d的雄性健康SD大鼠40只(购自重庆医科大学实验动物中心,清洁级,体质量40~60 g)。 ELISA睾酮试剂盒购自USCN公司,PSD-95抗体(sc-71933)和GAP-43抗体(sc-7457)购自Santa Cruz公司。 1.2 动物分组
将40只SD大鼠随机分为去势组、模型组、正常对照组,每组各10只,其余10只作为入侵鼠。对去势组进行摘除双侧睾丸手术,过程如下:消毒备皮,用10%的水合氯醛(100 mg/kg)进行麻醉,沿两膝连线处用直剪刀剪长约1~1.5 cm的切口,找到双侧睾丸,摘除,缝合。对模型组进行假手术,对照组不做处理。去势组和模型组采用单独笼子孤养,对照组和入侵组进行共养(每笼5只,每组两笼)。在自然昼夜周期光照、标准温度和湿度环境下饲养。 1.3 病理性攻击模型制作
去势组和模型组参照屈远等[8]和雷莉等[9]报道的方法建立病理攻击模型。(1)早年孤养:于出生后第21天(P21)开始持续进行孤养5周(自由进食水,正常条件温度、湿度)。(2)昼夜颠倒:自P21后进行昼夜颠倒,共持续5周(每日8:00至20:00遮蔽光照,20:00至次日8:00进行光照)。(3)非奖赏性挫败实验:自 P28开始,每天给予2%蔗糖水适应1周,至P35起,每次攻击实验前将蔗糖水浓度降至一半。(4)预激惹刺激及居住入侵实验:自P35起每天将入侵鼠单独放入居住鼠笼内,于笼子正中用一铁丝网将入侵鼠与居住鼠隔开,用坚果喂食入侵鼠,预激惹居住鼠5 min,随即将铁丝网取出,开始进行一次10 min居住-入侵攻击实验。每天1次,连续3周。 1.4 居住-入侵实验
各组大鼠于出生后57 d进行一次10 min居住-入侵实验,记录大鼠的攻击行为,行为评定采用盲法,由2名观察者观看录像后评估,取其平均值。大鼠攻击行为表现为:(1)攻击性理毛行为;(2)攻击性追逐行为;(3)嘶咬;(4)攀压;等。
定量标准为较短的攻击潜伏期、持续和频繁的攻击撕咬[10],而定性标准则为对于对方要害部位的攻击(头、腹、喉)[11]和独立于环境的攻击(攻击时忽视对方的性别、状态和环境)以及缺乏仪式行为(通过攻击/威胁比例来测量)[12]。 1.5 ELISA方法检测睾酮的浓度
在最后一次行为学检测24 h后,大鼠腹腔内注射10%的水合氯醛(100 mg/kg)进行麻醉,摘眼球取血,不抗凝,立即将血液离心(1 000×g,10 min)2次,抽取上层血清,置-80℃冰箱保存。按ELISA试剂盒说明书操作规范测定血清睾酮浓度。 1.6 蛋白质印迹法检测脑组织中PSD-95和GAP-43的表达
摘眼取血后断头取脑,根据大鼠脑立体定位图谱,取前额叶皮质,将其保存在液氮罐中,24 h后移至-80℃冰箱保存。取前额叶脑组织进行裂解、匀浆、取上清液。蛋白定量后进行聚丙烯酰胺凝胶电泳、电转膜,以5%脱脂奶粉TBST配制液封闭。封闭后分别用抗大鼠PSD-95(1∶500)、GAP-43(1∶200)抗体孵育,4℃过夜。复温,TBST洗膜3次(每次10 min),分别用辣根过氧化酶标记的山羊抗小鼠和兔抗羊IgG二抗孵育,37℃温箱放置2 h,TBST洗膜3次(每次10 min),DAB显色,曝光,显影,用凝胶成像系统分析结果并照相。 1.7 统计学处理
采用SPSS 16.0 统计软件,数据采用 ±s表示。3组间均数的比较采用单因素方差分析(方差齐)或秩和检验(方差不齐),两两之间比较用LSD-t检验。对睾酮和各个攻击指标之间进行Pearson相关分析。检验水准(α)为0.05。
2 结 果 2.1 三组大鼠睾酮水平及病理性攻击行为比较
去势组、模型组及对照组的睾酮水平分别为(1.15±0.13)、(3.32±0.21)、(4.19±0.21)ng/mL,差异有统计学意义(P<0.01),其中去势组和模型组睾酮水平明显低于对照组(P<0.01),且去势组明显低于模型组(P<0.01)。
去势组、模型组和对照组病理性攻击行为比较见表 1。三组间要害部位攻击次数、攻击/威胁比、屈服后继续攻击次数以及攻击潜伏期差异有统计学意义(P<0.01),其中去势组和模型组要害部位攻击次数、攻击/威胁比及屈服后继续攻击次数高于对照组,而攻击潜伏期低于对照组(P<0.01)。去势组屈服后继续攻击次数高于模型组,而攻击潜伏期时间短于模型组,差异均有统计学意义(P<0.01),但两组间要害部位攻击次数、攻击/威胁比差异无统计学意义(P>0.05)。
|
|
表 1 三组大鼠居住-入侵实验结果比较 Tab 1 Comparison of pathologically aggressive behaviors in resident-intruder test between the three groups |
睾酮浓度与危险部位攻击次数、屈服后继续攻击次数及攻击/威胁比呈负相关(r=-0.532,P<0.01;r=-0.750,P<0.01; r=-0.631,P<0.01),与攻击潜伏期呈正相关(r=0.730,P<0.01)。 2.3 三组前额叶皮质PSD-95和GAP-43蛋白表达水平的比较
去势组、模型组、对照组3组间前额叶皮质PSD-95和GAP-43蛋白表达水平差异均有统计学意义 (P<0.01),其中去势组、模型组前额叶皮质PSD-95、GAP-43蛋白表达量均低于对照组(P<0.05,P<0.01)。去势组前额叶皮质PSD-95和GAP-43蛋白表达水平均低于模型组(P<0.01)。见图 1。
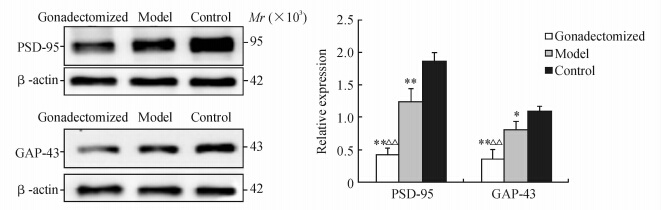 | 图 1 三组大鼠前额叶皮质PSD-95、GAP-43蛋白表达 Fig 1 Expression of PSD-95 and GAP-43 as detected by Western blotting analysis in the prefrontal cortex of rats *P<0.05,**P<0.01 vs control group; △△P<0.01 vs model group. n=10,x±s |
病理性攻击(又称异常攻击)是一种超出种属特异性的适应性不良的极端伤害性行为,有以下3点区别于普通攻击:(1)忽视屈服等社会信号;(2)攻击的强度与引发的刺激不匹配;(3)攻击潜伏期短、伤害性大。青春期是大脑和行为成熟的关键过渡期,而睾酮在此期间发挥着重要的调控作用,因此,它对青春期暴力攻击行为及其关键脑区前额叶皮质可塑性的影响值得探讨。
本实验研究结果显示模型组大鼠睾酮水平低于对照组,提示慢性应激可降低睾酮水平。既往研究证实不同类型的应激可引起大鼠血清睾酮水平降低[13],与本实验研究结果一致。而去势组大鼠睾酮水平明显低于模型组,与既往研究结果[14]一致,说明去势成功。与对照组相比,去势组和模型组大鼠攻击/威胁比显著增加,攻击潜伏期显著缩短,并出现对手屈服后继续攻击和对要害部位进行攻击等行为,以上4个指标中任何一个出现,则提示出现病理性攻击行为。去势组较模型组屈服后继续攻击次数增多,潜伏期缩短,说明去势后青春期大鼠病理性攻击行为进一步增强。Haug等[15]研究发现去势处理后的居住鼠对泌乳期雌性大鼠的攻击性增加,且其群体间的攻击性也增强,和本实验研究结果大致一致。但也有研究表明高睾酮浓度水平可增加成年雄性攻击行为[16, 17],与本实验研究结果相反。这些差异可能与本实验在去势处理后再采取应激方法造模有关。Lürzel等[18]发现青春期低睾酮水平可以增加丘脑-垂体-肾上腺皮质(hypothalamic-pituitary-adrenocortical,HPA)轴的应激反应,高睾酮水平可以抑制HPA轴应激反应。遭受躯体或精神心理应激可诱导机体内平衡状态紊乱,机体通常通过调整部分神经通路,激活HPA轴,或增加应激相关皮质酮水平来维持机体内平衡状态[19]。而HPA轴对攻击行为的调控有至关重要的作用,其高反应性及低反应性都介导了攻击行为的发生,尤其是在应激状态下[20]。结果提示去势组的病理性攻击行为增强可能是因为去势后低水平睾酮使得去势组大鼠HPA轴对应激更加敏感,继而出现HPA轴功能紊乱所致。本实验同时还发现睾酮水平和病理性攻击呈中-高度负相关,说明其他和应激密切相关的因素,例如血管加压素、内源性大麻素等也可能参与了青春期病理性攻击行为的产生。
此外,本实验结果还显示去势组前额叶皮质PSD-95、GAP-43蛋白表达水平低于模型组和对照组。有研究表明前额叶多个亚区,如眶额叶皮质、腹侧正中区及前扣带回皮质结构改变皆与病理性攻击相关[21],且前额叶皮质能够抑制下丘脑和杏仁体在攻击行为中的促发作用[22]。本课题组前期研究也提示病理性攻击大鼠前额叶神经元凋亡增多、突触明显改变,而杏仁体和下丘脑则无明显改变[23]。青少年中枢神经系统处于发育关键时期,对应激及性激素极其敏感,且应激可引起与攻击相关的神经内分泌及脑区结构改变[24],而低睾酮水平又可增加应激反应,可能进一步增加去势组前额叶皮质损伤。另有研究提示睾酮在神经精神疾病(例如:阿尔茨海默病、慢性认知损伤、抑郁症等)中具有神经保护作用,可促进神经元体细胞体积的增长,对突触发生及突触形成至关重要[25]。本研究显示去势后睾酮水平降低,前额叶皮质突触可塑性异常,提示去势组前额叶皮质可塑性异常可能与低睾酮水平相关。
综上所述,本研究证明低睾酮水平导致去势组大鼠病理性攻击行为增强、前额叶结构出现可塑性损伤。推测去势后病理性攻击行为增加可能与低水平睾酮导致的前额叶皮质突触可塑性损伤致下级攻击中枢及攻击相关脑区脱抑制相关,具体关系及其机制有待进一步探究。本研究存在一定的局限性:(1)仅从血清睾酮单因素方面研究,未涉及其他与应激相关的神经内分泌因素;(2)未探讨睾酮结合受体及其代谢物等因素的影响。未来研究需按低、中、高不同睾酮浓度水平,结合以上相关因素进一步研究睾酮对青春期大鼠病理性攻击行为及大脑可塑性的影响和机制,为探索青少年暴力攻击的预防和干预措施提供实验依据。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
志谢 衷心感谢重庆医科大学附属第一医院实验研究中心的技术指导和帮助!| [1] | 唐 平.病理性攻击行为的心理基础及其哲学本质[J].医学与哲学,2004,11:65-67. |
| [2] | Batrinos M L. Testosterone and aggressive behavior in man[J]. Int J Endocrinol Metab, 2012,10:563-568. |
| [3] | Wesson D W, McGinnis M Y. Stacking anabolic androgenic steroids (AAS) during puberty in rats: a neuroendocrine and behavioral assessment[J]. Pharmacol Biochem Behav,2006, 83: 410-419. |
| [4] | Kritzer M F, Brewer A, Montalmant F, Davenport M, Robinson J K. Effects of gonadectomy on performance in operant tasks measuring prefrontal cortical function in adult male rats[J].Horm Behav,2007, 51:183-194. |
| [5] | Pardini M, Krueger F, Hodgkinson C, Raymont V, Ferrier C, Goldman D, et al.Prefrontal cortex lesions and MAO-A modulate aggression in penetrating traumatic brain injury[J].Neurology, 2011,76:1038-1045. |
| [6] | Strenziok M, Krueger F, Heinecke A, Lenroot R K, Knutson K M, van der Meer E, et al. Developmental effects of aggressive behavior in male adolescents assessed with structural and functional brain imaging[J].Soc Cogn Affect Neurosci, 2011,6:2-11. |
| [7] | Denny J B. Molecular mechanisms, biological actions, and neuropharmacology of the growth-associated protein GAP-43[J]. Curr Neuropharmacol,2006,4:293-304. |
| [8] | 屈 远,雷 莉,秦光成,陈力学,胡 华.青春期病理性攻击动物模型的初步构建[J]. 中华行为医学与脑科学杂志,2011,20:630-632. |
| [9] | 雷 莉,张 艳,胡 华,秦光成,陈力学,屈 远.早年慢性应激对青春期大鼠攻击行为及下丘脑腹内侧核和前额皮质脑源性神经营养因子表达的影响[J].第三军医大学学报,2013,35:233-236. |
| [10] | Miczek K A, Fish E W,De Bold J F. Neurosteroids, GABAA receptors and escalated aggressive behavior[J]. Horm Behav, 2003,44: 242-257. |
| [11] | Haller J, Mikics E, Halász J, Tóth M. Mechanisms differentiating normal from abnormal aggression: glucocorticoids and serotonin[J]. Eur J Pharmacol,2005, 526(1-3): 89-100. |
| [12] | Koolhaas J M. Hypothalamically induced intraspecific aggressive behaviour in the rat[J]. Exp Brain Res,1978,32: 365-375. |
| [13] | Andersen M L, Bignotto M, Machado R B, Tufik S. Different stress modalities result in distinct steroid hormone responses by male rats[J]. Braz J Med Biol Res,2004,37:791-797. |
| [14] | 贾建新.睾酮对Aβ1-42寡聚体联合去势诱导的空间学习记忆损害的保护作用及其相关机制的研究[D].石家庄:河北医科大学,2013. |
| [15] | Haug M, Spetz J F, Ouss-Schlegel M L, Benton D, Brain P F.Effects of gender, gonadectomy and social status on attack directed towards female intruders by resident mice[J]. Physiol Behav,1986, 37:533-537. |
| [16] | Pope H G Jr, Kouri E M, Hudson J I. Effects of supraphysiologic doses of testosterone on mood and aggression in normal men: a randomized controlled trial[J]. Arch Gen Psychiatry, 2000,57:133-140. |
| [17] | Farrell S F,McGinnis M Y. Long-term effects of pubertal anabolic-androgenic steroid exposure on reproductive and aggressive behaviors in male rats[J].Horm Behav,2004,46:193-203. |
| [18] | Lürzel S, Kaiser S, Krüger C, Sachser N. Inhibiting influence of testosterone on stress responsiveness during adolescence[J]. Horm Behav,2011,60:691-698. |
| [19] | Smith S M, Vale W W. The role of the hypothalamic-pituitary-adrenal axis in neuroendocrine responses to stress[J]. Dialogues Clin Neurosci, 2006, 8: 383-395. |
| [20] | Kim J J, Haller J. Glucocorticoid hyper- and hypo- function: stress effects on cognition and aggression[J]. Ann NY Acad Sci, 2007,1113: 291-303. |
| [21] | Siever L J. Neurobiology of aggression and violence [J]. Am J Psychiatry, 2008,165:429-442. |
| [22] | Davidson R J, Putnam K M, Larson C L.Dysfunction in the neural circuitry of emotion regulation--a possible prelude to violence[J]. Science,2000,289:591-594. |
| [23] | 雷 莉. 早年慢性应激后大鼠攻击行为及攻击相关脑区损伤[D].重庆:重庆医科大学,2013. |
| [24] | McEwen B S, Morrison J H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course[J]. Neuron,2013,79:16-29. |
| [25] | Biaek M, Zaremba P, Borowicz K K, Czuczwar S J. Neuroprotective role of testosterone in the nervous system[J]. Pol J Pharmacol,2004,56: 509-518. |
 2015, Vol. 36
2015, Vol. 36


