瓣膜间质细胞(valve interstitial cells,VICs)是瓣膜组织最主要的细胞成分,其生物学行为改变是导致瓣膜纤维化、钙化的细胞学基础[1, 2]。过氧化氢(hydrogen peroxide,H2O2)是产生氧化应激的主要诱导剂,Miller等[3]发现纤维化及钙化的主动脉瓣组织中H2O2含量较正常瓣膜组织明显升高,提示H2O2介导的氧化应激在瓣膜纤维化、钙化进展过程中可能发挥着重要作用。
细胞模型是研究单一因素调控机制的重要方式,本研究以人VICs为模型细胞,通过给予不同浓度H2O2处理,建立H2O2诱导的VICs氧化应激细胞模型,为心脏瓣膜病发病机制研究提供基础。 1 材料和方法 1.1 实验材料
按照伦理学要求并遵循知情同意原则,搜集长海医院行手术切除的瓣膜标本。DMEM培养基、胎牛血清(fetal bovine serum,FBS)购自Gibco公司,30% H2O2购自Sigma公司,MTT试剂盒、二甲亚砜(DMSO)购自美国Amresco公司,Annexin Ⅴ-FITC细胞凋亡检测试剂盒为凯基生物公司产品。配制不同浓度梯度(0、50、100、300、500、800、1 000 μmol/L)的H2O2培养基封口后备用。 1.2 原代人VICs培养
修剪瓣膜组织为3 mm×3 mm大小,置于2 mg/mLⅡ型胶原酶中37℃下孵育30 min,用PBS冲洗去除内皮细胞;将瓣膜组织尽可能剪碎,再次置于2 mg/mLⅡ型胶原酶中37℃下孵育2 h,离心去上清后重悬细胞,置于37℃、5%CO2环境下孵育。 1.3 H-E染色观察VICs生长活性 细胞爬片后用不同浓度H2O2处理24 h,经固定、H-E染色、返蓝、脱水、透明、封片后,镜下观察细胞形态。 1.4 MTT法检测VICs相对存活率
将消化后的细胞种入96孔板,用不同浓度H2O2处理24 h后,每孔加入30 μL MTT试剂孵育4 h,每孔加入150 μL DMSO,振荡后静置10~15 min,1 h后于570 nm波长下测定各孔光密度值,计算细胞存活率并绘制细胞生长曲线。 1.5 Annexin Ⅴ/PI双染流式细胞术检测VICs凋亡率
将细胞加入不同浓度H2O2处理24 h后,胰酶悬起细胞,PBS洗涤后离心(2 000 r/min×5 min),弃上清,加入100 μL 结合缓冲液后,再加入5 μL Annexin Ⅴ-FITC,混匀后避光静置15 min,再加入150 μL 结合缓冲液,上机检测前加入5 μL PI试剂,检测后进行数据处理及图像制作。 1.6 统计学处理
采用 SPSS 18.0统计软件进行统计学分析,组间比较采用单因素方差分析(One-Way ANOVA),数据以 x±s表示,检验水准(α)为0.05。
2 结 果
2.1 分离培养的VICs形态学观察
刚消化分离的VICs呈散在球状,6 h后即开始贴壁生长,24 h后基本完全贴壁。初代细胞培养至第3天时,细胞多呈球状或短杆状,可见稍有伪足向外伸出(图 1A);初代细胞培养至第8天时,细胞呈星状或梭形,多量伪足明显向外延伸并且相互接触汇合,铺满培养皿底部的细胞镜下观察类似铺路石样(图 1B);传代至第2代时,细胞仍呈星状,大量伪足伸出并相互接触融合(图 1C);传代至第5代时,细胞形态与上一代基本一致(图 1D)。
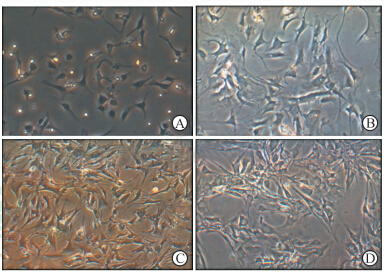 | 图 1 人瓣膜间质细胞(VICs)镜下形态 Fig 1 Morphology of human valve interstitial cells (VICs)under optical microscope A: Primary VICs cultured for 3 days; B: Primary VICs cultured for 8 days; C: The second passage cells; D:The fifth passage cells. Original magnification: ×100 |
对照组细胞伸出多量伪足,胞质丰富、染为淡红色,边界清楚,细胞核淡蓝染,核仁清晰可见(图 2A),50、100 μmol/L H2O2处理后的细胞形态与对照组基本一致; 300、500 μmol/L H2O2处理组H-E染色镜下形态与0~100 μmol/L处理组相比差异不大,仅见少量细胞变小,胞质染色稍加深(图 2B);H2O2浓度为800 μmol/L时,可见胞质浓缩、染色加深,伸出的伪足减少、变细,细胞核固缩、染为蓝黑色,核仁不可辨认,部分细胞脱落坏死(图 2C);H2O2浓度达1 000 μmol/L时,大片细胞坏死脱落,胞质进一步皱缩,伪足基本消失,部分细胞核破碎,形成凋亡小体(图 2D)。
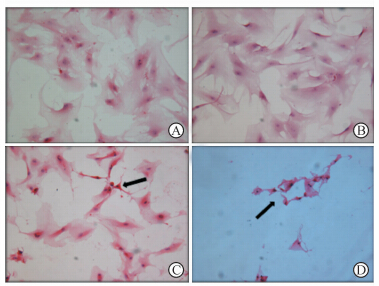 | 图 2 H2O2处理后人瓣膜间质细胞(VICs)形态 Fig 2 Morphology of human valve interstitial cells (VICs) after exposure to H2O2 A: Control group; B: 500 μmol/L H2O2 treatment group; C: 800 μmol/L H2O2 treatment group; D: 1 000 μmol/L H2O2 treatment group. Arrows indicate the apoptotic cells. H-E staining,original magnification: ×200 |
图 3为H2O2浓度与细胞存活率曲线,各组浓度H2O2对细胞存活率的影响有统计学意义(P<0.01),在50、100 μmol/L范围细胞存活率与对照组相比有所升高(P<0.05),然后开始平缓下降,H2O2浓度在800 μmol/L时,出现明显拐点,此时细胞存活率为(69.8±8.3)%(n=6);当浓度达到1 000 μmol/L时,细胞存活率迅速降为(14.3±11.0)%(n=6)。
 | 图 3 H2O2处理后人瓣膜间质细胞(VICs)存活率曲线 Fig 3 Concentration-course effect of H2O2 on survival rate of human valve interstitial cell *P<0.05,**P<0.01 vs control group. n=6,x±s |
2.4 H2O2处理对VICs凋亡的影响
图 4 为Annexin Ⅴ/PI双染流式细胞术检测VICs凋亡结果。对照组细胞凋亡率为(2.85±0.69)%,H2O2处理浓度为300 μmol/L时细胞凋亡率为(6.04±0.17)%,较对照组明显升高(P<0.01);500 μmol/L组凋亡率为(6.85±0.50)%,也较对照组明显升高(P<0.01),但与300 μmol/L组大致相当,说明在300~500 μmol/L范围H2O2诱导凋亡的作用相对温和;当H2O2浓度达800 μmol/L时细胞出现明显凋亡,总凋亡率为(22.76±0.94)%,较对照组明显升高(P<0.01),较其他处理组也明显升高(P<0.01),且以中晚期凋亡为主。
 | 图 4 流式细胞仪检测H2O2处理后的人瓣膜间质细胞(VICs)凋亡情况 Fig 4 Apoptosis of human valve interstitial cells (VICs) detected by Flow Cytometer after exposed to H2O2 **P<0.01 vs control group; △△P<0.01 vs 300 and 500 μmol/L group |
退行性钙化性心脏瓣膜病是常见的心血管疾病之一,在欧美国家其发病率仅次于高血压和冠心病[4],在我国其发病率逐年升高,已有取代风湿性心脏病成为最常见的心脏瓣膜疾病的趋势[5]。VICs是瓣膜组织的主要细胞成分,研究显示正常的VICs并不是单一的细胞种类,根据其形态和表型不同大致可以分为成纤维细胞、肌成纤维细胞和平滑肌细胞[6, 7]。在正常的瓣膜组织中,成纤维细胞所占比例约为75%,只有大约2.5%为肌成纤维细胞[8]。在功能上,成纤维细胞为静息状态细胞,激活后转化为肌成纤维细胞。肌成纤维细胞特异性表达平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),既具有收缩和迁移能力,又可以分泌多种细胞外基质蛋白,调控瓣膜自我修复,在维持瓣膜正常形态和生理功能上起重要作用;平滑肌细胞表达肌球蛋白和肌间线蛋白,具有收缩能力[9, 10]。还有研究显示,几乎所有瓣膜间质细胞均能表达脯氨酰4-羟化酶,该酶被认为是维持胶原蛋白三螺旋结构稳定所必需的[11]。在前期实验中我们采用免疫荧光和流式细胞仪鉴定VICs结果显示其α-SMA表达率为40%,波形蛋白(vimentin)表达率为96%[12],该表型结果与其生理功能相符合。VICs生物学行为改变是导致瓣膜钙化的最主要原因,早期研究显示VICs的凋亡与瓣膜钙化密切相关[2],进一步研究显示瓣膜钙化与细胞凋亡时释放的凋亡小体密切相关,凋亡小体具有促进钙盐被动性沉积于瓣膜组织的作用[13]。近年研究显示VICs向成骨细胞表型转化是导致瓣膜钙化的另一重要机制 [14, 15]。氧化应激是指体内活性氧生成清除机制失衡过度蓄积的活性氧成分导致细胞损伤及功能障碍[3]。氧化应激损伤是退行性瓣膜疾病的重要发病机制之一[16],研究显示导致氧化应激损伤的活性氧簇(reactive oxygen species,ROS)不仅能诱导VICs发生凋亡[17],还能激活VICs,活化后的VICs 具有表型转化的潜能[18]。H2O2是ROS的一种,也是体内导致氧化应激损伤的主要效应分子,Miller等[3]发现纤维化及钙化的主动脉瓣组织中H2O2含量较正常瓣膜组织明显升高,提示H2O2介导的氧化应激在退行性瓣膜病进展过程中可能发挥着重要作用。但目前国内外针对H2O2介导的氧化应激对VICs尤其是对具有人种属特性的VICs生物学行为影响在参与退行性瓣膜病发病机制中的研究结果非常有限,而体内代谢环境复杂,为阐明单一H2O2介导的氧化应激因素的具体作用机制,有必要建立H2O2诱导的人VICs氧化应激细胞模型。尤其是随着基因治疗技术的快速发展,能够尽可能模拟体内环境的体外模型在分子机制研究及靶向药物干预治疗的研究中越来越重要。本研究从细胞损伤和细胞反应两种角度探讨了H2O2对VICs的作用,试图建立具有模拟性的、可控的、特异的VICs氧化应激模型,通过观察细胞功能形态和功能改变,从而揭示可能的氧化损伤途径。
本实验采用0~1 000 μmol/L的H2O2构建VICs氧化应激模型,并以细胞凋亡作为细胞损伤评价指标,以细胞生存能力作为细胞反应能力评价指标。结果表明H2O2浓度在0~100 μmol/L时细胞存活率轻度升高,300~800 μmol/L时缓慢下降,超过800 μmol/L后快速下降。这提示低浓度H2O2(0~100 μmol/L) 具有增强细胞活性、提高细胞生存能力的作用,中等浓度H2O2(300~800 μmol/L)对细胞造成的细胞反应和损伤相对缓和,而高浓度的H2O2(>800 μmol/L)时是一个快速诱导过程,细胞损伤及反应更为强烈。根据文献报道,建立氧化应激模型时,细胞存活率通常应小于70%,且大于50%[19]。若细胞存活率过低(小于50%),则表明大量细胞已死亡,造成不可逆损伤,不利于研究氧化应激对细胞生物学行为改变影响的研究;若细胞存活率过高(大于70%),对细胞损伤不够,不利于后续干预研究。按此标准本实验中当H2O2浓度达到800 μmol/L时细胞存活率降低至(69.8±8.3)%,既造成VICs氧化应激损伤,同时细胞又保持较高的存活率,是造模的理想浓度。
有文献报道,100 μmol/L H2O2处理心肌细胞2 h,细胞已出现凋亡,存活率降至50%[20]。Jiang等[21]发现500 μmol/L H2O2处理血管内皮细胞24 h细胞出现明显凋亡现象,凋亡率达55%。而本VICs模型H2O2处理浓度需达800 μmol/L时才能达到类似效果,这表明H2O2对每种细胞的作用效能不同,因而应建立细胞特异性的损伤模型。
一个良好的模型须具备特异性、模拟性和可控性,在本模型建立过程中,我们采用人主动脉瓣VICs,能充分代表人类的特异性;本模型的突出优点在于培养的VICs具有完善的代谢功能,避免了全身神经体液、激素及不同细胞的影响,模拟了单一的H2O2诱导的氧化应激过程;在观察VICs生长过程中我们发现VICs形态均一性较好,生长特性稳定,可连续传代并保持形态学稳定,并且对H2O2反应一致性较好,具有较强的可控性。本实验结果表明,当H2O2作用浓度在800 μmol/L,作用时间24 h,可成功构建以H2O2为氧化应激诱导剂的VICs细胞体外氧化应激损伤模型,而进一步研究H2O2对VICs功能影响则应选择低于800 μmol/L的亚致死浓度。该模型的建立为揭示氧化应激机制以及研究和筛选抗氧化药物奠定了实验基础。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Han L, Gotlieb A I. Fibroblast growth factor-2 promotes in vitro heart valve interstitial cell repair through the Akt1 pathway[J]. Cardiovasc Pathol, 2012,21: 382-389. |
| [2] | Hutcheson J D, Venkataraman R, Baudenbacher F J, Merryman W D. Intracellular Ca2+ accumulation is strain-dependent and correlates with apoptosis in aortic valve fibroblasts[J]. J Biomech,2012,45: 888-894. |
| [3] | Miller J D, Chu Y, Brooks R M, Richenbacher W E, Peña-Silva R, Heistad D D. Dysregulation of antioxidant mechanisms contributes to increased oxidative stress in calcific aortic valvular stenosis in humans[J].J Am Coll Cardiol,2008,52:843-850. |
| [4] | Otto C M. Calcific aortic stenosis-time to look more closely at the valve[J]. N Engl J Med, 2008,359:1395-1398. |
| [5] | 韩 林,张宝仁,徐志云,邹良建,梅 举. 老年性钙化性主动脉瓣病变的临床特点和外科治疗[J].中华心血管病杂志,2004, 32:434-435. |
| [6] | Della Rocca F, Sartore S, Guidolin D, Bertiplaglia B, Gerosa G, Casarotto D, et al.Cell composition of the human pulmonary valve: a comparative study with the aortic valve—the VESALIO project[J]. Ann Thorac Surg,2000,70: 1594-1600. |
| [7] | Messier R H Jr, Bass B L, Aly H M, Jones J L, Domkowski P W, Wallace R B, et al. Dual structural and functional phenotypes of the porcine aortic valve interstitial population: characteristics of the leaflet myofibroblast[J]. J Surg Res, 1994,57: 1-21. |
| [8] | Rabkin-Aikawa E, Farber M, Aikawa M, Schoen F J. Dynamic and reversible changes of interstitial cell phenotype during remodeling of cardiac valves[J]. J Heart Valve Dis, 2004,13: 841-847. |
| [9] | Liu A C, Joag V R, Gotlieb A I. The emerging role of valve interstitial cell phenotypes in regulating heart valve pathobiology[J]. Am J Pathol, 2007, 171: 1407-1418. |
| [10] | Taylor P M,Allen S P,Dreger S A,Yacoub M H. Human cardiac valve interstitial cells in collagen sponge: a biological three-dimensional matrix for tissue engineering[J]. J Heart Valve Dis,2002,11:298-306. |
| [11] | Taylor P M, Batten P, Brand N J, Thomas P S, Yacoub M H. The cardiac valve interstitial cell[J]. Int J Biochem Cell Biol, 2003,35:113-118. |
| [12] | Zhang M,Liu X,Zhang X,Song Z,Han L,He Y, et al. MicroRNA-30b is a multifunctional regulator of aortic valve interstitial cells[J]. J Thorac Cardiovasc Surg,2014,147:1073-1080. |
| [13] | Proudfoot D, Skepper J N, Hegyi L, Bennett M R, Shanahan C M, Weissberg P L. Apoptosis regulates human vascular calcification in vitro: evidence for initiation of vascular calcification by apoptotic bodies[J]. Circ Res,2000,87:1055-1062. |
| [14] | Tanaka K, Sata M, Fukuda D, Suematsu Y, Motomura N, Takamoto S, et al. Age-associated aortic stenosis in apolipoprotein E-deficient mice[J]. J Am Coll Cardiol,2005,46:134-141. |
| [15] | Rajamannan N M, Subramaniam M, Rickard D, Stock S R, Donovan J, Springett M, et al. Human aortic valve calcification is associated with an osteoblast phenotype[J]. Circulation,2003,107:2181-2184. |
| [16] | O'Brien K D. Pathogenesis of calcific aortic valve disease: a disease process comes of age (and a good deal more)[J]. Arterioscler Thromb Vasc Biol,2006,26: 1721-1728. |
| [17] | Li P F, Dietz R, von Harsdorf R. Differential effect of hydrogen peroxide and superoxide anion on apoptosis and proliferation of vascular smooth muscle cells[J]. Circulation, 1997,96: 3602-3609. |
| [18] | Branchetti E, Sainger R, Poggio P, Grau J B, Patterson-Fortin J, Bavaria J E, et al. Antioxidant enzymes reduce DNA damage and early activation of valvular interstitial cells in aortic valve sclerosis[J]. Arterioscler Thromb Vasc Biol,2013,33:e66-e74. |
| [19] | Zhao X C, Zhang L, Yu H X, Sun Z, Lin X F, Tan C, et al. Curcumin protects mouse neuroblastoma Neuro-2A cells against hydrogen-peroxide-induced oxidative stress[J]. Food Chem, 2011, 129: 387-394. |
| [20] | Park K J, Kim Y J, Kim J, Kim S M, Lee S Y, Bae J W,et al. Protective effects of peroxiredoxin on hydrogen peroxide induced oxidative stress and apoptosis in cardiomyocytes[J]. Korean Circ J, 2012,42: 23-32. |
| [21] | Jiang B, Liang P, Zhang B, Song J, Huang X, Xiao X. Role of PPAR-beta in hydrogen peroxide-induced apoptosis in human umbilical vein endothelial cells[J]. Atherosclerosis,2009,204: 353-358. |
 2015, Vol. 36
2015, Vol. 36


