2. 上海市中医医院药剂科, 上海 200071;
3. 上海中医药大学岳阳医院药剂科, 上海 200437
2. Department of Pharmacy, Shanghai Traditional Chinese Medicine Hospital, Shanghai 200071, China;
3. Department of Pharmacy, Yueyang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China
瘢痕皮肤局部给予糖皮质激素是临床治疗增生性瘢痕的常用非手术疗法,治疗药物常选择醋酸曲安奈德,但该药并不适合透皮给药,表面涂布乳膏剂吸收困难,目前临床不得已采用瘢痕皮内注射给药代替[1, 2]。但即使混入利多卡因(稀释剂,与醋酸曲安奈德比例为1∶1)止痛,该方法注射时依然疼痛难忍。此外尚存在瘢痕面积大需多点注射、剂量不准或不均衡易造成皮肤坏死等缺点。我们前期将美容行业已使用多年的滚轮微针引入至醋酸曲安奈德的瘢痕裸鼠模型皮肤治疗(未发表资料),其无痛、均匀、便捷的特点,有针对性地克服了瘢痕皮内注射给药存在的上述诸多缺点。为解决市售滚轮微针无法控制力度均匀性、存在给药重现性差等问题,我们又改装了市售滚轮微针,并申请了国家专利(申请号:2012121700790540),初步获得了滚轮微针改装后提高裸鼠皮肤中微针力度可控性、释药重现性等实验结果(未发表资料)。本研究拟在适合人增生性瘢痕皮肤给药微针长度优化的基础上,选择增生性瘢痕患者,进一步考察改装滚轮微针装置对醋酸曲安奈德的体内吸收促进特性,并采用经皮水分流失(transepidermal water-loss,TEWL)测量法、激光多普勒血流量法评价其对皮肤的刺激性。 1 材料和方法 1.1 仪器、材料与志愿者
滚轮微针(192针,针长500 μm,Clinical Resolution Laboratory公司,美国);SPD-10AVP高效液相色谱仪(岛津公司,日本);改良Franz扩散池(中国科学院上海有机化学研究所);TEWL测量仪(Delfin公司,芬兰);激光多普勒血流仪Powerlab/8sp(AD Instruments公司,澳大利亚);TGL-18B离心机(安亭科学仪器厂,上海);超声破碎仪(新芝公司,宁波);Leica CM1900切片机(Leica公司,德国)。曲安奈德、醋酸曲安奈德对照品(批号分别为100055-200302、100125-201105,中国食品药品检定研究院,北京);醋酸曲安奈德乳膏、醋酸曲安奈德注射液(规格分别为0.1%、50 mg/5 mL,生产批号分别为120602、130106,上海通用药业公司);甲醇、乙酸乙酯为色谱纯,正己烷等其他试剂均为分析纯。人增生性瘢痕皮肤来源于上海市第七人民医院烧伤科手术切除的烧伤后增生期瘢痕皮肤,病理切片证实符合增生性瘢痕形态学特点。增生活跃的增生性瘢痕成年患者12例(7男,5女),平均年龄30.8(25~35)岁,烧伤治疗后半年内,瘢痕创面无破溃,面积较大,且术前3个月内未应用止痒药物。本研究经上海市第七人民医院医学伦理委员会审核批准,所有患者均知情同意。 1.2 滚轮微针的改装
在市售的微针滚轮(图 1A)外侧增加一个保护罩,该保护罩安装于滚轮轴上,底面开有一缺口,滚轮上的微针恰好通过该缺口露出(图 1B~1D),该保护罩不影响滚轮的转动。
 | 图 1 市售滚轮微针及改装滚轮微针图 Fig 1 Commercially available and modified microneedle roller A: Commercially available microneedle roller;B-D: Reverse side,side face,front side of the modified microneedle roller |
精密称取曲安奈德对照品25.0 mg,置50 mL容量瓶中,流动相溶解并稀释至刻度,摇匀,制备成质量浓度为500 μg/mL的储备液,置4℃冰箱保存备用。另精密称取醋酸曲安奈德对照品24.9 mg,置50 mL容量瓶中,流动相溶解并稀释至刻度,摇匀,制备成浓度为498 μg/mL的储备液,置4℃冰箱保存备用。 1.3.2 皮肤样品预处理
取人瘢痕皮肤匀浆200 μL,置于10 mL离心管中,加入200 μL 70%甲醇,混匀,加入乙酸乙酯-正己烷(4∶1) 2.0 mL,涡漩2 min,静置10 min,302×g离心10 min,吸取上层有机相于10 mL离心管。在原离心管中再加入乙酸乙酯-正己烷(4∶1) 2.0 mL,进行二次萃取。将两次萃取液合并,40℃水浴,氮气流下挥干,200 μL流动相复溶,11 000×g离心10 min,过滤,取上清液备用。 1.3.3 色谱条件及系统适应性实验
色谱柱:Diamonsil C18色谱柱( 4.6 mm × 250 mm,5 μm) ,流动相:甲醇-水(75∶25,V/V),柱温25℃,流速1.0 mL/min,检测波长240 nm,进样量20 μL。上述条件下空白瘢痕皮肤样液、10.00 μg/mL曲安奈德对照品样液、4.98 μg/mL醋酸曲安奈德对照品样液、瘢痕样品样液色谱图(图 2)可见,瘢痕皮组织匀浆液中 曲安奈德约5.5 min出峰,醋酸曲安奈德约8.5 min 出峰,与杂质峰分离较好,且空白皮肤样液对药物含量测定无影响。
 | 图 2 醋酸曲安奈德高效液相色谱(HPLC)图 Fig 2 High performance liquid chromatography (HPLC) chromatograms of triamcinolone acetonide A: Blank sample of human hyperplastic scar skin; B: Standard triamcinolone (10.00 μg/mL); C: Standard triamcinolone acetonide (4.98 μg/mL); D: Sample of human hyperplastic scar skin. 1: Triamcinolone; 2: Triamcinolone acetonide |
乳膏剂提取液标准曲线:将醋酸曲安奈德储备液用含20%乙醇生理盐水的空白乳膏提取液稀释,得0.1、0.5、1.0、5.0、10.0 μg /mL 的系列对照品溶液。按1.3.3项下色谱条件测定,以峰面积(A)对醋酸曲安奈德浓度(C)进行线性回归,得出醋酸曲安奈德标准曲线方程:A=44 713C-71.065(n=5),r=0.999 9,即在0.1~10.0 μg/mL范围内,峰面积与浓度有良好的线性关系。高、中、低浓度溶液(10.0、1.0、0.2 μg/mL)的日内RSD分别为1.17%、1.23%、1.50%,日间RSD分别为1.84%、2.55%、2.09%。加样回收率为(101.07±1.85)%。
皮肤匀浆液标准曲线:高温灭酶(60℃烘箱干燥15 min)后空白皮肤匀浆液代替空白乳膏提取液,测定曲安奈德和醋酸曲安奈德的皮肤匀浆标准曲线,得曲安奈德标准曲线方程:A=38 763C+29 712(n=7),r=0.998 7,线性范围:1~100 μg/mL。高、中、低浓度溶液(100.0、10.0、2.0 μg/mL)的日内RSD分别为2.09%、5.75%、2.34%,日间RSD分别为5.17%、7.64%、4.67%。加样回收率为(79.13±4.60)%;醋酸曲安奈德皮肤匀浆标准曲线为:A=38 381C+28 869(n=7),r=0.999 8,线性范围:0.996~249 μg/mL。高、中、低浓度溶液的日内RSD分别为3.02%、2.35%、3.51%,日间RSD分别为4.28%、5.29%、4.15%。加样回收率为(75.28±5.06)%。最低检测限为0.1 μg/mL。 1.4 滚轮微针长度实验 1.4.1 微针微孔分布
将人增生性瘢痕皮肤3块平铺,用大头针固定,保持自然张力,分别用250、500、1 000 μm滚轮微针以力度5.0 N(500 g,电子天平控制)垂直交叉滚动2遍,亚甲蓝染色,5 min后自来水冲洗,纱布擦去瘢痕皮肤表面残余染料,照相,计数单位面积内微孔。 1.4.2 H-E染色切片的微针微孔观察
将250、500、1 000 μm滚轮微针处理的瘢痕皮肤切成1 cm×1 cm大小,放入4%的多聚甲醛固定12 h,依次经过脱水、透明、浸蜡、包埋处理,切成厚5 μm的组织切片,H-E染色,封片后显微镜下观察各组微孔,随机测量每组16个微孔的长度和直径。 1.5 瘢痕皮肤在体吸收试验 1.5.1 进入皮肤总药量
人增生性瘢痕皮肤需手术切除患者6例,分成手术切除前1 h给药组和12 h给药组,每组患者3例。瘢痕皮肤消毒后划分出3个1 cm2区域,每个区域间隔5 cm,分别给予300 μg/cm2醋酸曲安奈德,即皮内注射30 μL,或针长500 μm微针垂直交叉滚动2遍后涂布乳膏0.3 g,或直接涂布乳膏0.3 g。给药1 h或12 h后立即手术切除瘢痕皮肤。采用洗脱法,用蘸有药用乙醇的棉花球轻轻擦去给药部位多余药液或乳膏,收集上述棉花球,用含20%乙醇的生理盐水冲洗和提取,HPLC法测定醋酸曲安奈德含量。将给予的注射液或乳膏药量300 μg减去上述所测药量,即得进入皮肤总药量。 1.5.2 皮肤滞留药量
采用匀浆法,将1.5.1项下实验中擦拭干净的皮肤高温灭酶(60℃烘箱干燥15 min)后精密称量,剪成碎片,加4倍量的生理盐水,匀浆,制成20%的组织匀浆,按1.3.2项下方法预处理后按1.3.3项下条件测定给药1 h或12 h的皮肤滞留药量。 1.5.3 吸收均匀性试验
人增生性瘢痕皮肤需手术切除患者3例,瘢痕皮肤消毒后标记出2个1 cm2区域,两区域间隔5 cm,分别采用皮内注射或滚轮微针处理后涂布的方法给予300 μg/cm2醋酸曲安奈德。给药12 h后立即手术切除瘢痕皮肤。用蘸有药用乙醇的棉花球轻轻擦去皮肤表面多余药液或乳膏,每隔100 μm冰冻切片,高温灭酶后进行匀浆,按照1.3.2项下方法预处理后按1.3.3项下条件测定皮肤滞留药量。 1.6 皮肤刺激性试验 1.6.1 TEWL测量法
人增生性瘢痕患者3例,瘢痕皮肤消毒后标记出3个1 cm2区域,每个区域间隔5 cm,25℃、相对湿度60%,清醒安静状态稳定30 min,以未进行处理的瘢痕皮肤为对照,分别采用不加药物的皮内注射、针长500 μm滚轮微针处理,于0、15、30、45、60、120、240 min时将探头轻轻按压于所标记区域,记录数据。 1.6.2 激光多普勒血流量法
人增生性瘢痕患者3例,25℃、相对湿度60%,清醒安静状态稳定30 min。瘢痕皮肤消毒后标记出4个1 cm2区域,标记区域避开大血管,每个区域间隔5 cm,以未进行处理的瘢痕皮肤为对照,分别采用皮内注射、滚轮微针处理后涂布乳膏、直接涂布乳膏等给药方法,于处理前、处理后2 h内每隔10 min测定1次皮肤血流量。处理前数值为基础血流值,血流量以血流灌注单位(blood perfusion units,BPU)为单位。 1.7 统计学处理
采用t检验进行统计分析,检验水准(α)为0.05。 2 结 果 2.1 适合人增生性瘢痕皮肤给药的微针长度考察
不 同针长微针刺入人增生性瘢痕皮肤的结果见图 3A~3C。250 μm针长微针处理的皮肤微孔清晰度相对较差,分布不均匀且大部分微孔未着色(图 3A);500 μm针长微针处理的皮肤微孔清晰度尚可,分布均匀但染色深浅有一定差别,少部分微孔并未完全着色(图 3B);1 000 μm针长的滚轮微针处理后,皮肤微孔相对清晰,排列规则且分布均匀(图 3C)。
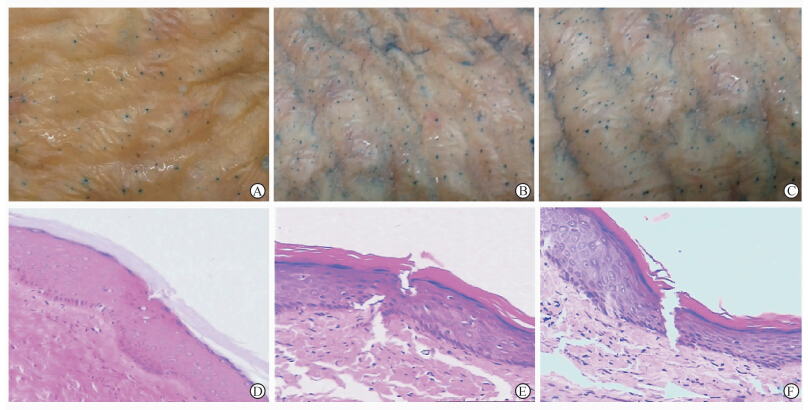 | 图 3 不同针长微针刺入人增生性瘢痕皮肤的形态 Fig 3 Morphology of human hyperplastic scar skin after insertion by microneedles of different lengths A-C: Photographs of human hyperplastic scar skin after the insertion of one microneedle as visualized by methylene blue staining (A: 250 μm; B: 500 μm; C: 1 000 μm); D-F: Microscopic images by H-E staining (D: 250 μm; E: 500 μm; F: 1 000 μm). Original magnification:× 200 |
图 3D~3F为采用H-E染色后瘢痕皮肤纵切面结果,250 μm针长微针并未完全穿透角质层(图 3D);500 μm针长微针穿透角质层,部分已刺入表皮层(图 3E);而1 000 μm针长微针甚至部分已刺入真皮浅层(图 3F)。
由表 1可见,随着针长的增加,微针刺入皮肤形成的微孔深度相应增加,但刺入皮肤的深度仅为针长的14.8%~17.8%。随着针长的增加,微孔直径、微孔数量亦相应增加,但1 000 μm针长微针刺入皮肤后形成的微孔数量与500 μm针长微针相比差异无统计学意义(P>0.05)。
|
|
表 1 不同针长微针刺入人增生性瘢痕皮肤的微孔深度、直径和数量 Tab 1 Depth,diameter,and number of micropores in human hyperplastic scar skin after insertion of microneedles of different lengths |
由图 4A可见,给药1 h,直接涂布乳膏有8.00%醋酸曲安奈德吸收进入皮肤,为(21.89±2.33) μg/cm2,而微针处理后涂布乳膏则有27.42%即(74.98±12.94) μg/cm2的药物进入皮肤,微针给药1 h后的促透作用为3.43倍。给药12 h,直接涂布乳膏组进入皮肤的药物为(66.01±13.69) μg/cm2,仅为总给药量的24.14%,而微针处理后涂布乳膏则有60.64%的药物进入皮肤,为(165.85±57.51) μg/cm2,微针给药12 h后的促透作用为2.51倍。
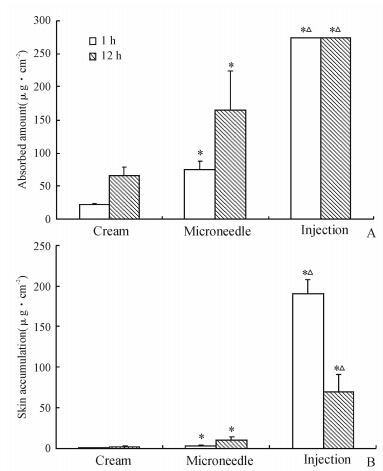 | 图 4 不同给药方法对增生性瘢痕患者皮肤内醋酸曲安奈德吸收的影响 Fig 4 Influence of different drug delivery routes on triamcinolone acetonide absorption in human hyperplastic scar skin A: Skin absorption of triamcinolone acetonide; B: Skin accumulation of triamcinolone acetonide. *P<0.05 vs cream group;△P<0.05 vs microneedle group. n=6,x±s |
由图 4B可见,在3种给药方法中,给药1 h皮内注射给药后皮肤中曲安奈德的滞留量最高,达到(190.47±17.73) μg/cm2;直接涂布乳膏相对最低,仅为(0.70±0.21) μg/cm2;微针处理后,皮肤中滞留药量提高到5.46倍,达到(3.82±0.66) μg/cm2(P<0.05)。给药12 h,皮肤中滞留药量明显发生变化,其中皮内注射后下降至给药1 h的45.98%;而微针处理和直接涂布乳膏均有明显上升,直接涂布乳膏上升到4.18倍,为(2.93±0.80) μg/cm2,微针处理后则上升至2.73倍,达到(10.44±3.62) μg/cm2,12 h时微针对皮肤中滞留药量的促透作用为3.56倍,差异有统计学意义(P<0.05)。
将1 cm×1 cm面积的瘢痕皮肤每100 μm予以均匀切片,共获得10张切片,测定发现皮内注射后皮肤中滞留药量紧紧围绕注射点,呈现正态分布且迅速降低,分布相对不均匀,药物滞留量均值为(4.83±5.51) μg,最高(16.12±3.53) μg,最低(0.32±0.09) μg,其中药物滞留量10 μg以上切片3张、1~10 μg 3张、1 μg以下4张。给药12 h,微针组皮肤内药物滞留量均值为(0.93±0.14) μg,最高(1.18±0.44) μg,最低(0.74±0.19) μg。详见图 5。
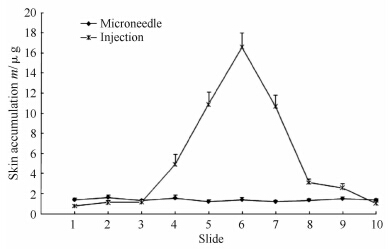 | 图 5 不同给药方法对增生性瘢痕皮肤内曲安奈德吸收均匀性的影响 Fig 5 Effect of different drug delivery routes on absorption homogeneity of triamcinolone acetonide in human hyperplastic scar skin n=3,x±s |
由图 6可见,皮内注射、针长500 μm微针处理瘢痕皮肤后,皮肤TEWL均在瞬间达到最高值,分别为未予以任何处理的瘢痕皮肤的1.72倍和1.31倍,差异有统计学意义(P<0.05),且皮内注射组的TEWL高于微针处理组,差异有统计学意义(P<0.05)。但是,皮内注射30 min后TEWL下降至基线水平;而微针处理组则相对缓慢,45 min后才缓慢下降至基线水平,两者的曲线下面积(AUC)分别为25.80和29.48,差异无统计学意义(P>0.05)。
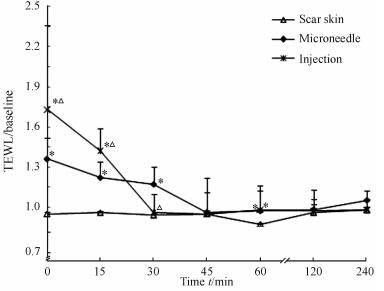 | 图 6 不同给药方法对增生性瘢痕皮肤TEWL的影响 Fig 6 Effect of different drug delivery routes on transepidermal water-loss of human hyperplastic scar skin TEWL: Transepidermal water-loss measurement. *P<0.05 vs scar skin group; △P<0.05 vs microneedle group. n=3,x±s |
不同给药方法对增生性瘢痕患者皮肤血流的影响结果见图 7。图 7显示,直接涂布乳膏2 h内,血流与处理前无明显变化。皮内注射和微针处理后涂布乳膏皮肤局部血流均明显增加,差异有统计学意义(P<0.05),且注射组增加更多。微针处理后血流即达最大值(24.77±3.13)BPU,20 min后恢复至基线水平,其AUC为282.15 BPU·min;皮内注射处理后20 min达到最大值(44.98±2.44)BPU,随后逐渐降低,至90 min恢复至基线水平,其AUC为2 368.97 BPU·min,显示皮内注射的皮肤刺激性是微针给药的8.40倍。
 | 图 7 不同给药方法对增生性瘢痕皮肤血流的影响 Fig 7 Effect of different drug delivery routes on blood flow in human hyperplastic scar skin BPU: Blood perfusion unit. *P<0.05 vs control; △P<0.05 vs microneedle group. n=3,x±s |
本实验采用HPLC法测定了乳膏剂、皮肤匀浆液、体外Franz扩散接受液(该数据本文未报道,离体皮肤1 h内新鲜获取制备)中醋酸曲安奈德含量,发现乳膏剂中均为醋酸曲安奈德;体外皮肤匀浆液中既含有醋酸曲安奈德,亦含有曲安奈德;体内皮肤匀浆液、体外Franz扩散接受液则仅含有曲安奈德。这是因为醋酸曲安奈德结构为醋酸酯;皮肤作为人体的代谢屏障之一,含有相当数量的醋酸酯酶,能将醋酸曲安奈德部分或全部酶解成曲安奈德。为确保有效定量,本实验尝试采用冰浴离体皮肤以灭活皮肤中醋酸酯酶,但仍然出现双峰。采用60℃烘箱干燥15 min,发现成功灭活皮肤中醋酸酯酶,仅出现醋酸曲安奈德峰。干燥时间若超过15 min,皮肤过干、过脆,将影响实验的顺利开展。
人增生性瘢痕皮肤结构与正常皮肤差异较大,为此本实验开展了适合人增生性瘢痕皮肤给药的微针长度优化实验。由于瘢痕皮肤结构因年龄大小、个体差异、烧伤面积大小、创面部位、创面深浅不同而异,难以实现真正一致,本实验尽量选择年龄相仿、烧伤部位类似的增生性瘢痕患者作为研究对象。我们预实验时采用HPLC法测定了增生性瘢痕患者皮内注射、滚轮微针处理后涂布乳膏、直接涂布乳膏等3个区域相互间隔5 cm处皮肤的药物含量,并未检测到曲安奈德或醋酸曲安奈德,表明3种给药方式均为局部给药,药物并未对同体其他给药部位产生干扰,因此本研究仍采用患者自身同体对照开展试验。
醋酸曲安奈德难溶于水,其市售注射剂为混悬液,我们推测其理化性质一定程度干扰了人增生性瘢痕皮肤药物在体吸收试验的准确性。但是,实验结果仍然出现了皮内注射12 h后皮肤滞留药量下降明显、微针处理12 h后皮肤滞留药量明显增加等皮肤吸收规律。给药1 h和给药12 h,滚轮微针处理和直接涂布乳膏的皮肤滞留药量均分别较同期的皮肤吸收药量明显下降,这是因为吸收进入皮肤的药物被活性表皮和真皮层中大量毛细血管所转运,而并非仅仅滞留在皮肤中。药物分布均匀性试验充分说明滚轮微针给药后药物分布相对均匀。
经皮水分流失TEWL测量法、激光多普勒血流量法是国外多角度评价皮肤刺激性的经典方法,但国内尚未见相关报道。图 6发现TEWL值低于基线现象,可能是因为人体正常代谢活动影响皮肤表面水分蒸发,不同时间人体的TEWL值均有波动,符合类似文献报道[3]。本研究测得皮内注射后30 min和微针处理后45 min内便恢复至基线,这可能与为排除注射液和乳膏对TEWL值测定的干扰而未加药物有关。Banks等[4]发现,载有纳曲醇的微针处理72 h,TEWL值才恢复至基线,而未装载药物的微针处理30 min即已恢复至基线,说明TEWL值变化可能与给药与否相关。此外,Bal等[5] 发现,200、300 μm金属微针处理后45 min时TEWL值已恢复至基线,而400 μm微针则为60 min,说明TEWL恢复与针长有关。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | McCollum P T,Bush J A,James G,Mason T,O'Kane S,McCollum C,et al.Randomized phase Ⅱ clinical trial of avotermin versus placebo for scar improvement [J].Br J Surg,2011,98:925-934. |
| [2] | Finken M J,Mul D.Cushing's syndrome and adrenal insufficiency after intradermal triamcinolone acetonide for keloid scars[J].Eur J Pediatr,2010,169:1147-1149. |
| [3] | Kalluri H,Kolli C S,Banga A K.Characterization of microchannels created by metal microneedles:formation and closure[J].AAPS J,2011,13:473-481. |
| [4] | Banks S L,Pinninti R R,Gill H S,Paudel K S,Crooks P A,Brogden N K,et al.Transdermal delivery of naltrexol and skin permeability lifetime after microneedle treatment in hairless guinea pigs[J].J Pharm Sci,2010,99:3072-3080. |
| [5] | Bal S M,Caussin J,Pavel S,Bouwstra J A.In vivo assessment of safety of microneedle arrays in human skin[J].Eur J Pharm Sci,2008,35:193-202. |
 2015, Vol. 36
2015, Vol. 36


