2. 第二军医大学药学院海洋药物研究中心, 上海 200433
2. Research Center for Marine Drugs, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
海洋无脊椎动物的共附生微生物是海洋生物生态体系的组成部分,其次生代谢产物结构多样、活性丰富,受到天然产物化学家的重视。对共附生微生物的次生代谢产物的研究不仅能获得药源性活性物质,还可考察共附生微生物与宿主之间的生态关系,探讨其在海洋化学防御中可能扮演的角色。
海参是棘皮动物门海参纲动物的总称,全世界约有1 000多种,在我国分布有140多种,主要营海洋底栖生活[1]。有人从日本海海参表皮真菌Acremonium striatisporum中分离得到具有中等细胞毒活性的二萜皂苷[2,3,4],从青岛海域海参Stichopus japonicus共附生真菌Aspergillus fumigatus中分离得到19个吲哚二酮哌嗪类生物碱[5]以及pseurotin A 和它的2个非对映异构体pseurotin A1和A2[6]。
黑乳海参(Holothuria nobilis Selenka)在我国东海、南海海域均有分布[1]。前期已对黑乳海参体内的海参皂苷类成分及其生物活性进行了系统研究[8,9,10]。本课题组已从黑乳海参的一株共附生真菌Dendrodochium sp.中分离得到13个十二元环内酯化合物,其中包含4对手性异构体[7]。本研究运用正、反相硅胶柱色谱、凝胶柱色谱以及高效液相色谱(HPLC)等分离纯化技术,对分离自黑乳海参的共附生真菌Phialemonium sp.的次生代谢产物进行研究,结果分离纯化得到2个缩酚酸环醚类化合物,并运用现代波谱技术结合文献报道进行了结构鉴定。 1 材料和方法 1.1 样品
实验所用菌株由德国布伦瑞克理工大学(Technische Universit Braunschweig)微生物研究所Barbara Schulz教授从中国南海黑乳海参中分离得到,并鉴定为Phialemonium sp.。现保存在第二军医大学药学院海洋药物研究中心,编号10082。将菌株接种到培养基上(50 g生物麦芽糖,15 g琼脂,800 mL人工海水,pH 5.6),培养箱温度26℃,固体培养28 d,共培养300块。 1.2 仪器与试剂
HZQ-F280型全温振荡培养箱;LDZH-200KBS型立式压力蒸汽灭菌器;Bruker Varian Inova-600、Avance-500核磁共振仪;Agilent 1100高效液相色谱仪配有RID检测器和Zorbax 300-C18柱(250 mm×9.4 mm,5 μm);Sephadex LH-20凝胶由Amersham Pharmacia Biotech生产;TLC薄层板和柱色谱硅胶均由烟台黄务硅胶开发实验厂提供;开放柱色谱所用溶剂为分析纯,HPLC所用试剂为色谱纯,购自国药集团上海化学试剂公司。 1.3 提取与分离
共附生真菌Phialemonium sp.菌株用含5%生物麦芽提取物的Biomalt固体琼脂培养基室温发酵28 d,培养基用乙酸乙酯提取(1.0 L×5次),合并提取液,浓缩得总浸膏4.2 g。将总浸膏进行正相硅胶柱色谱法分离,依次用石油醚/丙酮(10∶1,5∶1,4∶1,3∶1,2∶1,1∶1)和二氯甲烷/甲醇(10∶1,5∶1,2∶1,0∶1)系统作为洗脱剂进行梯度洗脱,TLC点板合并共得到Fr. A~Fr. K 16个部分。对Fr. E进行Sephadex LH-20凝胶柱(CHCl3∶MeOH = 2∶1)、ODS柱分离和半制备HPLC纯化,得到单体化合物 1 (4.3 mg)和 2 (1.7 mg)。 2 结 果 2.1 化合物 1 的结构鉴定
白色粉末,ESI-MS-显示准分子离子峰(m/z): 413 [M-H]—和415 [M+2-H]—(比例约为3∶1),提示分子中含有1个Cl原子,结合1HNMR、13CNMR和DEPT谱推测其分子式为C23H23ClO5,计算其不饱和度为12。13CNMR谱和1HNMR谱低场区110~160范围内的芳香碳信号和芳香氢信号[6.52(s,1H,H-2)],提示分子中分别存在1个五取代苯环(A)和1个六取代苯环(B)。1HNMR谱的高场区存在两组甲基氢信号[1.67(d,J = 6.6 Hz,3H,H-3’’),1.82(d,J = 6.6 Hz,3H,H-3’),1.86(s,3H,H-4’’),1.94(s,3H,H-4’)]和低场区存在的两组烯氢信号[5.46(q,J = 6.6 Hz,1H,H-2’’),5.47(q,J = 6.6 Hz,1H,H-2’)]提示分子中存在2个“1-甲基丙基-1-烯基”单元,这个结构单元进一步被COSY谱中H-2’’/H-3’’和H-2’/H-3’相关信号证实。根据13CNMR谱上烯甲基碳的化学位移[17.7(C-4’’),17.5(C-4’)],“1-甲基丙基-1-烯基”的烯键被确定为E构型。HMBC谱中,H-4’’与C-1’’、C-2’’、C-1的相关信号以及H-4’与C-1’、C-2’、C-6的相关信号,确定两个“(E)-1-甲基丙基-1-烯基”单元分别连接在A环的C-1位和B环的C-6位上。H3-4Me与C-3、C-4和C-4a,H3-9Me与C-8、C-9和C-9a,以及H-2与C-1、C-2和C-3分别确定了A、B苯环上甲基、羟基和氯原子的取代位置。13CNMR谱中的酯羰基信号(164.7,C-11)提示A、B环通过1个酯键和1个醚键环合形成C环。经与文献[11]中数据比对,鉴定化合物 1 为缩酚酸环醚化合物emeguisin A(图 1A)。化合物 1 的核磁数据见表 1。
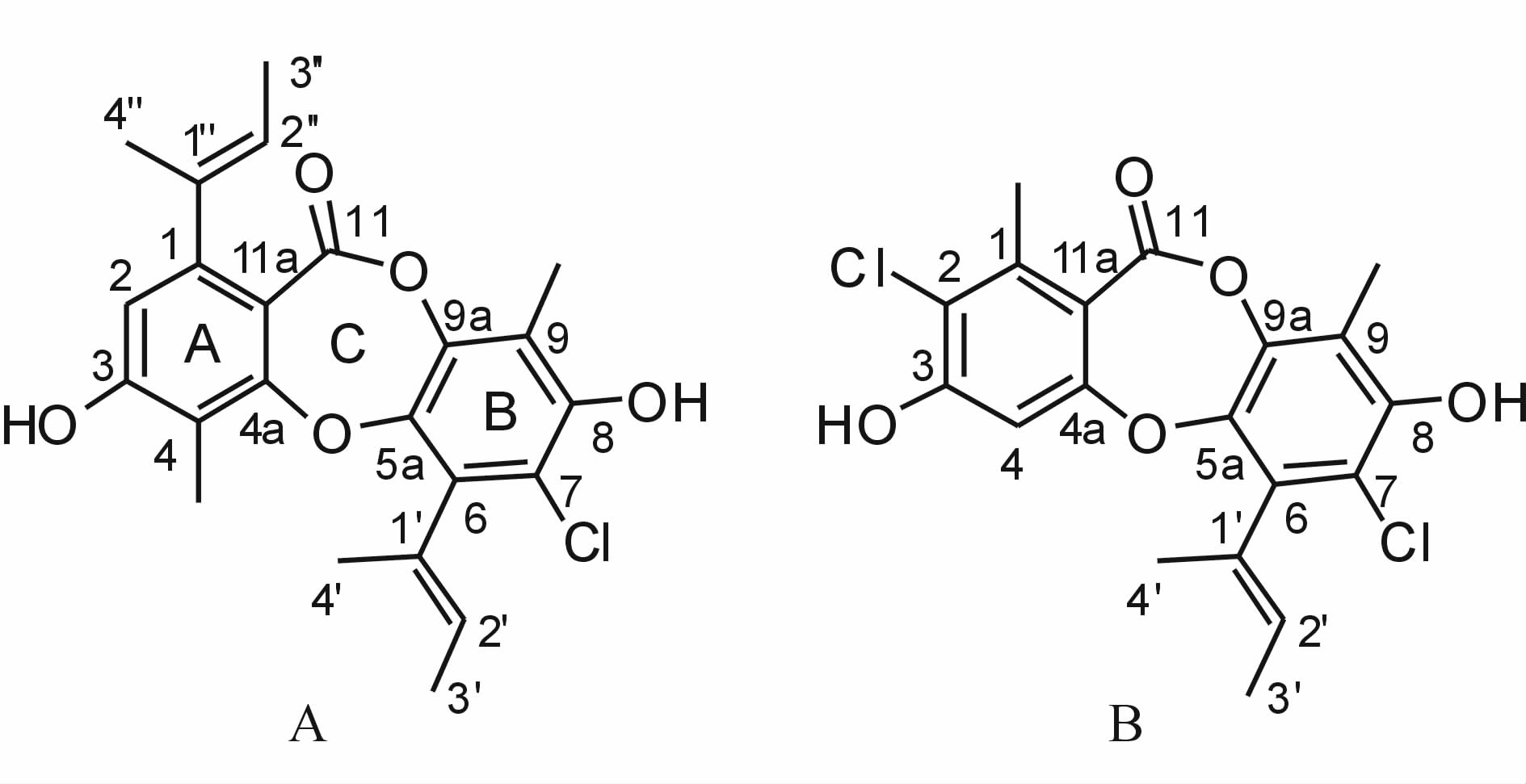
|
图 1 化合物emeguisin A (A)和aspergillusidone C(B)的化学结构式 Fig. 1 Structures of emeguisin A (A) and aspergillusidone C(B) |
| 表 1 化合物emeguisin A和aspergillusidone C的1HNMR和13CNMR数据 Tab 1 1HNMR and 13CNMR spectroscopic data of compounds emeguisin A and aspergillusidone C |
白色粉末,ESI-MS-显示准分子离子峰(m/z): 393 [M-H]—,395[M+2-H]—和 395[M+4-H]—(比例9∶6∶1),提示分子中含有2个Cl原子,结合1HNMR、13CNMR和DEPT谱推测其分子式为C19H16Cl2O5,计算其不饱和度为11。化合物2的13CNMR和1HNMR谱与化合物1相似,提示也为缩酚酸环醚类化合物。1HNMR谱的高场区的甲基氢信号[1.89(d,J = 6.8 Hz,3H,H-3’)和1.96(s,3H,H-4’)]和低场区的烯氢信号[5.42(q,J = 6.8,1H,H-2’)]提示分子中只含有1个“(E)-1-甲基丙基-1-烯基”单元,H-4’与C-1’、C-2’、C-6的HMBC远程相关信号确定“(E)-1-甲基丙基-1-烯基”连接在B环的C-6上。HMBC谱上芳氢[6.59(s,1H,H-4)]与C-3、C-4和C-4a的相关信号以及H3-1Me与C-1、C-2和C-11a,H3-9Me与C-8、C-9和C-9a的相关信号确定了A、B环上的取代基位置。经与文献[12]中数据比对,鉴定化合物 2 为aspergillusidone C(图 1B),其核磁数据见表 1。 3 讨论
本研究首次对南海黑乳海参共附生真菌Phialemonium sp.次生代谢产物进行分离鉴定,2个缩酚酸环醚化合物均为首次从该真菌中分离得到。缩酚酸环醚主要存在于低等生物地衣中[13,14],在一些植物[15]和少数真菌[16]中也有存在。缩酚酸环醚类化合物具有广泛的生物活性,如抗分枝杆菌、抗革兰阳性细菌、杀线虫、抗炎、抗肿瘤和抗病毒等[17,18]。Emeguisin A最早分离自真菌Emericella unguis Malloch & Cain,在10-3 mol/L浓度下对单胺氧化酶的抑制率为4.7%,在50 μg/板浓度下能够抑制革兰阳性菌B. Subtilis的生长[11]。Aspergillusidone C最早分离自海洋真菌Aspergillus unguis CRI282-03,具有芳香酶抑制活性和自由基清除活性[12]。黑乳海参共附生真菌Phialemonium sp.及其缩酚酸环醚类代谢产物在黑乳海参化学防御机制中的可能作用还有待进一步研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 廖玉麟.中国动物志[M].北京:科学出版社, 1997:611. |
| [2] | Afiyatullov S S, Kuznetsova T A, Isakov V V, Pivkin M V, Prokof'eva N G, Elyakov G B.New diterpenic altrosides of the fungus Acremonium striatisporum isolated from a sea cucumber[J].J Nat Prod, 2000, 63:848-850. |
| [3] | Afiyatullov S S, Kalinovsky A I, Kuznetsova T A, Isakov V V, Pivkin M V, Dmitrenok P S, et al.New diterpene glycosides of the fungus Acremonium striatisporum isolated from a sea cucumber[J].J Nat Prod, 2002, 65:641-644. |
| [4] | Afiyatullov S S, Kalinovsky A I, Kuznetsova T A, Pivkin M V, Prokof'eva N G, Dmitrenok P S, et al.New glycosides of the fungus Acremonium striatisporum isolated from a sea cucumber[J].J Nat Prod, 2004, 67:1047-1051. |
| [5] | Wang F Z, Fang Y C, Zhu T J, Zhang M, Lin A Q, Gu Q Q, et al.Seven new prenylated indole diketopiperazine alkaloids from holothurian-derived fungus Aspergillus fumigatus[J].Tetrahedron, 2008, 64:7986-7991. |
| [6] | Wang F Z, Li D H, Zhu T J, Zhang M, Gu Q Q.Pseurotin A1 and A2, two new 1-oxa-7-azaspiro[4.4]non-2-ene-4, 6-diones from the holothurian-derived fungus Aspergillus fumigatus WFZ-25[J].Can J Chem, 2011, 89:72-76. |
| [7] | Sun P, Xu D X, Mándi A, Kurtán T, Li T J, Schulz B, et al.Structure, absolute configuration, and conformational study of 12-membered macrolides from the fungus Dendrodochium sp.associated with the sea cucumber Holothuria nobilis Selenka[J].J Org Chem, 2013, 78:7030-7047. |
| [8] | Wu J, Yi Y H, Tang H F, Wu H M, Zou Z R, Lin H W.Nobilisides A-C, three new triterpene glycosides from the sea cucumber Holothuria nobilis[J].Planta Med, 2006, 72:932-935. |
| [9] | 巫 军, 易杨华, 吴厚铭, 贺全山, 邹峥嵘, 张诗龙.黑乳海参中两个新的四环三萜化合物[J].中国天然药物, 2005, 3:276-279. |
| [10] | 巫 军, 易杨华, 邹峥嵘, 吴厚铭, 汤海峰.黑乳海参中两个新的三萜皂苷[J].中草药, 2006, 37:497-500. |
| [11] | Kawahara N, Nozawa K, Nakajima S, Kawai K, Yamazaki M.Isolation and structures of novel fungal depsidones, emeguisins A, B, and C, from Emericella unguis[J].J Chem Soc Perkin Trans 1, 1988, 8:2611-2614. |
| [12] | Sureram S, Wiyakrutta S, Ngamrojanavanich N, Mahidol C, Ruchirawat S, Kittakoop P.Depsidones, aromatase inhibitors and radical scavenging agents from the marine-derived fungus Aspergillus unguis CRI282-03[J].Planta Med, 2012, 78:582-588. |
| [13] | Millot M, Tomasi S, Articus K, Rouaud I, Bernard A, Boustie J.Metabolites from the lichen Ochrolechia parella growing under two different heliotropic conditions[J].J Nat Prod, 2007, 70:316-318. |
| [14] | Rezanka T, Guschina I A.Brominated depsidones from Acarospora gobiensis, a lichen of central Asia[J].J Nat Prod, 1999, 62:1675-1677. |
| [15] | Xu Y J, Chiang P Y, Lai Y H, Vittal J J, Wu X H, Tan B K, et al.Cytotoxic prenylated depsidones from Garcinia parvifolia[J].J Nat Prod, 2000, 63:1361-1363. |
| [16] | Pittayakhajonwut P, Dramae A, Madla S, Lartpornmatulee N, Boonyuen N, Tanticharoen M.Depsidones from the endophytic fungus BCC 8616[J].J Nat Prod, 2006, 69:1361-1363. |
| [17] | Yamamoto Y, Miura Y, Kinoshita Y, Higuchi M, Yamada Y, Murakami A, et al.Screening of tissue cultures and thalli of lichens and some of their active constituents for inhibition of tumor promoter-induced Epstein-Barr virus activation[J].Chem Pharm Bull, 1995, 43:1388-1390. |
| [18] | Neamati N, Hong H X, Mazumder A, Wang S, Sunder S, Nicklaus M C, et al.Depsides and depsidones as inhibitors of HIV-1 integrase:discovery of novel inhibitors through 3D database searching[J].J Med Chem, 1997, 40:942-951. |
 2014, Vol. 35
2014, Vol. 35


