2. 第二军医大学长海医院心内科, 上海 200433;
3. 第二军医大学长征医院心内科, 上海 200003
2. Department of Cardiology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Department of Cardiology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
血管紧张素Ⅱ(AngⅡ)是高血压发病过程的核心效应分子,对心血管系统有着广泛的生物学作用,可导致血管收缩、血压上升等,同时还能诱导内皮损伤和血管重构[1]。血管紧张素Ⅱ受体1(AT1R)主要分布于血管平滑肌细胞、内皮细胞等心血管系统细胞,介导了大部分AngⅡ对心血管细胞、组织的有害作用[1,2]。同型半胱氨酸(homocysteine,Hcy)是体内蛋氨酸代谢途径中的一个中间产物。1995年的一项大规模前瞻性临床试验研究表明,Hcy代谢异常导致的高Hcy血症是动脉粥样硬化和冠心病的独立危险因子[3]。高Hcy参与了冠心病及卒中的发生发展[4,5,6]。1997年,Sutton-Tyrrell等[7]发现高Hcy是高血压患者预后的独立危险因子,该结论得到随后的多项临床实验结果[8,9,10,11,12]的支持。Lu等[13]亦在中国人群中证实了高Hcy是高血压患者预后的独立危险因子。
针对高Hcy与高血压的内在关系,近年来国际上已有部分研究。Rodrigo等[14]的研究结果提示,高Hcy可提高内皮细胞内的氧化应激、炎症因子,损伤内皮。而Tsai等[15,16]的研究则显示Hcy可促进血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖。此外,Hcy可增强VSMC内的钙离子释放,从而改变血管的收缩舒张活性[17];改变VSMC内DNA的甲基化水平[18];通过MAPK通路刺激VSMC增殖[19]等。但是,作为高血压发病环节中最重要的因素之一,AngⅡ-AT1R这一核心环节在Hcy与高血压的关系的研究中极少被关注。本研究通过观察Hcy在VSMC上对AT1R表达的影响,探讨Hcy导致VSMC功能异常的分子机制,从而为深入了解高Hcy血症与高血压的内在关系提供新的理论依据。
1 材料和方法 1.1 试剂及动物
细胞培养级Hcy(美国Sigma公司);α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体、AT1R抗体(美国Santa Cruz公司);磷酸化ERK1/2抗体、总ERK1/2抗体(美国CST公司);Alexa 488荧光标记二抗、高糖DMEM细胞培养基、胎牛血清(美国Invitrogen公司);ERK1/2化学抑制剂U0126、Bradford蛋白浓度测定试剂盒(江苏海门碧云天生物技术公司);RIPA细胞裂解液、蛋白酶抑制剂、磷酸酶抑制剂及免疫印迹ECL超敏发光液(美国Pierce公司);PVDF膜(美国 Millipore公司);四甲基乙二胺(TEMED)、二巯基乙醇(美国AMRESCO公司),其他试剂均为国产分析纯。2~3周龄雄性SD大鼠[上海中科院动物中心提供,许可证号:SCXK(沪)2003-0004,SPF级],体质量50~80 g。 1.2 原代大鼠VSMC的分离、培养及鉴定
主要采用贴块法培养。用10%的水合氯醛麻醉幼年大鼠,打开胸腔,呈俯卧位,剪开右心房,放血后从胸腔上方开始分离出胸主动脉,长约2~3 cm。在超净工作台里,用已消毒的眼科剪纵向剪开,摊平后再剪成长约3 mm的小段,并将内皮侧覆盖在培养皿底部。晾干15 min后,加入含10%胎牛血清的高糖DMEM培养液。静置于含5%二氧化碳的细胞培养箱内培养。5~7 d后,可见贴块周围有VSMCs爬出。去除贴块,胰酶消化后,按细胞密度1×105个/mL传代培养。
大鼠VSMC的鉴定采用α-SMA细胞免疫荧光染色,阳性者即为VSMC。传代时,将VSMC以较稀的密度(约3×104个/mL)铺在含有无菌盖玻片的6孔板内,加入DMEM培养基。待其生长36 h后,取出盖玻片,用4%多聚甲醛固定细胞,然后用0.1%的Triton X-100透化细胞,5%牛血清白蛋白封闭1 h后,用anti-α-SMA在室温孵育2 h,PBS洗涤3次,加入Alexa-488标记的二抗,PBS洗涤3次,中性树脂封片,随后在荧光显微镜下观察、拍片。 1.3 Hcy和U0126给药处理
将Hcy溶于PBS(pH值7.4) 制备成母液,置于-20℃保存。待大鼠平滑肌细胞生长到40%~50%融合度时,加入Hcy,使其终浓度分别为10、100和300 μmol/L。在使用信号通路化学抑制剂实验中,则在加入Hcy的同时加入U0126,终浓度为5 μmol/L。给药后继续培养48 h。 1.4 蛋白质印迹法检测AT1R蛋白表达
给药后细胞在培养箱中培养48 h后,去除培养液,用冰PBS冲洗3次。随后加入含蛋白酶抑制剂和磷酸酶抑制剂的裂解液,孵育2 min,裂解细胞,收集裂解液。在4℃下以14 000×g离心10 min,取上清,用Bradford法测定蛋白浓度。在细胞蛋白样品中加入同体积的免疫印迹上样缓冲液,煮沸15 min。自然冷却后,以14 000×g离心10 min。取含有蛋白总量约30 μg的样品,用10%浓度的聚丙烯酰胺凝胶电泳分离蛋白质。然后采用湿转法转膜,PVDF膜,恒压100 V,持续1 h。使用10%脱脂牛奶封闭2 h后,分别用兔源的AT1R多克隆抗体及鼠源的α-Tubulin单克隆抗体孵育。PBS洗脱3次后,再用辣根过氧化物酶偶联的羊抗兔、羊抗鼠的二抗分别孵育。最后用超敏ECL显色液显影。采用Image J软件进行条带光密度分析,以AT1R与α-Tubulin的比值作为AT1R蛋白表达量的相对值。 1.5 蛋白质印迹法检测磷酸化ERK1/2
基本过程同1.4项,先对磷酸化ERK1/2进行抗体孵育及显影,再用免疫印迹抗体洗脱液在摇床上洗脱掉一抗及二抗后,重新对总ERK1/2进行抗体孵育及显影。以磷酸化ERK1/2与总ERK1/2的比值作为ERK1/2信号通路激活的相对值。 1.6 统计学处理
采用SPSS 13.0软件进行统计分析。数据以 ±s 表示,组间比较用单因素方差分析。检验水准(α)为0.05。 2 结 果 2.1 原代大鼠VSMC的培养及鉴定
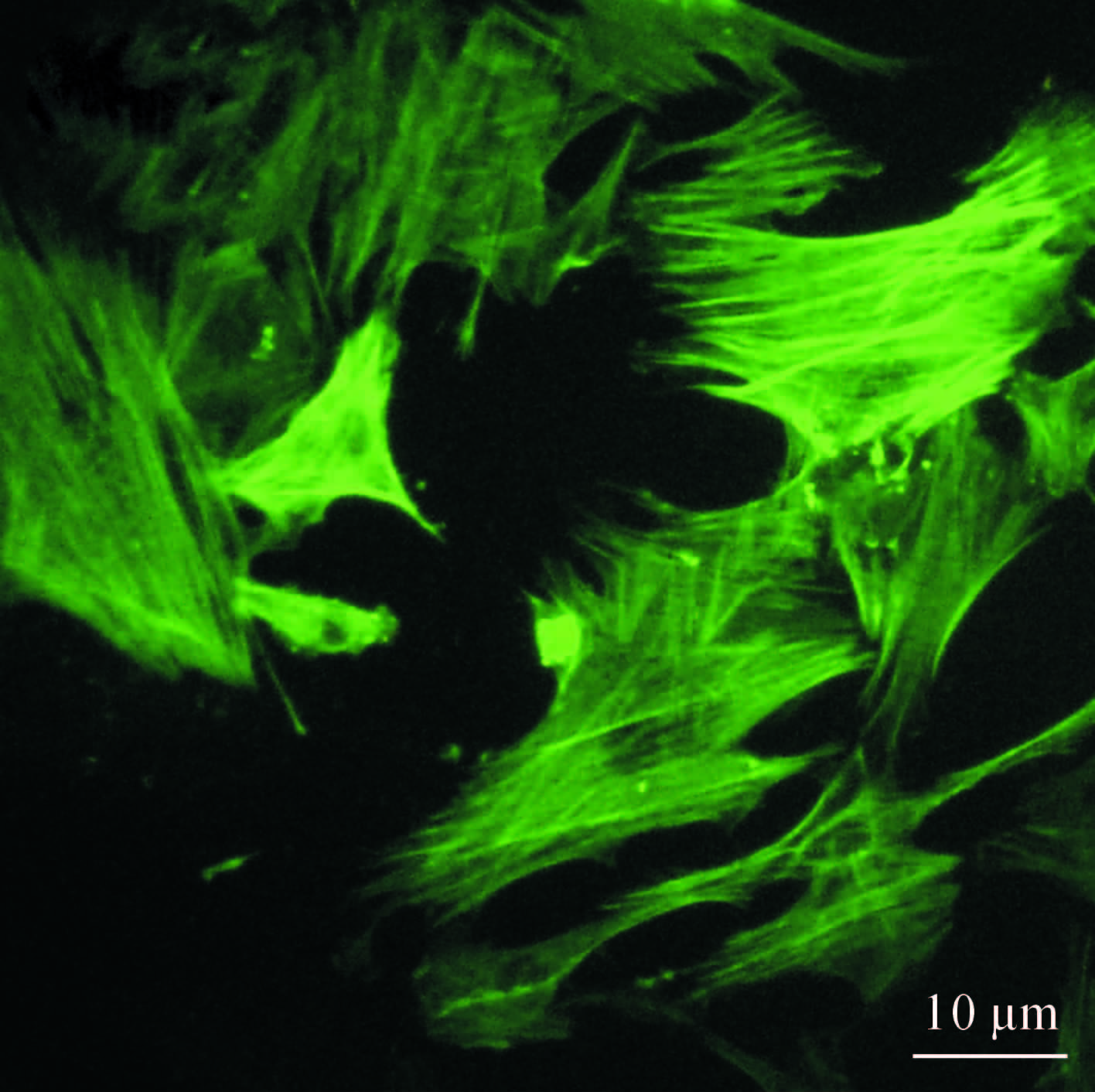
在倒置显微镜下观察,约第4~5天时见VSMC开始从组织块边缘长出。VSMC细胞呈长梭形或椭圆形,平铺状生长。当细胞传代后,生长速度较为迅速,长满瓶底后,相邻细胞可融合成片,或多层重叠生长,有谷、峰状交替。如图 1所示,对细胞爬片行α-SMA免疫荧光染色,显示95%以上为阳性细胞,在荧光显微镜下可见明显的肌丝状结构。
|
图 1 α-SMA免疫荧光染色鉴定原代大鼠VSMC Fig. 1 Identification of rat primary vascular smooth muscle cells (VSMC) by α-SMA immunofluorescence α-SMA: α-smooth muscle actin |
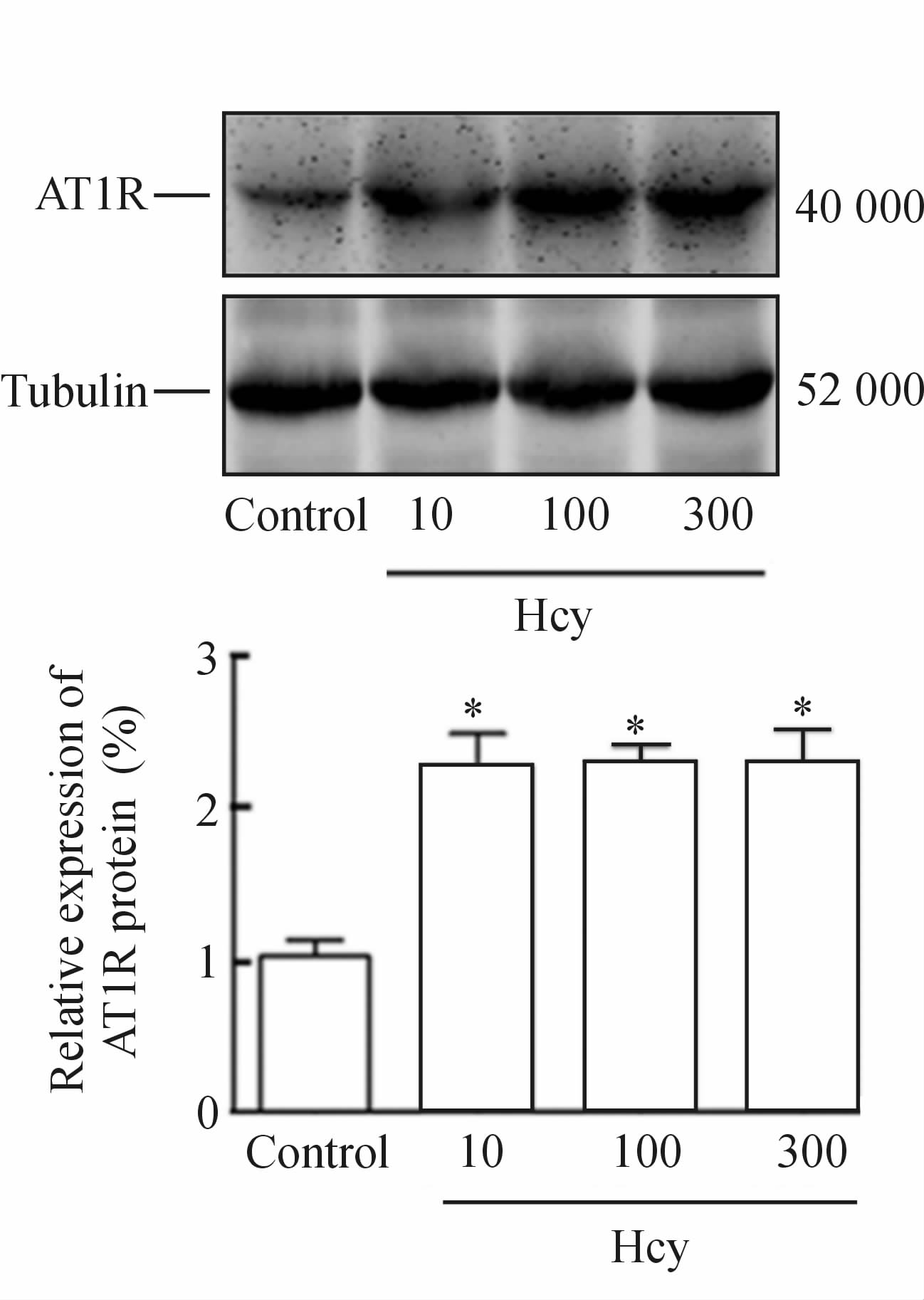
结果(图 2)显示,和溶剂对照组相比,3个不同浓度的Hcy处理VSMC后均可提高AT1R的蛋白表达量,差异有统计学意义(P<0.05)。3个不同浓度的Hcy对AT1R的蛋白表达上调幅度之间差异无统计学意义(P>0.05)。因此,在以下的分子机制实验中,我们均采用10 μmol/L作为Hcy处理VSMC的浓度。
|
图 2 3种不同浓度的Hcy在大鼠VSMC上对AT1R蛋白表达的影响 Fig. 2 Effects of three concentrations of Hcy (10,100 and 300 μmol/L) on AT1R protein expression in rat vascular smooth muscle cells(VSMC) |
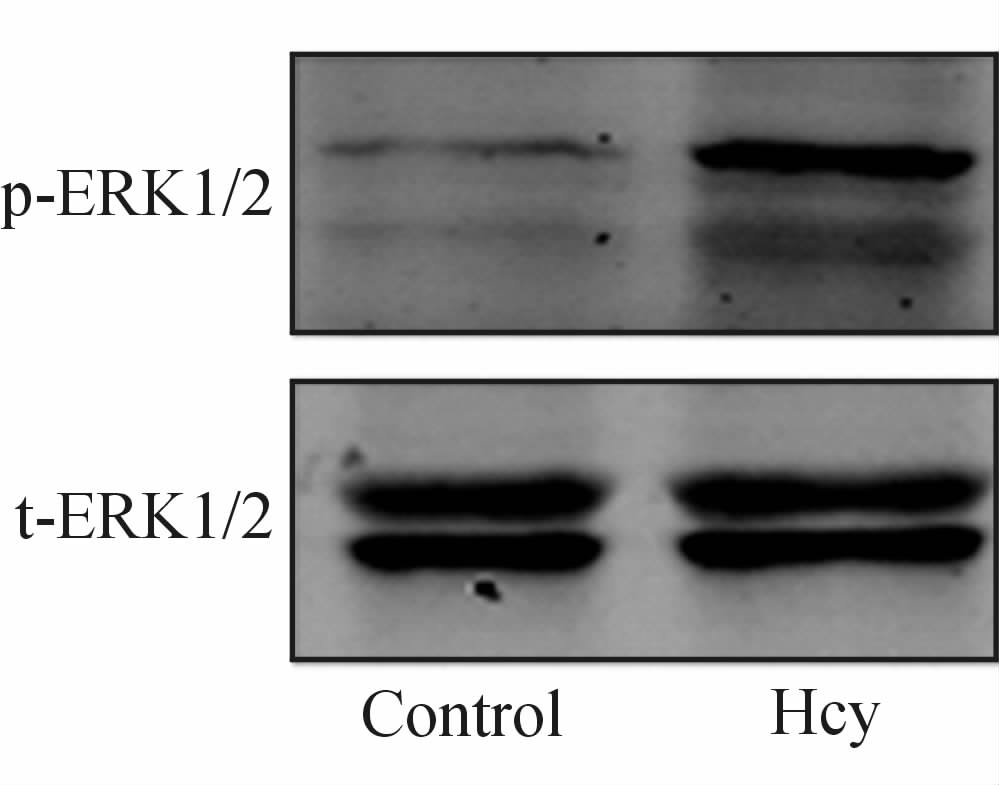
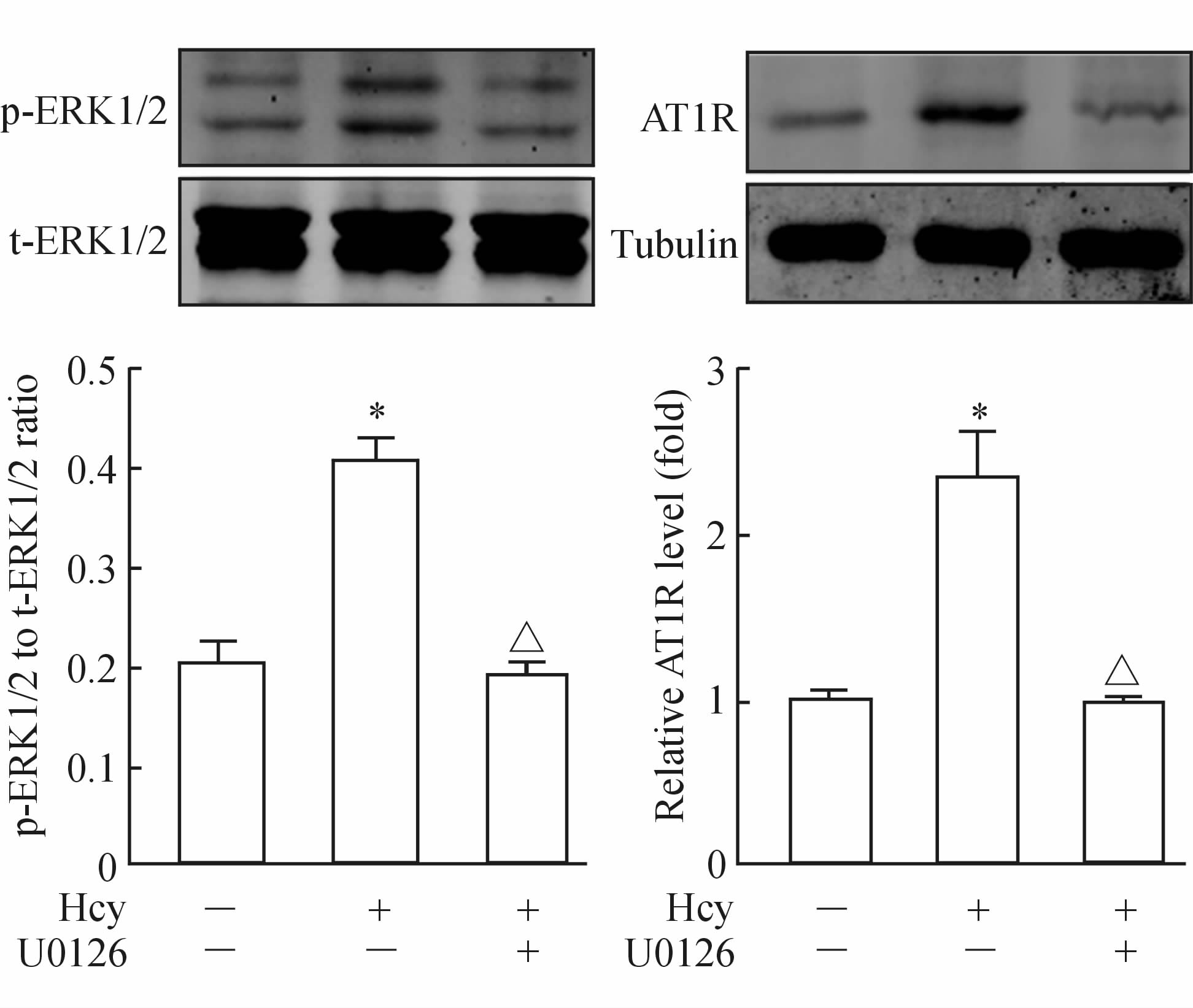
结果(图 3)显示,用10 μmol/L的Hcy处理VSMC,可升高p-ERK1/2与t-ERK1/2的比值,差异有统计学意义(P<0.05),提示Hcy在大鼠VSMC上可激活ERK1/2信号通路。 2.4 阻断ERK1/2通路的激活可取消Hcy对AT1R的上调作用 结果(图 4)显示,和空白对照组相比,实验组+不干预治疗组(Hcy单独给药组)的ERK1/2磷酸化程度增强。当用5 μmol/L的ERK1/2信号通路抑制剂U0126加入处理后,可以看到实验组+干预治疗组(Hcy+U0126组)的 ERK1/2激活作用被取消。而且,此时实验组+干预治疗组中,Hcy对AT1R的上调作用也被U0126所取消。这些结果提示ERK1/2信号通路的激活为Hcy对AT1R的上调作用所必需。
|
图 3 Hcy (10 μmol/L)在大鼠VSMC上激活ERK1/2信号通路 Fig. 3 Homocysteine (Hcy,10 μmol/L) activated ERK1/2 signaling pathway in rat vascular smooth muscle cells (VSMC) |
|
图 4 阻断ERK1/2通路的激活可取消Hcy对AT1R的上调作用 Fig. 4 U0126 blocked Hcy-induced activation of ERK1/2 signaling pathway and upregulation of AT1R in rat vascular smooth muscle cells |
| HCY: Homocysteine; AT1R: Angiotensin Ⅱ type 1. *P<0.05 vs blank control. △P<0.05 vs Hcy alone. n=6, ±s |
过度激活的肾素-血管紧张素-醛固酮系统是产生高血压的关键原因之一[20]。在正常生理状态下,AngⅡ通过激动AT1R发挥收缩血管、升高血压的作用。但是,在高血压患者体内,无论是血液中[20]还是局部组织中[21],都存在着过度升高的AngⅡ。过高的AngⅡ长期刺激AT1R,导致血压过度升高及诸多有害作用,包括血管内皮舒张功能损伤、血管中层VSMC异常增殖重构、心肌细胞肥大/失代偿等[20]。基于这些病理生理过程开发而来的AngⅡ转化酶抑制剂和AT1R拮抗剂也成为目前临床治疗高血压的最重要药物之一。在本研究中,我们发现了Hcy可以上调体外培养的VSMC上的AT1R蛋白表达量;而不同浓度Hcy组没有组间差异。根据我们的实验结果,我们推测可能Hcy在非常低剂量下就通过激活ERK1/2明显上调AT1R,此时Hcy已达到最大药理效应,即所谓的平台期,即使加入更多的Hcy也不能进一步增加AT1R的表达。这一在细胞层面上的结果对于高血压有一定的提示作用。部分高血压患者同时合并有高Hcy血症。那么,此时患者血中的高Hcy对于AT1R的上调作用可能会进一步增强AngⅡ对VSMC的损害作用。这一恶性循环的产生,对于VSMC的功能无疑是有害的。这一推论仍需在整体动物乃至临床研究中进一步验证。
ERK1/2信号通路是最早发现的丝裂原活化的蛋白激酶(MAPK)信号转导途径,主要参与各种生长因子、细胞因子、丝裂原以及激素受体活化后的信号转导。在微血管内皮细胞上,Moshal等[22]发现Hcy可激活ERK1/2来增加基质金属蛋白酶-9的表达。此外,Luo等[23]在小鼠上发现Hcy可通过激活ERK1/2来促进VSMC的增殖和迁移。在该过程中,伴有明显的氧化应激水平(超氧阴离子及丙二醛)的增加[23]。罗格列酮则通过抑制ERK1/2信号通路的激活来减弱NF-κB及肿瘤坏死因子TNF-α导致的细胞损伤[24]。而在PC12神经元细胞株上,Hcy也可以通过激活ERK1/2导致明显的神经毒性[25]。在本研究中,我们发现了Hcy在VSMC上确实可以激活ERK1/2信号通路的磷酸化,这一结果与文献报道[22,23]一致。而当我们用U0126阻断了ERK1/2的激活后,Hcy上调AT1R的作用亦被取消。这一结果说明,Hcy是通过激活ERK1/2信号通路来促进AT1R的蛋白表达的。
AT1R不仅参与高血压的发病过程,还在动脉粥样硬化、血管硬化、心肌细胞功能损伤等诸多心血管疾病中扮演重要角色。本研究发现,在VSMC上Hcy可上调AT1R的表达。那么,在心血管其他细胞如心肌细胞、肾小球细胞足细胞等这些重要细胞上,Hcy是否也具有类似的上调AT1R的作用呢?Hcy导致的AT1R的上调对于高血压的转归究竟有多大作用?这些值得关注的问题都有待在离体细胞及整体动物实验上进一步证明。
综上所述,本文在体外培养的大鼠VSMC上,首次发现了Hcy可通过激活ERK1/2信号通路来上调AT1R的蛋白表达。这一结果有助于揭示高Hcy血症与高血压的内在联系,并为伴有高Hcy血症的心血管疾病提供新的治疗理论依据。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Zuo Y M,Wang Y,Liu J P.Recent advances and findings of angiotensin type 2 receptor:a review[J].Chin Med J (Engl),2010,123:3462-3466. |
| [2] | Horiuchi M,Iwanami J,Mogi M.Regulation of angiotensin Ⅱ receptors beyond the classical pathway[J].Clin Sci (Lond),2012,123:193-203. |
| [3] | Nygrd O,Vollset S E,Refsum H,Stensvold I,Tverdal A,Nordrehaug J E,et al.Total plasma homocysteine and cardiovascular risk profile.The hordaland homocysteine study[J].JAMA,1995,274:1526-1533. |
| [4] | Schaffer A,Verdoia M,Cassetti E,Marino P, Suryapranata H,De Luca G,et al.Relationship between homocysteine and coronary artery disease.Results from a large prospective cohort study[J].Thromb Res,2014,14,291-296. |
| [5] | Naess H,Nyland H,Idicula T,Waje-Andreassen U.C-reactive protein and homocysteine predict long-term mortality in young ischemic stroke patients[J].J Stroke Cerebrovasc Dis,2013,22:e435-e440. |
| [6] | Wang C Y,Chen Z W,Zhang T,Liu J,Chen S H,Liu S Y,et al.Elevated plasma homocysteine level is associated with ischemic stroke in Chinese hypertensive patients[J].Eur J Intern Med,2014,25:538-544. |
| [7] | Sutton-Tyrrell K,Bostom A,Selhub J,Zeigler-Johnson C.High homocysteine levels are independently related to isolated systolic hypertension in older adults[J].Circulation,1997,96:1745-1749. |
| [8] | Narayan S K,Firbank M J,Saxby B K,Stansby G,Hansrani M,O’Brien J T,et al.Elevated plasma homocysteine is associated with increased brain atrophy rates in older subjects with mild hypertension[J].Dement Geriatr Cogn Disord,2011,31:341-348. |
| [9] | Vyssoulis G,Karpanou E,Kyvelou S M,Adamopoulos D,Gialernios T,Gymnopoulou E,et al.Associations between plasma homocysteine levels,aortic stiffness and wave reflection in patients with arterial hypertension,isolated office hypertension and normotensive controls[J].J Hum Hypertens,2010,24:183-189. |
| [10] | Bogdanski P,Miller-Kasprzak E,Pupek-Musialik D,Jablecka A,Lacinski M,Jagodzinski P P,et al.Plasma total homocysteine is a determinant of carotid intima-media thickness and circulating endothelial progenitor cells in patients with newly diagnosed hypertension[J].Clin Chem Lab Med,2012,50:1107-1113. |
| [11] | Ruhui L,Jinfa J,Jiahong X,Wenlin M.Influence of hyperhomocysteinemia on left ventricular diastolic function in Chinese patients with hypertension[J].Herz,2014 May 28.[Epub ahead of print] |
| [12] | Baszczuk A,Musialik K,Kopczyński J,Thielemann A,Kopczyński Z,Ksy L,et al.Hyperhomocysteinemia,lipid and lipoprotein disturbances in patients with primary hypertension[J].Adv Med Sci,2014,59:68-73. |
| [13] | Lu H,Lu Z H,Li P G,Wang Y Y,Yan Z Y.Elevated homocysteine and hypertension in Xinjiang Province,China[J].Ethn Dis,2010,20:7-10. |
| [14] | Rodrigo R,Passalacqua W,Araya J,Orellana M,Rivera G.Implications of oxidative stress and homocysteine in the pathophysiology of essential hypertension[J].J Cardiovasc Pharmacol,2003,42:453-461. |
| [15] | Tsai J C,Wang H,Perrella M A,Yoshizumi M,Sibinga N E,Tan L C,et al.Induction of cyclin A gene expression by homocysteine in vascular smooth muscle cells[J].J Clin Invest,1996,97:146-153. |
| [16] | Tsai J C,Perrella M A,Yoshizumi M,Hsieh C M,Haber E,Schlegel R,et al.Promotion of vascular smooth muscle cell growth by homocysteine:a link to atherosclerosis[J].Proc Natl Acad Sci USA,1994,91:6369-6373. |
| [17] | Mujumdar V S,Hayden M R,Tyagi S C.Homocyst(e)ine induces calcium second messenger in vascular smooth muscle cells[J].J Cell Physiol,2000,183:28-36. |
| [18] | Zhang D,Chen Y,Xie X,Liu J,Wang Q,Kong W,et al.Homocysteine activates vascular smooth muscle cells by DNA demethylation of platelet-derived growth factor in endothelial cells[J].J Mol Cell Cardiol,2012,53:487-496. |
| [19] | Zou T,Yang W,Hou Z,Yang J.Homocysteine enhances cell proliferation in vascular smooth muscle cells:role of p38 MAPK and p47phox[J].Acta Biochim Biophys Sin (Shanghai),2010,42:908-915. |
| [20] | Matsusaka T,Ichikawa I.Biological functions of angiotensin and its receptors[J].Annu Rev Physiol,1997,59:395-412. |
| [21] | Bader M.Tissue renin-angiotensin-aldosterone systems:targets for pharmacological therapy[J].Annu Rev Pharmacol Toxicol,2010,50:439-465. |
| [22] | Moshal K S,Sen U,Tyagi N,Henderson B,Steed M,Ovechkin A V,et al.Regulation of homocysteine-induced MMP-9 by ERK1/2 pathway[J].Am J Physiol Cell Physiol,2006,290:C883- C891. |
| [23] | Luo X,Xiao Y,Song F,Yang Y,Xia M,Ling W.Increased plasma S-adenosyl-homocysteine levels induce the proliferation and migration of VSMCs through an oxidative stress-ERK1/2 pathway in apoE(-/-) mice[J].Cardiovasc Res,2012,95:241-250. |
| [24] | Bai Y P,Liu Y H,Chen J,Song T,You Y,Tang Z Y,et al.Rosiglitazone attenuates NF-kappaB-dependent ICAM-1 and TNF-alpha production caused by homocysteine via inhibiting ERK1/2/p38MAPK activation[J].Biochem Biophys Res Commun,2007,360:20-26. |
| [25] | Tang X Q,Shen X T,Huang Y E,Chen R Q,Ren Y K,Fang H R,et al.Inhibition of endogenous hydrogen sulfide generation is associated with homocysteine-induced neurotoxicity:role of ERK1/2 activation[J].J Mol Neurosci,2011,45:60-77. |
 2014, Vol. 35
2014, Vol. 35


