动脉粥样硬化是众多心血管疾病共同的病理基础,由其引发的心血管疾病发病率和死亡率一直居高不下,严重危害人类的健康[1]。在动脉壁损伤或动脉粥样变化早期阶段,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在多种细胞因子如肿瘤坏死因子α(TNF-α)的作用下,经过一系列的表型变化迁移到动脉内膜进行增殖,采取针对TNF-α治疗的策略能够有效抑制病情的发展[2]。因此,降低VSMCs的异常迁移对于心脑血管疾病的治疗具有重要意义。降糖药物二甲双胍(metformin)具有显著的抗动脉粥样硬化的作用,这在动物实验中已得到验证[3],但具体机制尚未明确。本研究拟观察二甲双胍对TNF-α诱导的VSMCs迁移的影响,并从NF-κB信号通路的活化情况及基质金属蛋白酶(matrix metalloproteinases,MMPs)表达变化探讨其作用机制。
1 材料和方法 1.1 材料及试剂
8周龄雄性SD大鼠[中国医科大学动物实验中心提供,许可证号SCXK(辽)2010-0001],二甲双胍片(中美上海施贵宝制药有限公司,批号120421);MMP-2、MMP-9、NF-κB p65、IκB、β-actin抗体及山羊抗兔IgG-HRP(沈阳万类生物科技有限公司);Transwell小室(美国Corning公司);总RNA提取试剂盒、Quant cDNA第一链合成试剂盒(北京天根生物科技有限公司);DMEM培养基(美国Invitrogen公司),胎牛血清(美国Hyclone公司);引物由生工生物工程(上海)股份有限公司合成,其他药品均为国产分析纯。 1.2 细胞培养及分组
按文献[4]报道的方法从8周龄SD大鼠中获得主动脉原代VSMCs。将细胞培养于含2 mmol/L谷氨酰胺、10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中,37℃、5% CO2饱和湿度条件下培养。根据细胞生长状况,每2~3 d更换一次培养液,待细胞生长至80%~90%融合时进行传代。调整大鼠VSMCs状态,选择第3代细胞进行实验。实验设置对照组、TNF-α组(TNF-α终浓度为10 ng/mL)、二甲双胍组(加入终浓度为2 mmol/L的二甲双胍)、二甲双胍+TNF-α组(TNF-α诱导的同时加入二甲双胍,浓度同前)。 1.3 划痕实验检测细胞的迁移能力
将细胞用胰酶消化后接种于6孔板中。待细胞生长完全融合后,用灭菌枪头在单层细胞的中央划痕。用PBS洗涤细胞后,于显微镜下拍照。加入各组条件培养液,常规培养12 h,观察细胞生长情况并于显微镜下拍照,用Image-pro Plus软件分别测量处理前和处理后细胞划痕边界的距离,并计算迁移率。 1.4 Tranwell实验检测细胞的迁移 VSMCs用含不同组分药物的DMEM培养液制成细胞悬液,调整密度为5×104/mL。取200 μL细胞悬液加入上室,下室中加入含20% FBS的与上室相同条件培养液800 μL,置37℃、5%CO2饱和湿度条件下培养24 h。PBS轻轻冲洗小室,并用棉签擦去微孔膜上层细胞。用多聚甲醛在室温下固定20 min,苏木精染液染色7 min,蒸馏水冲洗。在倒置显微镜下(×200)对迁移至微孔膜下层的细胞计数。每组选取5个视野计数,取平均数,以迁移细胞的相对数目来表示细胞的迁移能力。 1.5 RT-PCR法检测MMP-2、MMP-9的表达
各组细胞培养24 h后,TRIzol法提取各组细胞的总RNA,分光光度法测定RNA浓度并调平。按照cDNA第一链合成试剂盒说明书中的方法将mRNA反转录成cDNA。以β-actin为内参进行PCR反应。MMP-2的上游引物5′-GAA TCA CGG AGG AAG CCA AT-3′,下游引物5′-TAG CCC CAA CTT ATC CAG ACT-3′,扩增片段长度224 bp。MMP-9的上游引物5′-GAA TCA CGG AGG AAG CCA AT-3′,下游引物5′-TAG CCC CAA CTT ATC CAG ACT-3′,扩增片段长度190 bp。β-actin的上游引物5′-GGA GAT TAC TGC CCT GGC TCC TAG C-3′,下游引物5′-GGC CGG ACT CAT CGT ACT CCT GCT T-3′,扩增片段长度为155 bp。参照2×Taq PCR Master mix试剂盒说明书进行操作,在反应管中加入cDNA模板2 μL,上、下游引物各1 μL,2×Taq PCR Master-mix 10 μL,最后加入ddH2O补足使反应体系总体积至20 μL。PCR反应条件为:95℃预变性5 min;95℃变性20 s;60℃退火20 s;72℃延伸30 s;共30个循环,最后72℃延伸5 min。PCR反应结束后,将反应产物于1.5%琼脂糖凝胶上进行电泳,利用凝胶成像系统将图片扫描入电脑并进行灰度分析。 1.6 蛋白质免疫印迹法检测MMP-2、MMP-9、NF-κB及IκB的表达
各组细胞培养24 h后收获细胞,用RIPA裂解液作用于细胞,提取总蛋白,并用BCA法测定蛋白质浓度。取40 μg总蛋白经10%分离胶、5%浓缩胶的聚丙烯酰胺凝胶电泳后,电转移至PVDF膜上。用含5%脱脂奶粉的TBST封闭1 h后,分别加入含MMP-2、MMP-9、NF-κB、IκB的一抗封闭液,4℃摇床过夜。PBS洗膜后,加入辣根过氧化物酶标记的二抗,室温孵育1 h。将膜与ECL发光液静置5 min后,转入暗盒,在暗室进行曝光,独立实验重复3次。 1.7 统计学处理
采用SPSS 16.0软件进行数据分析。所有数据采用 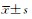 表示,组间比较采用t检验。检验水准(α)为0.05。
2 结 果
2.1 二甲双胍对TNF-α诱导下细胞迁移能力的影响
表示,组间比较采用t检验。检验水准(α)为0.05。
2 结 果
2.1 二甲双胍对TNF-α诱导下细胞迁移能力的影响
划痕实验检测结果表明,与对照组相比,TNF-α处理后细胞的迁移能力明显增强[迁移率分别为(60.48±6.25)%和(87.06±4.61)%,P<0.01];而二甲双胍处理后细胞的迁移能力降低[迁移率为(48.16±2.28)%,P<0.05];用二甲双胍+TNF-α共同处理后细胞的迁移率为(71.23±2.90)%,与TNF-α组相比,细胞的迁移能力明显降低(P<0.01)。Transwell实验结果与划痕实验结果一致:与对照组的迁移数(115±8)相比,TNF-α处理后发生迁移的细胞数为(139±10)个,细胞的迁移能力增强(P<0.01);二甲双胍处理后细胞的迁移数为(89±7)个,表明细胞的迁移能力明显降低(P<0.01)。而用二甲双胍+TNF-α共同处理后发生迁移的细胞个数(117±9)与TNF-α组相比明显下降(P<0.01)。 2.2 二甲双胍对TNF-α诱导下MMP-2、MMP-9表达的影响
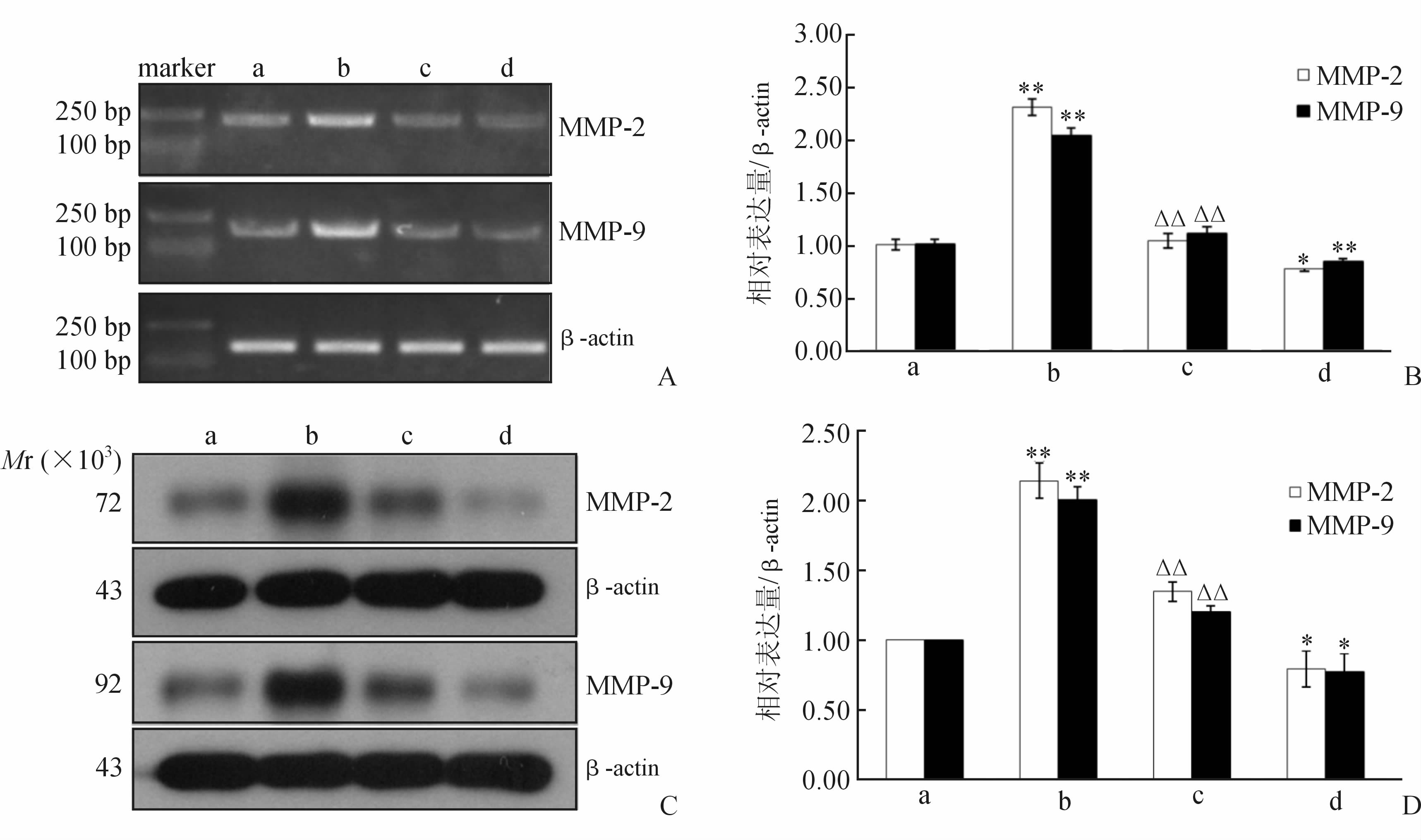
RT-PCR与蛋白质免疫印迹检测各组细胞MMP-2、MMP-9 在基因和蛋白水平的表达,经β-actin校正后结果如图 1所示。TNF-α组MMP-2的基因及蛋白表达水平均高于对照组(P<0.01),二甲双胍组MMP-2基因及蛋白的表达水平则低于对照组(P<0.05);与TNF-α组相比,二甲双胍+TNF-α组MMP-2的基因及蛋白表达量下降(P<0.01)。MMP-9的表达情况与MMP-2基本一致,即TNF-α组表达水平高于对照组(P<0.01),二甲双胍组表达水平低于对照组(P<0.05或P<0.01),二甲双胍+TNF-α组的表达水平与TNF-α组相比下降(P<0.01)。
|
图 1 RT-PCR(A,B)和蛋白质免疫印迹法(C,D)检测VSMCs中MMP-2、MMP-9 基因和蛋白的表达
MMP: 基质金属蛋白酶; VSMCs: 血管平滑肌细胞. a: 对照组; b: TNF-α组; c: 二甲双胍+TNF-α组; d: 二甲双胍组. *P<0.05,**P<0.01与对照组比较; △P<0.05,△△P<0.01与TNF-α组比较. n=3, |
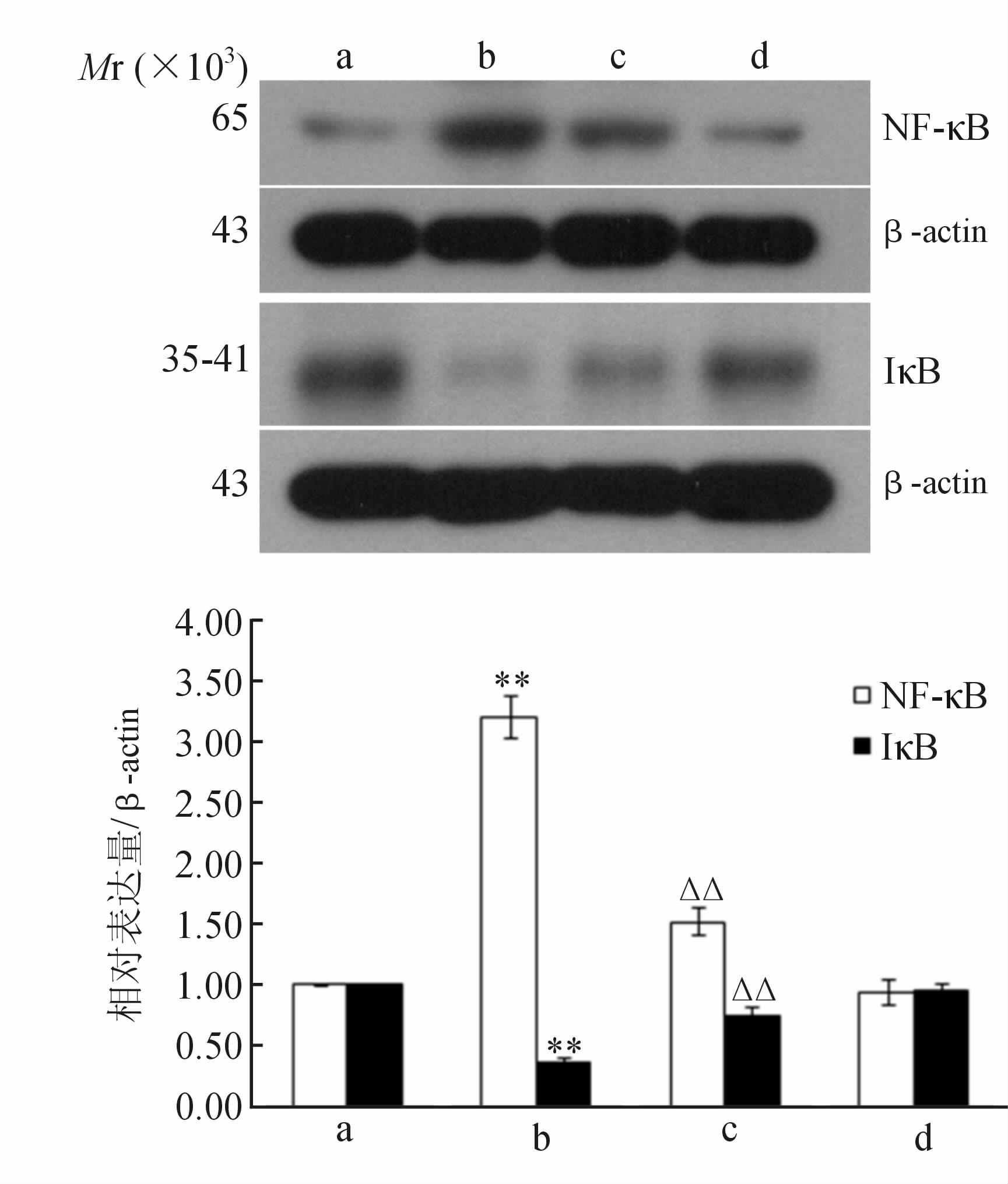
各组细胞培养24 h后,蛋白质印迹法检测细胞核内NF-κB及胞质IκB的表达,结果如图 2。与对照组相比较,TNF-α组NF-κB表达量明显升高(P<0.01),二甲双胍组的NF-κB则与对照组差异无统计学意义;与TNF-α组相比,二甲双胍+TNF-α组NF-κB的表达量则下调(P<0.01)。IκB与NF-κB正相反,TNF-α组IkB的表达较对照组降低(P<0.01),二甲双胍组与对照组差异无统计学意义;而与TNF-α组相比,二甲双胍+TNF-α组IκB的表达则升高(P<0.01)。
|
图 2 蛋白质免疫印迹法检测细胞核内NF-κB的表达及胞质IκB的表达
a: 对照组; b: TNF-α组; c: 二甲双胍+TNF-α组; d: 二甲双胍组. **P<0.01与对照组比较; △△P<0.01与TNF-α 组比较. n=3,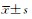
|
VSMCs的增殖和迁移是促成动脉粥样硬化最主要的因素,因此抑制VSMCs的增殖和迁移对于治疗心脑血管疾病具有重要意义。MMPs是一个蛋白水解酶家族,在心脑血管疾病中的研究显示该家族成员能通过促进VSMCs的增殖和迁移来促进动脉粥样硬化的发展[5]。MMP-2和MMP-9是血管内皮细胞表达、分泌的最主要的MMPs,它们不仅在内膜损伤和动脉粥样硬化的发展中发挥关键作用,同时也是细胞迁移能力增加的标志蛋白[6]。在动脉粥样硬化的动物组织中发现MMP-2和MMP-9大量表达,并且下调这两种蛋白的表达或是抑制它们的活性都能有效降低血管新生内膜的形成[7]。研究表明,包括TNF-α在内的炎性因子能通过ERK信号通路来激活细胞内NF-κB,进而促进MMPs在血管内皮细胞中的表达[8]。另有研究显示,TNF-α能诱导大鼠VSMCs的迁移和炎性应答,增加MMP-2、MMP-9 在mRNA及蛋白水平的表达,并且MMPs的表达可能与NF-κB信号通路的激活相关[9]。本研究也观察到类似结果,即TNF-α处理后大鼠VSMCs中MMP-2、MMP-9及NF-κB的水平均显著提高,而NF-κB的抑制蛋白IκB的表达则降低。
二甲双胍是一种用于降低非胰岛素依赖型糖尿病患者血糖浓度的胰岛素增敏药。在血糖控制作用中二甲双胍往往通过AMPK途径抑制IκB-α的磷酸化从而抑制NF-κB的活性[10],而TNF-α则与之作用相反,具有促进IκB-α磷酸化的作用。除了降血糖作用外,二甲双胍还被发现具有治疗心脑血管疾病的作用[11,12,13],比如二甲双胍能增加动脉血流、保护血管完整性、减少动脉壁脂质沉积、防止血栓形成。此外,二甲双胍能减少人VSMCs增殖,从而抑制动脉粥样硬化的进展[14]。在兔动脉粥样硬化的研究中显示,二甲双胍能够显著抑制病变部位NF-κB的活化[15]。但是,二甲双胍预防和治疗动脉粥样硬化的机制仍不十分清楚。本研究便是从二甲双胍对血管平滑肌异常迁移的影响方面探讨其对心脑血管疾病的治疗机制。在加入二甲双胍干预后发现二甲双胍组中MMP-2、MMP-9的表达量降低,且划痕实验和transwell实验也显示其迁移能力显著降低,这说明二甲双胍对正常的VSMCs的迁移能力有抑制作用。此外,二甲双胍+TNF-α组中MMP-2、MMP-9及NF-κB的表达低于TNF-α诱导组,IκB的表达却高于TNF-α诱导组,而且迁移能力也显著下降,这说明二甲双胍还能降低由TNF-α诱导的大鼠血管平滑肌的迁移及MMP-2、MMP-9、NF-κB的表达。
综合本实验的结果,二甲双胍能抑制TNF-α诱导的VSMCs迁移,其抑制作用可能与MMPs表达量的下调及NF-κB信号通路的阻断有关。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 李 薇,杜军保.动脉粥样硬化发病机制研究进展[J].实用儿科临床杂志,2009,24:58-60. |
| [2] | Angel K,Provan S A,Fagerhol M K,Mowinckel P ,Kvien T K,Atar D.Effect of 1-year anti-TNF-α therapy on aortic stiffness,carotid atherosclerosis,and calprotectin in inflammatory arthropathies:a controlled study [J].Am J Hypertens,2012,25:644-650. |
| [3] | Mamputu J C,Wiernsperger N F,Renier G.Antiatherogenic properties of metformin:the experimental evidence [J].Diabetes Metab,2003,29:71-76. |
| [4] | Park E S,Kang S I,Yoo K D,Lee M Y,Yoo H S,Hong J T,et al.Camptothecin inhibits platelet-derived growth factor-BB-induced proliferation of rat aortic vascular smooth muscle cells through inhibition of PI3K/Akt signaling pathway[J].Exp Cell Res,2013,319:982-991. |
| [5] | Newby A C,Zaltsman A B.Molecular mechanisms in intimal hyperplasia [J].J Pathol,2000,190:300-309. |
| [6] | Murtuza B,Suzuki K,Bou-Gharios G,Beauchamp J R,Smolenski R T,Partridge T A,et al.Transplantation of skeletal myoblasts secreting an IL-1 inhibitor modulates adverse remodeling in infarcted murine myocardium[J].Proc Natl Acad Sci U S A,2004,101:4216-4221. |
| [7] | Murtuza B,Suzuki K,Bou-Gharios G,Beauchamp J R,Smolenski R T,Partridge T A,et al.Transplantation of skeletal myoblasts secreting an IL-1 inhibitor modulates adverse remodeling in infarcted murine myocardium[J].Proc Natl Acad Sci U S A,2004,101:4216-4221. |
| [8] | Zhu X,Wang Z,Hu C,Li Z,Hu J.Honokiol suppresses TNF-α-induced migration and matrix metalloproteinase expression by blocking NF-κB activation via the ERK signaling pathway in rat aortic smooth muscle cells[J].Acta Histochem,2014,116:588-595. |
| [9] | Meng L,Yan D,Xu W,Ma J,Chen B,Feng H.Emodin inhibits tumor necrosis factor-α-induced migration and inflammatory responses in rat aortic smooth muscle cells[J].Int J Mol Med,2012,29:999-1006. |
| [10] | Brown K A,Hunger N I,Docanto M,Simpson E R.Metformin inhibits aromatase expression in human breast adipose stromal cells via stimulation of AMP-activated protein kinase[J].Breast Cancer Res Treat,2010,123:591-596. |
| [11] | Eskens B J,Zuurbier C J,van Haare J,Vink H,van Teeffelen J W.Effects of two weeks of metformin treatment on whole-body glycocalyx barrier properties in db/db mice[J].Cardiovasc Diabetol,2013,12:175. |
| [12] | Hong J,Zhang Y,Lai S,Lv A,Su Q,Dong Y,et al.Effects of metformin versus glipizide on cardiovascular outcomes in patients with type 2 diabetes and coronary artery disease [J].Diabetes Care,2013,36:1304-1311. |
| [13] | Roussel R,Travert F,Pasquet B,Wilson P W,Smith S C Jr,Goto S,et al.Metformin use and mortality among patients with diabetes and atherothrombosis[J].Arch Intern Med,2010,170:1892-1899. |
| [14] | Li L,Mamputu J C,Wiernsperger N,Renier G.Signaling pathways involved in human vascular smooth muscle cell proliferation and matrix metalloproteinase-2 expression induced by leptin:inhibitory effect of metformin[J].Diabetes,2005,54:2227-2234. |
| [15] | 李松南,王 祥,曾秋棠,冯义柏,郭和平,王天红,等.二甲双胍对兔动脉粥样硬化NF-κB表达及血清高敏C反应蛋白水平的影响 [J].中国病理生理杂志,2008,24:2339-2343. |
 2014, Vol. 35
2014, Vol. 35


