Roux-en-Y胃肠旁路术(Roux-en-Y gastric bypass,RYGB)是治疗病态肥胖的首选术式,也是目前糖尿病外科最流行的手术方式。临床实践已证明RYGB可有效地改善非肥胖2型糖尿病患者的生活质量[1,2],但其治疗机制仍未完全阐明。有研究显示,刺激迷走神经能明显促进胃泌素的释放,而迷走神经对于抑胃肽、缩胆囊肽(CCK)、肠抑胃肽(GIP)、胰高血糖素样肽-1(GLP-1),酪酪肽(PYY)、载脂蛋白A-Ⅳ(ApoA-Ⅳ)、N-酰基磷脂乙醇胺(NAPE)的调节作用说法不一,学者们认为RYGB后外周GLP-1分泌增多是2型糖尿病缓解的重要机制之一[3,4]。GLP-1对胃肠运动和胰腺内分泌的作用与中枢介导的迷走神经途径密切相关,尤其是迷走神经肝支[5]。研究显示,肝门静脉外膜有迷走神经分支支配,而内膜有GLP-1受体分布,肠源性GLP-1很大可能通过门静脉GLP-1受体刺激迷走神经肝支,激活胰腺迷走神经反射,刺激胰岛素的释放,从而改善糖耐量[6]。Gautron等[7]运用荧光标记法观察转基因小鼠RYGB术后支配胃肠道的完整迷走神经分布模式,为进一步研究迷走神经的机制提供了新的技术指导。本次实验,我们通过选择性切断迷走神经肝支,研究RYGB和迷走神经肝支两种处理因素对2型糖尿病大鼠空腹血糖、血清胰岛素及GLP-1水平的影响。
1 材料和方法 1.1 主要材料及试剂
健康雄性SD大鼠由第二军医大学实验动物中心提供,动物生产许可证号:SCXK(沪)2008-0016。电子分析天平(AEL-200型,日本岛津LIBROR公司),血糖仪为美国Roche公司产品。链脲佐菌素(STZ)购自美国Sigma公司,大鼠GLP-1、ELISA试剂盒购自美国ADL公司。
1.2 动物模型建立6周龄的雄性SD大鼠55只,体质量(185.7±14.8)g。在10~25℃、相对湿度40%~60%环境中适应性饲养1周后,给予高脂高糖饲料喂养1个月,体质量为(467.5±25.7)g。建模前12 h禁食、禁水,用0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 4.4)和新鲜配制的STZ按比配制成1%注射液,于大鼠左下腹进行腹腔注射(60 mg/kg),连续4周。在开始注射造模前及造模后4~7 d空腹剪鼠尾取血,快速使用血糖仪测定血糖浓度。大鼠造模前血糖值为3.1~7.7 mmol/L,注射后连续2次血糖值高于16.7 mmol/L并且保持稳定3 d的大鼠视为肥胖2型糖尿病造模成功,纳入实验,其余大鼠不计入实验。本实验中SD大鼠55只。造模后成功45只,建模成功率为82%。
1.3 动物分组
将建模成功的45只大鼠按照随机分组原则并平衡各组大鼠体质量后,分成假手术组(S组,n=10);假手术+迷走神经肝支切断组(SV组,n=11); RYGB组 (n=12);RYGB+迷走神经肝支切断组(RYGBV组,n=12)。
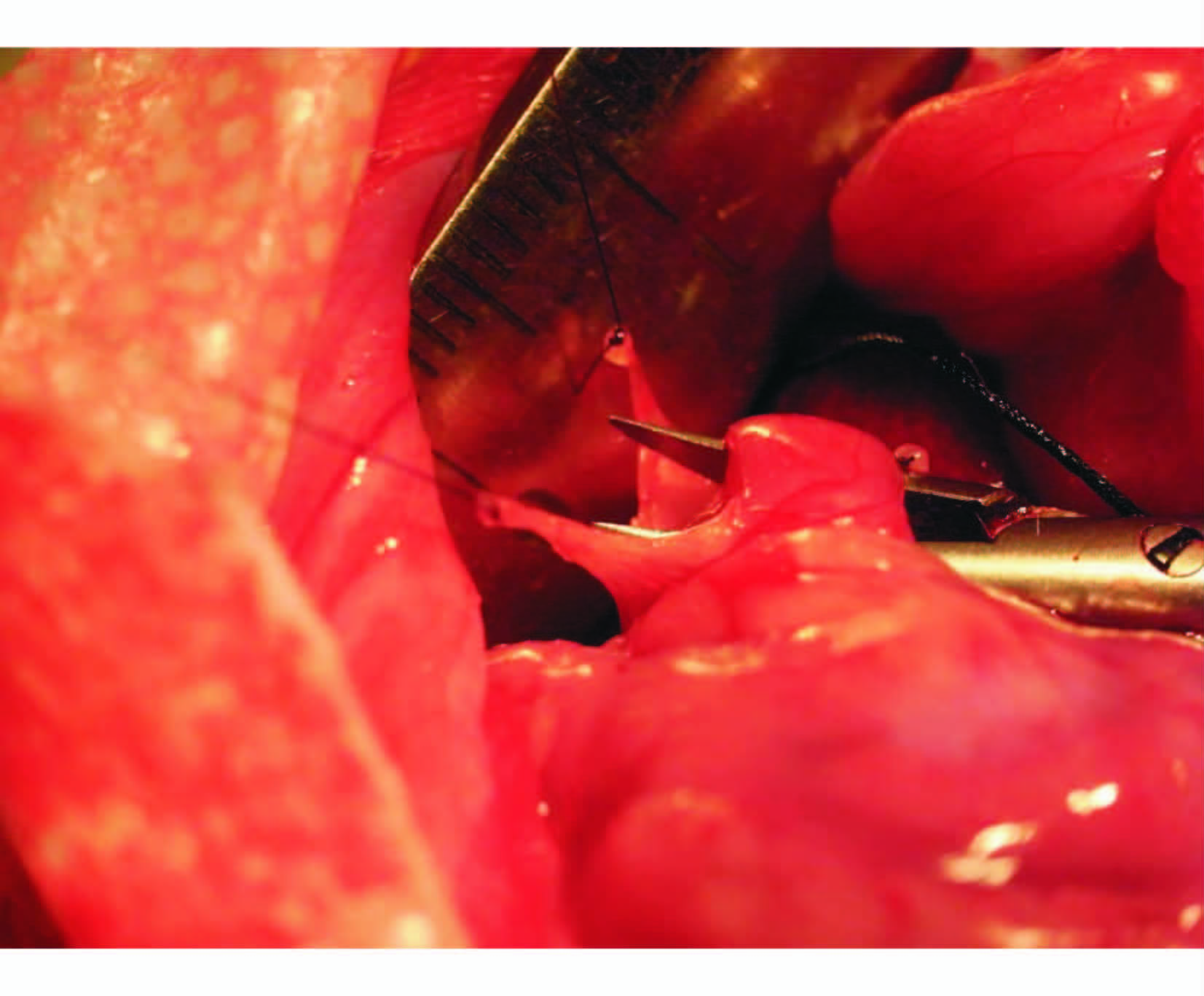
1.4 手术方式各组大鼠术前12 h禁食、禁水。RYGB组:0.3%的戊巴比妥钠按50 mg/kg行左下腹腹腔注射麻醉,皮下注射20 mL 0.9%氯化钠溶液防止脱水休克,术前肌内注射青霉素钠80万单位预防感染。取剑突下1 cm正中纵行3 cm切口,在距Treitz韧带远端约8 cm处切断空肠。近端空肠与远端空肠下方10 cm处行侧侧全层吻合。贲门远端1 cm处断胃,保留约5%小胃囊,近端胃囊与远端空肠断端行侧侧吻合,关闭远端残胃。RYGBV组:近端空肠与远端空肠行侧侧吻合后,离断肝胃韧带,暴露胃小弯侧。将食管和胃轻轻向下拉,把肝的右叶及前叶向上轻轻拉起,肝尾叶向右推,直视下切断贲门上几毫米处由膈下迷走神经腹侧支发出的迷走神经肝支(图 1),仔细操作确保肝脏与食管丛及贲门之间无联系。保留约5%小胃囊,行胃空肠吻合,旷置远端残胃。S组:在与RYGB组相同位置离断胃及空肠,行原位端端吻合。SV组:与RYGB组相同位置离断胃及空肠,行原位端端吻合。将食管和胃轻轻向下拉,把肝的右叶及前叶向上轻轻拉起,肝尾叶向右推,直视下切断贲门上几毫米处由膈下迷走神经腹侧支发出的迷走神经肝支分支,仔细操作确保肝脏与食管丛及贲门之间无联系。当术中发现迷走神经肝支分支不明确时,即将该大鼠剔除实验。各组手术暴露时间相同,仔细检查肠管无扭转及明显出血,生理盐水冲洗腹腔,常规关腹。术后第1、2天禁食,皮下注射5%氯化钠葡萄糖溶液20 mL,术后3~7 d予流质饮食,逐渐恢复普食。
|
图 1 显露后切断迷走神经肝支 Fig 1 Sever hepatic branch of the vagus after exposure |
体质量:天平仪称质量。空腹血糖:尾静脉采血,血糖仪检测。空腹血清胰岛素和GLP-1检测:隔夜禁食12 h后,采用眼眶静脉取血法采血,取各组大鼠手术前以及术后1、2、4、8 周的静脉血1 mL,采血后立即将血液加入装有DPP IV inhibitor 10 μL的试管中,待其混匀,静置30 min后以1 500×g离心10 min,分离出血清,重新装管后置于-80℃冰箱保存。血清胰岛素、GLP-1送中心实验室按照大鼠ELISA试剂盒说明书检测。
1.6 统计学处理应用SPSS17.0统计软件分析,数据以 ±s 表示,不同组间的同一时间点统计指标采用Dunnett-t检验,单个统计指标手术前后的变化采用配对t检验,两组间均数比较采用两独立样本t检验。分析RYGB手术和迷走神经肝支对GLP-1的影响用析因设计方差分析。检验水准(α)为0.05。
2 结 果 2.1 各组实验动物一般情况
S组大鼠术后无死亡(n=10)。SV组大鼠2只术中因迷走神经肝支解剖不清剔除实验(n=9)。RYGB组大鼠死亡3只,分别于术后1 d不明原因死亡,术后3 d、4 d死于吻合口瘘(n=9)。RYGBV组大鼠2只术中因迷走神经肝支分支解剖不清剔除实验,1只因术后1 d腹腔内出血死亡(n=9)。术后1周至8周,存活的37只大鼠在标本采集过程中无死亡。
2.2 各组体质量的变化术前各组间大鼠体质量的差异无统计学意义(P>0.05)。S组和SV组大鼠体质量在术后1周与术前相比下降(P<0.05),术后2周开始逐渐恢复。RYGB组和RYGBV组大鼠体质量在术后1周开始逐渐下降,术后2周时两组大鼠的体质量与S组差异均有统计学意义(P<0.05)。术后8周时,RYGBV组大鼠体质量开始恢复,而RYGB组大鼠仍保持较低体质量,两组差异有统计学意义(P<0.05)。见表 1。
| 表 1 4组大鼠手术前后各时间点体质量的变化 Tab 1 Body mass of rats in four groups at different time points before and after operation |
表 2可见,术前各组大鼠间血糖水平差异无统计学意义(P>0.05)。S组和SV组术后1周至8周空腹血糖值无明显变化(P>0.05);RYGB组和RYGBV组大鼠血糖值在术后1周均开始逐渐下降,均较S组降低(P<0.05)。
| 表 2 4组大鼠手术前后各时间点空腹血糖的变化 Tab 2 Fasting blood-glucose of rats in four groups at different time points before and after operation |
术前各组间大鼠胰岛素水平差异无统计学意义。S组术后胰岛素水平与术前比较,差异无统计学意义(P>0.05)。SV组大鼠胰岛素水平术后1周时较S组升高(P<0.05),术后2周后逐步下降,至术后8周时较S组降低(P<0.05)。RYGB组和RYGBV组术后1周开始胰岛素水平较S组逐渐升高,且RYGB组的胰岛素水平较RYGBV组低(P<0.05);术后2周至8周两组的胰岛素水平均较S组升高(P<0.05),但两组间的差异无统计学意义(P>0.05)。见表 3。
| 表 3 4组大鼠手术前后各时间点空腹血清胰岛素水平的变化 Tab 3 Fasting serum insulin of rats in four groups at different time points before and after operation |
| 表 4 4组大鼠手术前后各时间点空腹血清GLP-1水平的变化 Tab 4 Fasting serum GLP-1 levels of rats in four groups at different time points before and after operation |
析因分析迷走神经肝支对大鼠空腹血清GLP-1水平影响的主效应为3.42 pmol/L(F=47.53,P<0.01),RYGB对大鼠空腹血清GLP-1水平影响的主效应为12.60 pmol/L (F=644.87,P<0.01),两者存在交互作用(F=7.28,P<0.05)。详见表 5。
| 表 5 RYGB和迷走神经肝支对术后8周大鼠空腹血清GLP-1水平影响的析因分析 Tab 5 Fasting serum GLP-1 levels of rats at 8 weeks after RYGB and hepatic branch of vagus |
GLP-1是进食后肠道L细胞分泌的一种肽类激素,具有刺激葡萄糖依赖的胰岛素分泌、抑制胰高血糖素的分泌、促进胰岛细胞增殖、改善胰岛素敏感性、抑制胃肠运动和食物摄入等多种生物学作用[6]。研究发现,2型糖尿病患者肠源性GLP-1分泌减少、延迟;而RYGB术后消化道解剖顺序的改变,近端小肠被旷置,未消化的食糜快速进入富含L细胞的远端回肠可刺激L细胞合成并大量分泌GLP-1[8,9,10]。GLP-1经门静脉进入体循环,通过促进胰岛素分泌、抑制胰高血糖素分泌、抑制食欲等方式维持机体糖稳态[11,12]。
本次实验,我们发现RYGB能减少大鼠的体质量,降低空腹血糖浓度,提高血清空腹胰岛素水平和GLP-1水平。RYGB组大鼠空腹血清胰岛素水平与GLP-1的升高呈正相关,RYGB可以引起空腹血清胰岛素的分泌增加,我们初步判断是由GLP-1的高分泌导致的。而RYGB术后大鼠GLP-1和胰岛素水平均明显升高,提示GLP-1的水平变化在RYGB术后血糖的变化中起到重要作用。这与Shah等[9]的研究结果一致,内源性GLP-1浓度的升高能降低血糖,尤其是餐后血糖的浓度,并刺激胰岛素的释放[13,14,15]。
本研究还发现,切断迷走神经肝支组(RYGBV组)术后8周时大鼠体质量回升,而保留迷走神经肝支(RYGB组)则能更长时间维持较低体质量。比较SV组和S组、RYGBV组和RYGB组,迷走神经肝支的切断与保留对空腹血糖的影响不大,但迷走神经肝支切断后能不同程度降低血清胰岛素和GLP-1的水平。实验中我们发现,术后1周时,SV组胰岛素水平较S组高(P<0.05),RYGBV组胰岛素水平较RYGB组高(P<0.05)。但是,各组间大鼠术后1周时GLP-1水平差异并无统计学意义。胰岛素的水平与迷走神经肝支切断后的整体下降趋势相反,且不与GLP-1水平呈正相关。查阅文献,肝迷走神经对胰岛素的分泌呈现一种紧张性抑制作用,当肝迷走神经去除后,肝迷走神经对脑干(胰腺神经内分泌系统的迷走神经传出中枢)的这种紧张性抑制随之消失,因而短期内胰岛素的分泌明显增多[10]。但是Hayes等[16]的发现与我们的实验结果相反,他们认为GLP-1通过与肠道内分泌细胞自身附近传入迷走神经元胞体上的GLP-1受体结合,激活支配胰腺的传出迷走神经,从而介导胰岛素和血糖的调控,迷走神经肝支并不发挥重要作用。Shin等[11]也认为,迷走神经肝支的保留与否并不影响RYGB后摄食的减少和体质量的减轻。我们的实验更倾向于外周循环中GLP-1通过刺激门静脉GLP-1受体,激活迷走神经肝支途径,从而刺激胰岛素的释放,调控血糖和摄食抑制,长期维持较低体质量。
通过析因方差分析,我们发现RYGB对于GLP-1水平影响的主效应比迷走神经肝支对GLP-1水平影响的主效应高,但两者存在交互作用(P<0.05)。比较各处理因素的单独效应,我们也发现RYGB比迷走神经肝支对GLP-1水平的影响要大,且行RYGB时,保留迷走神经肝支能促使空腹血清GLP-1维持在较高水平。因此,我们认为行RYGB治疗2型糖尿病时,注意保护迷走神经肝支具有积极意义。
本研究也存在一些不足。首先,判断肝脏迷走神经肝支是否去除完全尚无统一标准,我们仅仅是通过解剖学观察确认迷走神经肝支已被切断。其次,GLP-1在循环中被快速地清除提示可能在它分泌区域附近存在GLP-1作用的基本位点,并不能排除GLP-1通过旁分泌效应影响局部小肠迷走神经末梢,经腹腔迷走神经通路介导胰岛素和血糖的调控[16]。再次,GLP-1水平变化到达何种程度才具有临床指导意义,仍待进一步研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 黄 盛, 檀建勇, 戴露倢, 邓治洲, 邹忠东, 王 瑜.两种外科手术治疗大鼠非肥胖2型糖尿病的疗效对比[J].第二军医大学学报, 2011, 32:187-190. Huang S, Tan J Y, Dai L J, Deng Z Z, Zou Z D, Wang Y.Efficacy comparison between two kinds of gastric bypass surgery for non-obse type 2 diabetes mellitus in rats[J].Acad J Sec Mil Med Univ, 2011, 32:187-190. |
| [2] | 李 桢, 张红梅, 赵宏峰, 曾和平, 梁 炜, 王来奎, 等.Roux-en-Y胃旁路术对非肥胖2型糖尿病患者生活质量的影响[J].中华胃肠外科杂志, 2012, 15:1136-1138. |
| [3] | Koda S, Date Y, Murakami N, Shimbara T, Hanada T, Toshinai K, et al.The role of the vagal nerve in peripheral PYY3-36-induced feeding reduction in rats[J].Endocrinology, 2005, 146:2369-2375. |
| [4] | Abbott C R, Monteiro M, Small C J, Sajedi A, Smith K L, Parkinson J R, et al.The inhibitory effects of peripheral administration of peptide YY(3-36) and glucagon-like peptide-1 on food intake are attenuated by ablation of the vagal-brainstem-hypothalamic pathway[J].Brain Res, 2005, 1044:127-131. |
| [5] | Nishizawa M, Nakabayashi H, Uehara K, Nakagawa A, Uchida K, Koya D.Intraportal GLP-1 stimulates insulin secretion predominantly through the hepatoportal-pancreatic vagal reflex pathways[J].Am J Physiol Endocrinol Metab, 2013, 305:E376-E387. |
| [6] | Baggio L L, Drucker D J.Biology of incretins:GLP-1 and GIP[J].Gastroenterology, 2007, 132:2131-2157. |
| [7] | Gautron L, Zechner J F, Aguirre V.Vagal innervation patterns following Roux-en-Y gastric bypass in the mouse[J].Int J Obes (Lond), 2013, 37:1603-1607. |
| [8] | Karra E, Yousseif A, Batterham R L.Mechanisms facilitating weight loss and resolution of type 2 diabetes following bariatric surgery[J].Trends Endocrinol Metab, 2010, 21:337-344. |
| [9] | Shah M, Law J H, Micheletto F, Sathananthan M, Dalla Man C, Cobelli C, et al.Contribution of endogenous glucagon-like peptide 1 to glucose metabolism after Roux-en-Y gastric bypass[J].Diabetes, 2014, 63:483-493. |
| [10] | Warne J P, Foster M T, Horneman H F, Pecoraro N C, de Jong H K, Ginsberg A B, et al.The gastroduodenal branch of the common hepatic vagus regulates voluntary lard intake, fat deposition, and plasma metabolites in streptozotocin-diabetic rats[J].Am J Physiol Endocrinol Metab, 2008, 294:E190-E200. |
| [11] | Shin A C, Zheng H, Berthoud H R.Vagal innervation of the hepatic portal vein and liver is not necessary for Roux-en-Y gastric bypass surgery-induced hypophagia, weight loss, and hypermetabolism[J].Ann Surg, 2012, 255:294-301. |
| [12] | Vahl T P, Tauchi M, Durler T S, Elfers E E, Fernandes T M, Bitner R D, et al.Glucagon-like peptide-1 (GLP-1) receptors expressed on nerve terminals in the portal vein mediate the effects of endogenous GLP-1 on glucose tolerance in rats[J].Endocrinology, 2007, 148:4965-4973. |
| [13] | German J, Kim F, Schwartz G J, Havel P J, Rhodes C J, Schwartz M W, et al.Hypothalamic leptin signaling regulates hepatic insulin sensitivity via a neurocircuit involving the vagus nerve[J].Endocrinology, 2009, 150:4502-4511. |
| [14] | Sclafani A, Ackroff K, Schwartz G J.Selective effects of vagal deafferentation and celiac-superior mesenteric ganglionectomy on the reinforcing and satiating action of intestinal nutrients[J].Physiol Behav, 2003, 78:285-294. |
| [15] | Yamamoto H, Kishi T, Lee C E, Choi B J, Fang H, Hollenberg A N, et al.Glucagon-like peptide-1-responsive catecholamine neurons in the area postrema link peripheral glucagon-like peptide-1 with central autonomic control sites[J].J Neurosci, 2003, 23:2939-2946. |
| [16] | Hayes M R, Kanoski S E, De Jonghe B C, Leichner T M, Alhadeff A L, Fortin S M, et al.The common hepatic branch of the vagus is not required to mediate the glycemic and food intake suppressive effects of glucagon-like-peptide-1[J].Am J Physiol Regul Integr Comp Physiol, 2011, 301:R1479-R1485. |
 2014, Vol. 35
2014, Vol. 35