2. 潍坊市食品药品检验检测中心, 潍坊 261205
2. Center for Food and Drug Control of Weifang, Weifang 261205, Shandong, China
随着核辐射在军事、医疗和能源等方面的广泛应用,人类受照射的概率大大增加,核辐射潜在风险越来越高。大剂量电离辐射除造成胃肠道[1]、造血系统[2]、性腺[3]等辐射敏感器官损伤之外,还可以导致肾脏损伤及其功能障碍[4,5]。另外,腹部肿瘤患者在大剂量放疗时极易导致放射性肾炎,其机制主要是电离辐射作用于肾脏细胞尤其是肾小管上皮细胞(HK-2细胞),通过直、间接作用导致细胞损伤进而产生一系列病理改变,最终致使肾脏功能衰竭[5,6]。然而,对于放射性肾脏损伤尚无有效治疗手段,重在预防[7,8],因此寻找高效、低毒的辐射防护剂对于放射性肾炎的防治具有重大意义。
2007年Ohsawa等[9]报道,氢气(H2)具有选择性清除羟自由基(·OH)和过氧化亚硝基阴离子(ONOO-)的生物活性,显示较强的抗氧化效应。本课题组前期研究发现,富H2溶液对整体动物及细胞具有较好的辐射防护效果,并能减轻免疫系统、生殖系统、造血系统和心肌组织的辐射损伤[10,11,12,13]。国外学者也报道氢气可减轻放射性肺损伤[14],但是关于富H2溶液对放射性肾脏损伤的防护作用的研究还未见报道。本研究以HK-2细胞为研究对象,观察饱和富H2溶液对HK-2细胞的辐射防护效果,初步探讨富H2溶液的辐射防护作用机制,为新型辐射防护剂的研究提供理论和实验基础。
1 材料和方法 1.1 材料
HK-2细胞购自上海拜力生物科技有限公司,Annexin Ⅴ-FITC/PI凋亡试剂盒、丙二醛(MDA)检测试剂盒购自上海碧云天公司,MEM培养基和胎牛血清购自美国PAA公司。2-[6-(4’羟基)苯氧基-3H-占吨醇-3-on-9-yl]-苯甲酸[羟苯基荧光素(HPF)荧光探针]购自日本Daiichi公司。流式细胞仪购自美国Beckman Coulter公司,使用奥林巴斯BX60荧光显微镜进行观察,用第二军医大学辐照中心60Co辐射源进行照射。
1.2 富H2溶液的制备采用特种装置,先将磷酸盐缓冲液(PBS)内充入纯H2,在加压仓内高压(0.4 MPa)下放置4 h以上,以便使H2充分溶解,使其达到饱和状态。利用液体H2浓度测试电极(Biogas Analyzer Systems-1000,Mitleben,日本)进行浓度测试,检测发现制备的富H2溶液中H2达到过饱和浓度(0.814 mmol/L)。
1.3 HK-2细胞处理与照射HK-2细胞用含10%胎牛血清的MEM培养液,在37℃、5% CO2及饱和湿度的细胞培养箱中培养。将对数生长期的HK-2细胞分为对照组、H2组、照射组和照射加H2组。细胞照射前,H2组和照射加H2组细胞离心后各加入5 mL的富H2溶液,对照组和照射组加入等量无H2的PBS溶液,孵育10 min后,照射组和照射加H2组分别同时给予6 Gy 60Co γ射线照射,照射时间为325 s。细胞照射后继续培养,用于后续实验。
1.4 细胞克隆形成实验各组细胞照射后,进行计数,将细胞悬液以200个细胞/孔的密度加入至每孔含有2 mL MEM培养液的6孔板中。每天观察细胞的生长情况,当细胞集落生长到一定程度时(肉眼可见克隆时,本实验为第10天)终止培养。甲醇固定10 min,吉姆萨应用液染色20 min,流水洗净,空气干燥后进行克隆计数分析。
1.5 流式细胞术检测细胞凋亡采用Annexin Ⅴ-FITC/PI凋亡试剂盒,用流式细胞仪检测细胞凋亡情况。照射后24 h,将细胞制成5×106/mL的细胞悬液,PBS洗2次弃上清,加入50 μL PBS重悬。每50 μL体系加入1.5 μL Annexin Ⅴ-FITC温室避光孵育15 min,再加入2 μL PI,5 min后上机检测[10]。
1.6 MDA含量测定收集各组细胞,裂解并高速离心后取适量上清液,应用比色法检测MDA。根据试剂盒说明书计算MDA含量。
1.7 细胞内·OH水平的测定各组细胞照射前加入HPF(终浓度为10 μmol),用6 Gy γ射线照射后,37℃孵育15 min。荧光显微镜下观察并拍照。用IPLabSpectrum图像分析软件(版本4.0,美国Scanalystics公司)对单个细胞中的HPF平均荧光强度进行定量分析。每次实验各剂量组随机选取5个不同的视野,随机检测50个细胞的荧光强度值[10]。
1.8 统计学处理所得数据以 x ±s 表示,采用SPSS13.0软件进行统计学分析,组间比较采用方差齐性的成组t检验。检验水准(α)为0.05。
2 结 果 2.1 富H2溶液增加HK-2细胞照射后存活率
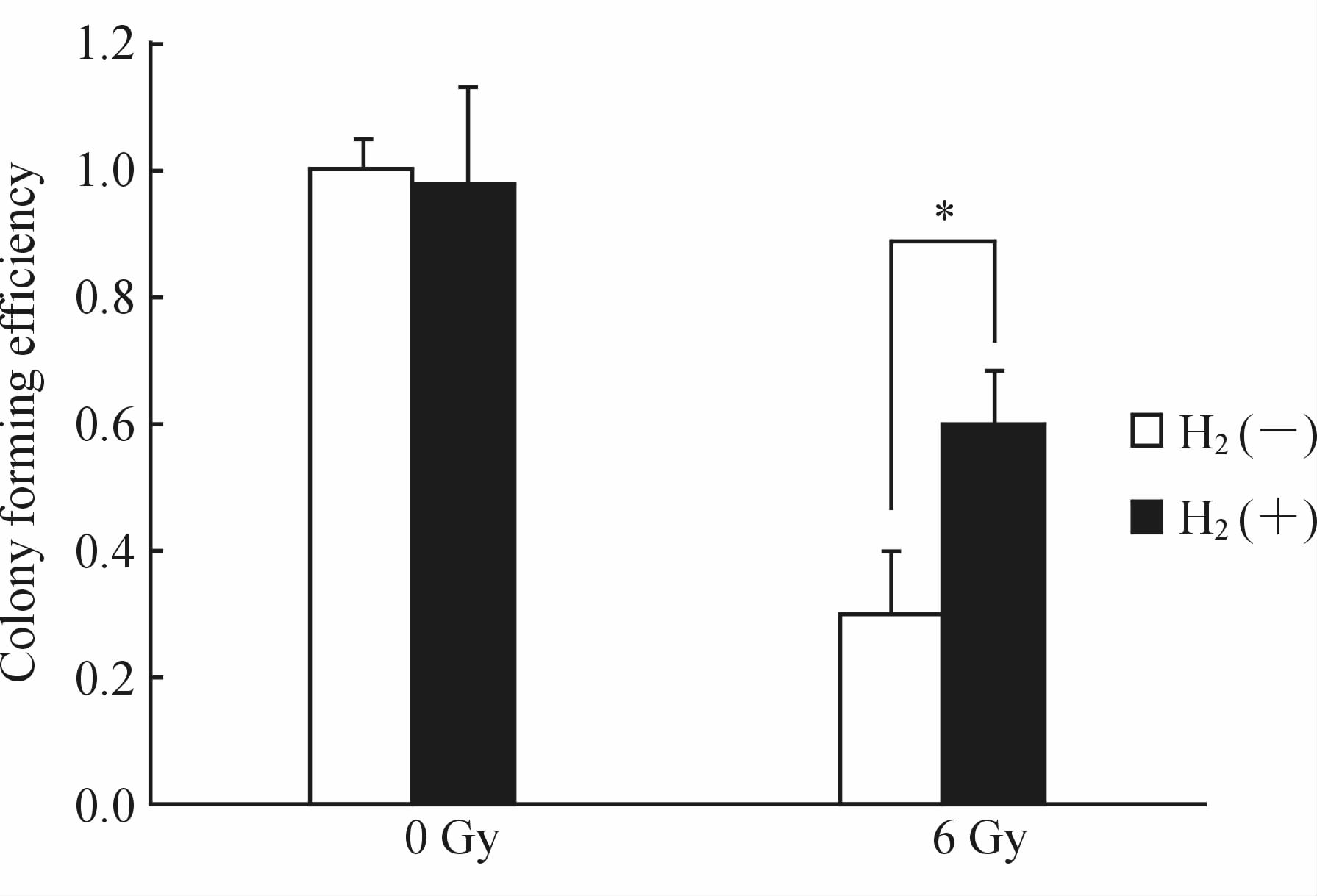
照射后第10天计数各组细胞克隆形成率,结果显示:照射加H2组HK-2细胞克隆形成率明显高于照射组(图 1),差异具有统计学意义(P<0.05),说明富H2溶液对HK-2细胞有一定的辐射防护作用。
|
图 1 富H2溶液明显提高HK-2细胞照射后克隆形成率
Fig 1 Hydrogen-rich saline notably enhanced the cloning efficiency of irradiated HK-2 cells
*P<0.05; n=6,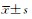
|
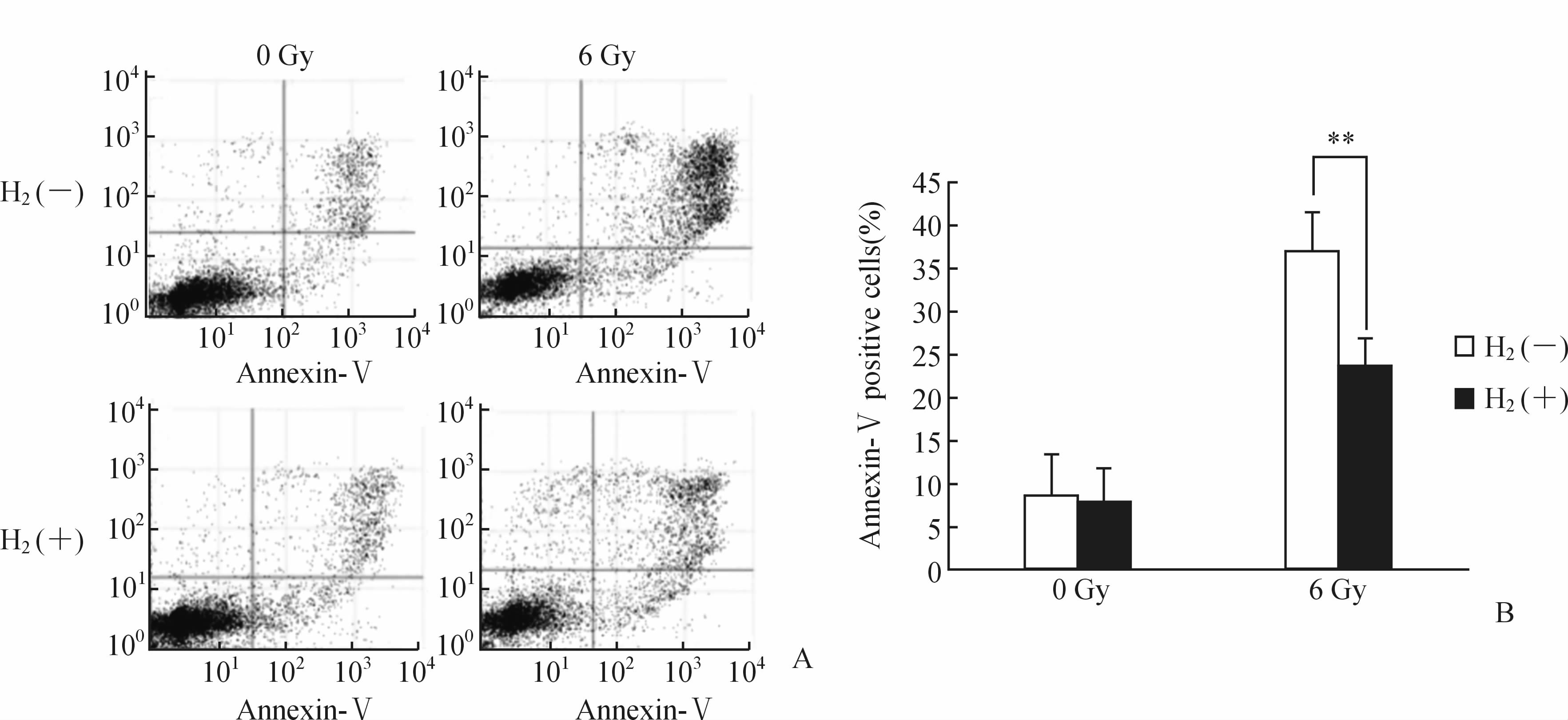
照射后24 h,检测各组的细胞凋亡水平。结果显示,两照射组的细胞凋亡率高于对照组及H2组,而照射加H2组的细胞凋亡率明显低于照射组,具有统计学差异(P<0.01,图 2),表明富H2溶液能减轻辐射诱导的细胞凋亡。
|
图 2 富H2溶液抑制辐射诱导的HK-2细胞凋亡
Fig 2 Hydrogen-rich saline inhibited irradiation-induced apoptosis of HK-2 cells
A: Descriptive outcome;B: Quantitative outcome. **P<0.01; n=6,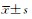
|
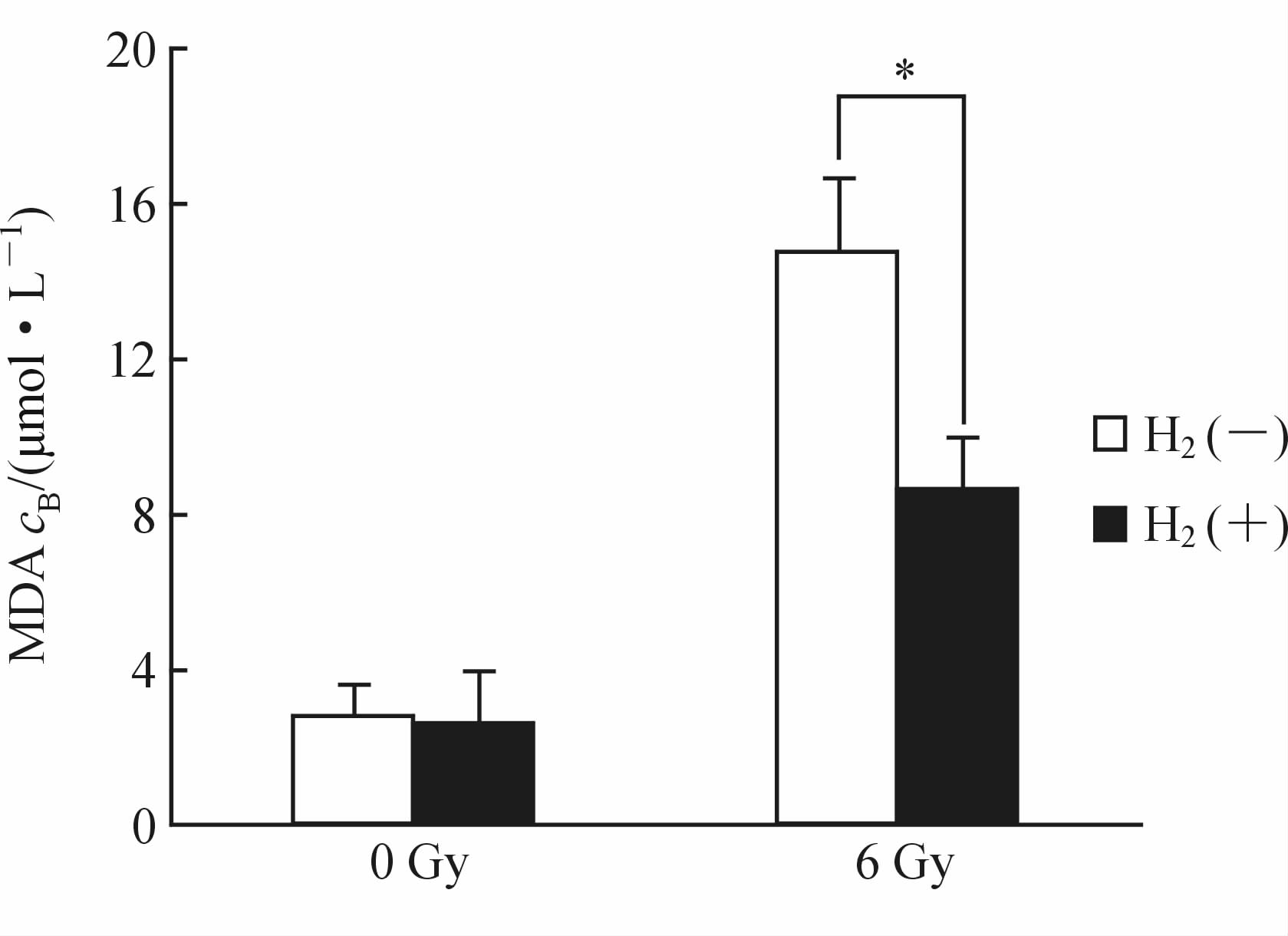
MDA可以间接反映辐射对生物脂质的损伤,照射加H2组HK-2细胞的MDA水平明显低于照射组,差异具有统计学意义(P<0.05,图 3),说明富H2溶液降低了辐射诱导的MDA水平,提示其具有抗氧化作用。
|
图 3 富H2溶液能减少辐射导致的MDA的产生
Fig 3 Hydrogen-rich saline decreased malondialdehyde (MDA) production induced by irradiation
*P<0.05; n=6,
|
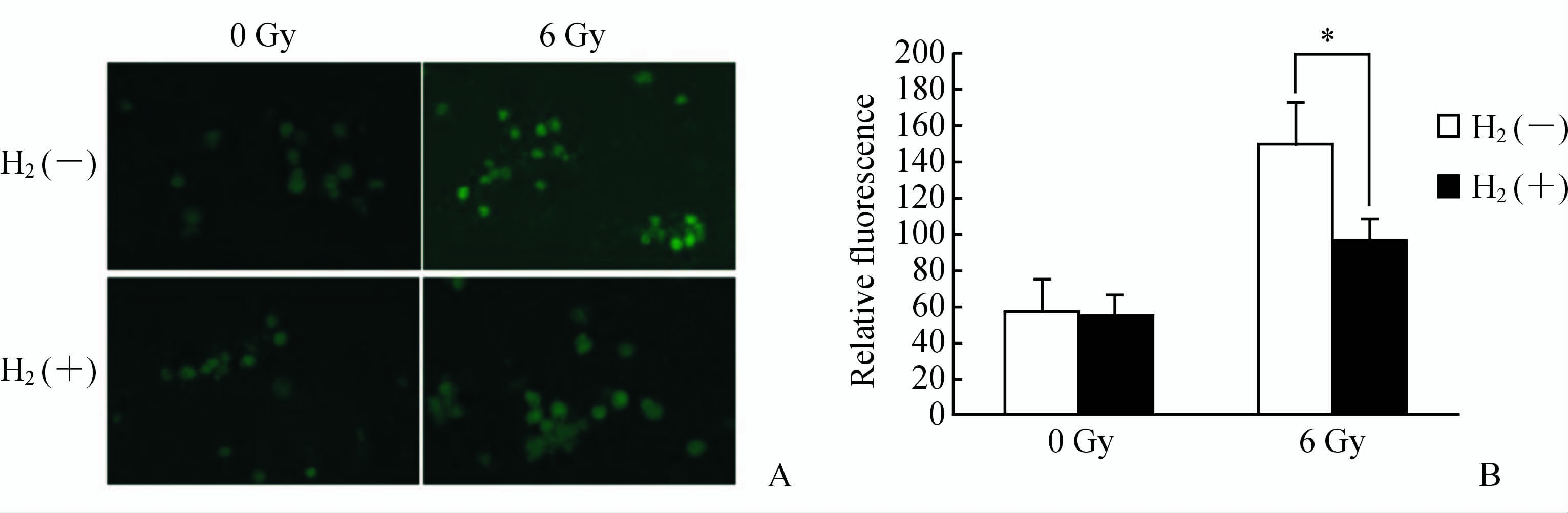
γ射线照射可诱导·OH的产生,而照射期间用富H2溶液孵育细胞,明显降低了HK-2细胞中辐射诱导的·OH的水平(P<0.05,图 4)。
|
图 4 富H2溶液降低HK-2细胞中辐射诱导的·OH水平
Fig 4 Hydrogen-rich saline decreased ·OH level in HK-2 cells induced by irradiation
A: Descriptive outcome; B: Quantization outcome. *P<0.05; n=6,
|
关于富H2溶液对放射性肾损伤的防护作用的研究方面,本课题之前未见国内外报道。本研究以HK-2细胞为研究对象,观察了饱和富H2溶液对HK-2细胞的辐射防护效果,并且初步探索了其辐射防护作用机制,具有重要的科学意义。
过去大部分学者一直认为H2是一种生理性惰性气体,像氮气一样不与体内任何物质发生反应[15,16]。然而近年来研究发现,H2可以清除体内的细胞毒性氧自由基[9]。有关富H2溶液对小鼠造血干细胞、胃肠道细胞、肺细胞等的辐射防护效应研究结果支持其辐射防护效果[12,14,17]。同时,人体肠道细菌不断地产生H2并在血液中循环,说明少量H2对人体无毒副作用。H2是易燃气体,具有一定的危险性,将其溶于各种溶剂中再予以使用则解决了这一问题。
电离辐射对机体的损伤主要分为直接损伤和间接损伤,尤以间接损伤占据主导地位,通过水等的辐射产物(如·OH等)引起生物大分子的损伤,辐射损伤中60%~70%是由于·OH所致[9,18]。因而辐射防护的重点主要是针对间接损伤,即通过清除辐射产生的自由基,提高机体的抗辐射能力,从而保护机体组织和器官免受伤害。电离辐射作用于机体之后,产生诸如超氧阴离子(O2-)、过氧化氢(H2O2)、·OH及一氧化氮(NO)等活性氧自由基(ROS)或活性氮自由基(RNS)等,从而对生物大分子造成损伤[11],这是间接辐射损伤的核心机制。鉴于此,针对电离辐射损伤的发生机制,寻找高效、低毒、使用方便的自由基清除剂,是探索新型辐射防护剂的有效途径,是目前国内外辐射防护领域的重要研究思路之一。
我们通过富H2溶液对HK-2细胞的防护实验发现,在6 Gy照射时,照射加H2组于照射后10 d HK-2克隆形成率较照射组有明显升高(P<0.05)。Annexin Ⅴ-FITC/PI双染检测细胞早期凋亡率分析结果也发现,照射加H2组较照射组HK-2细胞早期凋亡率降低,差异具有统计学意义(P<0.01)。这些结果表明富H2溶液可以减轻HK-2细胞的辐射损伤,增加其存活率;而前期研究发现,富H2溶液对机体其他组织细胞有较为明确的辐射损伤防护效应[12,13,14,15,19,20],提示富H2溶液对肾脏辐射损伤的改善可能有一定的积极作用。
生物脂质是ROS的主要攻击目标之一,脂质氧化物如MDA、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARs)等的增多反映出脂质受到氧化损伤[21]。HK-2细胞受照射后MDA显著增高,但是在照射前给予富H2溶液处理,细胞内的MDA水平显著降低。说明富H2溶液可以有效降低辐射诱导的脂质过氧化产物,即减轻生物脂质的氧化反应。细胞膜和大多数细胞器均具有膜结构,其中主要组成部分是脂质,本结果说明富H2溶液可以有效减轻生物脂质的辐射损伤,从而保证其生物学功能的正常发挥。
HPF是Setsukinai等合成的一种选择性极高的测定·OH的新型荧光探针,它选择性地、剂量依赖式地与·OH发生特异性反应,生成一种强荧光复合物,能够抵抗光诱导的自动氧化反应;而且,HPF不与O2-、H2O2、单线态氧等其他活性氧发生反应[22],这些优点更有利于快速、准确地定量分析细胞内的·OH[11]。本研究发现,照射组和照射加H2组经6 Gy剂量照射后,照射加H2组的HPF荧光强度明显低于照射组,提示富H2溶液可以降低照射后HK-2细胞内的·OH含量。因此我们认为富H2溶液通过及时清除辐射引起的自由基与阻断氧化效应,减轻辐射引起的一系列生物学损伤,从而对受照射细胞发挥保护作用。
综上所述,富H2溶液对HK-2细胞具有较好的辐射防护作用,其作用机制可能与氢气清除自由基以及抗氧化活性有关,提示富H2溶液有可能成为放射性肾损伤的新型防护剂,具有较大应用前景。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 王文亭, 李建远.电离辐射对雄性生殖健康影响研究进 展[J].中国保健营养, 2013, 23:3421. |
| [2] | 周美娟, 郑 莉, 丁振华.辐射对造血系统的影响[J].国外医学放射医学核医学分册, 2004, 28:139-142. |
| [3] | 马晓飞, 张 红.小肠电离辐射损伤研究进展[J].原子核物理评论, 2010, 27:323-326. |
| [4] | 高林峰, 王洪复.电离辐射所致肾损伤引起的骨代谢异常的机制探讨[J].辐射研究与辐射工艺学报, 2006, 24:303-307. |
| [5] | 高林峰, 王洪复, 朱飞鹏.电离辐射肾损伤病理特点及其机理研究[J].中华放射医学与防护杂志, 2004, 24:430-432. |
| [6] | 袁玉兰, 杨品清.放射性肾损伤[J].哈尔滨医科大学学报, 1984(3):144-146. |
| [7] | Harada T, Kono S.[Radiation nephritis].Nihon Naika Gakkai Zasshi, 1999, 88:1463-1466. |
| [8] | Krochak R J, Baker D G.Radiation nephritis.Clinical manifestations and pathophysiologic mechanisms[J].Urology, 1986, 27:389-393. |
| [9] | Ohsawa I, Ishikawa M, Takahashi K, Watanabe M, Nishimaki K, Yamagata K, et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med, 2007, 13:688-694. |
| [10] | Yang Y, Li B, Liu C, Chuai Y, Lei J, Gao F, et al.Hydrogen-rich saline protects immunocytes from radiation-induced apoptosis[J].Med Sci Monit, 2012, 18:BR144-BR148. |
| [11] | Chuai Y, Gao F, Li B, Zhao L, Qian L, Cao F, et al.Hydrogen-rich saline attenuates radiation-induced male germ cell loss in mice through reducing hydroxyl radicals[J].Biochem J, 2012, 442:49-56. |
| [12] | Qian L, Cao F, Cui J, Huang Y, Zhou X, Liu S, et al.Radioprotective effect of hydrogen in cultured cells and mice[J].Free Radic Res, 2010, 44:275-282. |
| [13] | Qian L, Cao F, Cui J, Wang Y, Huang Y, Chuai Y, et al.The potential cardioprotective effects of hydrogen in irradiated mice[J].J Radiat Res, 2010, 51:741-477. |
| [14] | Terasaki Y, Ohsawa I, Terasaki M, Takahashi M, Kunugi S, Dedong K, et al.Hydrogen therapy attenuates irradiation-induced lung damage by reducing oxidative stress[J].Am J Physiol Lung Cell Mol Physiol, 2011, 301:L415-L426. |
| [15] | Fontanari P, Badier M, Guillot C, Tomei C, Burnet H, Gardette B, et al.Changes in maximal performance of inspiratory and skeletal muscles during and after the 7.1-MPa Hydra 10 record human dive[J].Eur J Appl Physiol, 2000, 81:325-328.. |
| [16] | Hong S K, Bennett P B, Shiraki K, Lin Y C, Claybaugh J R.Mixed-gas saturation diving[J].Comp Physiol, 2011:1023-1045. |
| [17] | Qian L, Cao F, Cui J, Huang Y, Zhou X, Liu S, et al.Radioprotective effect of hydrogen in cultured cells and mice[J].Free Radic Res, 2010, 44:275-282. |
| [18] | Ward J F.DNA damage produced by ionizing radiation in mammalian cells:identities, mechanisms of formation, and reparability[J].Prog Nucleic Acid Res Mol Biol, 1988, 35:95-125. |
| [19] | Chuai Y, Shen J, Qian L, Wang Y, Huang Y, Gao F, et al.Hydrogen-rich saline protects spermatogenesis and hematopoiesis in irradiated BALB/c mice[J].Med Sci Monit, 2012, 18:BR89-BR94. |
| [20] | Jiang Z, Xu B, Yang M, Li Z, Zhang Y, Jiang D.Protection by hydrogen against gamma ray-induced testicular damage in rats[J].Basic Clin Pharmacol Toxicol, 2013, 112:186-191. |
| [21] | Yurkova I, Shadyro O, Kisel M, Brede O, Arnhold J.Radiation-induced free-radical transformation of phospholipids:MALDI-TOF MS study[J].Chem Phys Lipids, 2004, 132:235-246. |
| [22] | Setsukinai K, Urano Y, Kakinuma K, Majima H J, Nagano T.Development of novel fluorescence probes that can reliably detect reactive oxygen species and distinguish specific species[J].J Biol Chem, 2003, 278:3170-3175. |
 2014, Vol. 35
2014, Vol. 35


