近年来,随着免疫缺陷宿主的不断增多,临床深部真菌感染率大幅上升,已成为免疫功能低下患者死亡的主要原因之一。白假丝酵母菌作为人类的条件致病性真菌,是深部真菌感染的主要病原菌。液泡是真菌细胞中降解大分子、储存营养物质以及耐受外界压力的细胞器。真菌细胞液泡具有哺乳动物细胞溶酶体功能之外的其他功能,液泡通过提高白假丝酵母菌对应激的耐受能力、促进菌丝生长、协助细胞杀伤巨噬细胞等作用,帮助白假丝酵母菌发挥其致病性[1,2]。本研究选取了 ORF19.2734、 ORF19.6950、 ORF19.6605、 ORF19.2006、 ORF19.5780 等5个潜在液泡功能相关基因,通过构建各基因敲除菌,考察其液泡形态、生长、菌丝及对各种刺激的敏感性,进而试图发现并阐明白假丝酵母菌液泡在真菌耐药中的作用。
1 材料和方法 1.1 菌株及试剂菌株SN152、质粒pSN40、pSN52、pSN69均由美国加利福尼亚大学Suzanne M. Noble教授馈赠。从-80℃ 25%甘油冻存菌中吸取少量菌,划线接种至酵母浸膏葡萄糖(yeast extract peptone dextrose,YPD)固体培养基,于30℃培养48 h;从中挑取单个菌落于1 mL YPD液体培养基中30℃振摇16 h活化。氟康唑、酮康唑、咪康唑、两性霉素B、布雷菲德菌素、刚果红、荧光增白剂、羟基脲及羟乙基哌嗪乙硫磺酸(HEPES)均购自Sigma公司。氯化钠、氯化钙、氯化锂、过氧化氢、甘氨酸、甘油、氢氧化钠、DMSO购自中国医药集团上海化学试剂公司。
1.2 基因敲除菌的构建
候选基因选自白假丝酵母菌数据库(candida genome database,CGD)中与液泡相关但功能尚未完全明确的5个基因: ORF19.2734、 ORF19.6950、 ORF19.6605、 ORF19.2006、 ORF19.5780 。应用Primer 3软件分别设计引物,由生工生物工程(上海)有限公司定制,在-20℃保存。各引物序列见表 1。用融合PCR介导的His1-Leu2-Arg4基因策略[3]构建双臂敲除菌,采用琼脂糖凝胶电泳鉴定敲除效果。
| 表 1 本研究所用基因敲除菌构建的引物及其序列 Tab 1 Primers used for disruption of target genes |
活化菌株,使真菌处于指数生长期后期;用新鲜YPD调整菌密度为1×106 cells/mL,以零时为起点,每隔1 h取1 mL菌液,充分混匀后用分光光度计于600 nm波长下测定光密度(D)值,共计12 h,记录并绘制曲线。
1.4 Spot assay[4]不同pH的培养基制备:YPD培养液基础上用150 mmol/L HEPES缓冲液调pH为4.0,或用50 mmol/L甘氨酸-氢氧化钠缓冲液调pH为10,用pH计测定。在超净台中用0.22 μm滤膜过滤除菌,4℃保存。固体培养基在YPD固体培养基灭菌后冷却至50℃左右于超净台中,用0.22 μm滤膜过滤过的缓冲液调好pH后倒入无菌培养皿,冷却凝固后于4℃保存。在YPD固体培养基基础上分别加4 μg/mL氟康唑、2 μg/mL酮康唑、2 μg/mL咪康唑、0.5 μg/mL两性霉素B、15 μg/mL布雷菲德菌素A、200 μg/mL刚果红、25 μg/mL荧光增白剂、1.5 mol/L氯化钾、1.5 mol/L氯化钠、250 mmol/L氯化钙、200 mmol/L氯化锂、8 mmol/L过氧化氢、2.5 mmol/L甘油、30 mmol/L羟基脲制备含药培养基。
活化菌株,使真菌处于指数生长期;用YPD调整菌密度为5×106 cells/mL,再依次5倍稀释5个浓度梯度,每个浓度取3 μL点于相应含药培养基上,30℃避光静置培养48 h后,观察菌落生长状态。
1.5 菌丝诱导实验活化菌株,用PBS缓冲液调整菌密度为2×102 cells/mL,取50 μL均匀涂布于含10%FBS的YPD[5]、Spider[6]、Lee’s[7]的固体培养基上,待完全吸收后10%FBS、Spider置于37℃培养5 d,Lee’s置于25℃培养10 d,观察菌丝生长情况。
液体培养液中培养观察菌丝:活化菌株,使真菌处于对数生长期,按1∶1 000接种于10%FBS的YPD、Spider、Lee’s液体培养液中,将含菌的培养液混合均匀,取1 mL加入9孔板中置37℃培养3 h,观察并拍照。
1.6 激光共聚焦观察液泡形态[8]活化菌株,使真菌处于指数生长期后期;转移至1.5 mL离心管中于4 000×g室温离心5 min,吸弃上清,收集菌体。用1 mL新鲜YPD培养液重悬菌体,加入2.5 μL FM4-64染料(16 mmol/L),涡旋混匀,避光30℃水浴30 min。4 000×g室温离心5 min,吸弃上清,用5 mL YPD培养液重悬菌体,30℃振摇,培养2 h。4 000×g室温离心5 min,吸弃上清,用1 mL 灭菌水重悬菌体,反复2次,彻底洗去培养液。用500 μL 全合成培养基(synthetic complete medium,SC) 重悬菌体,取8 μL点于载玻片上,小心盖上盖玻片,于激光共聚焦显微镜下观察荧光,激发波长为558 nm,发射波长为734 nm。
1.7 实时定量PCR分析 ORF19.2734 敲除菌对唑类药物敏感性增加的机制选择药物外转运相关基因 MDR1、 CDR1、 CDR2,麦角甾醇合成通路相关基因 ERG2,ERG11 编码唑类药物的靶酶Erg11p,菌丝负调控转录因子 NRG1、BCR1 考察基因缺失菌在酮康唑2 μg/mL作用2 h后上述基因的表达水平。通过嵌合荧光染料(SYBR Green)检测法进行实时定量PCR检测基因的表达水平。引物应用Primer 3软件设计,由生工生物工程(上海)有限公司合成。各引物序列见表 2。结果分析采用2-ΔΔCt法,用内参18S的Ct值校正目的基因的Ct值,得到ΔCt值,比较实验组与对照组的ΔCt值得到ΔΔCt值,基因拷贝数比值(实验组/对照组)=2-ΔΔCt。本实验取不同的单克隆菌落重复3次,并计算平均值。
| 表 2 实时定量PCR引物及其序列 Tab 2 Primers used for real-time PCR |
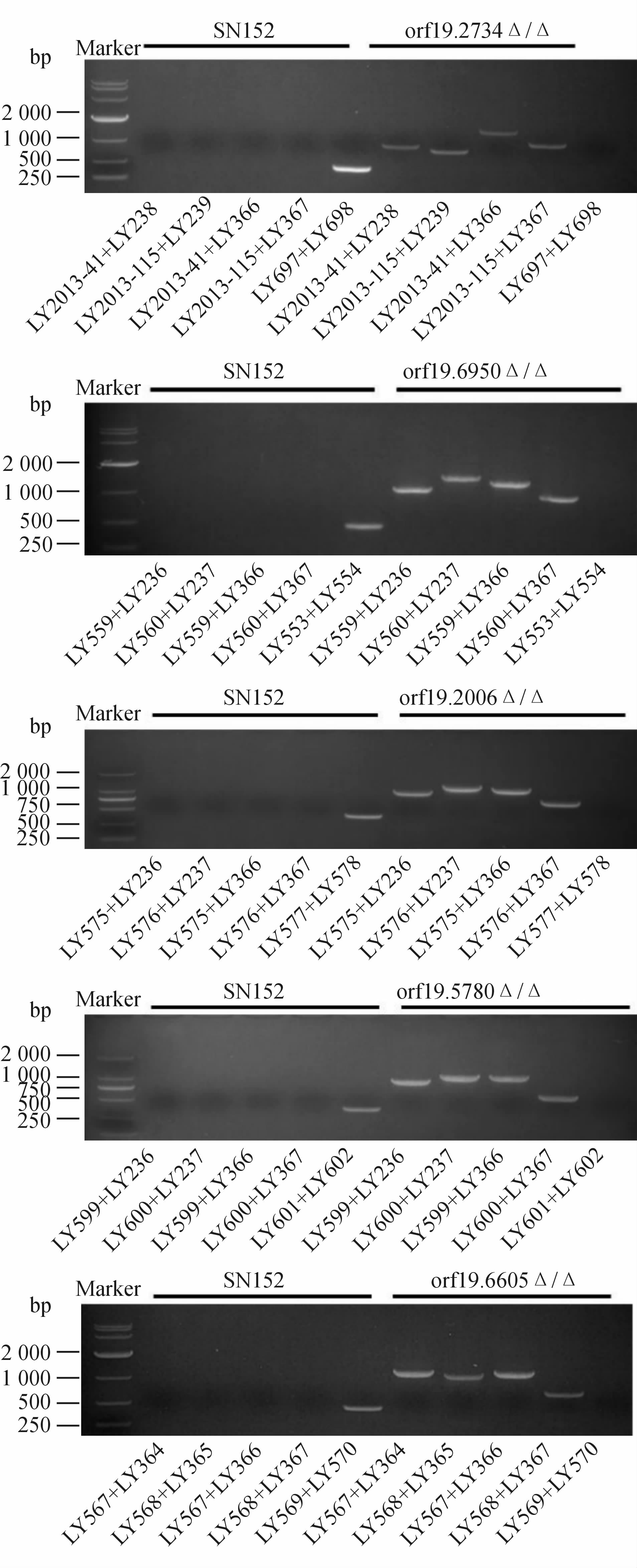
琼脂糖凝胶电泳鉴定结果(图 1)显示,各基因敲除菌中 HIS1 和 LEU2 的融合片段均已成功整合至基因组正确位置,实验所需目的基因均已分别敲除,各基因缺失菌orf19.2734Δ/Δ、orf19.6950Δ/Δ、orf19.6605Δ/Δ、orf19.2006Δ/Δ、orf19.5780Δ/Δ构建成功。
|
图 1 各基因缺失菌基因组DNA的PCR验证 Fig 1 PCR analysis confirming disruption of ORF19.2734,ORF19.6950,ORF19.6605,ORF19.2006 and ORF19.5780 |
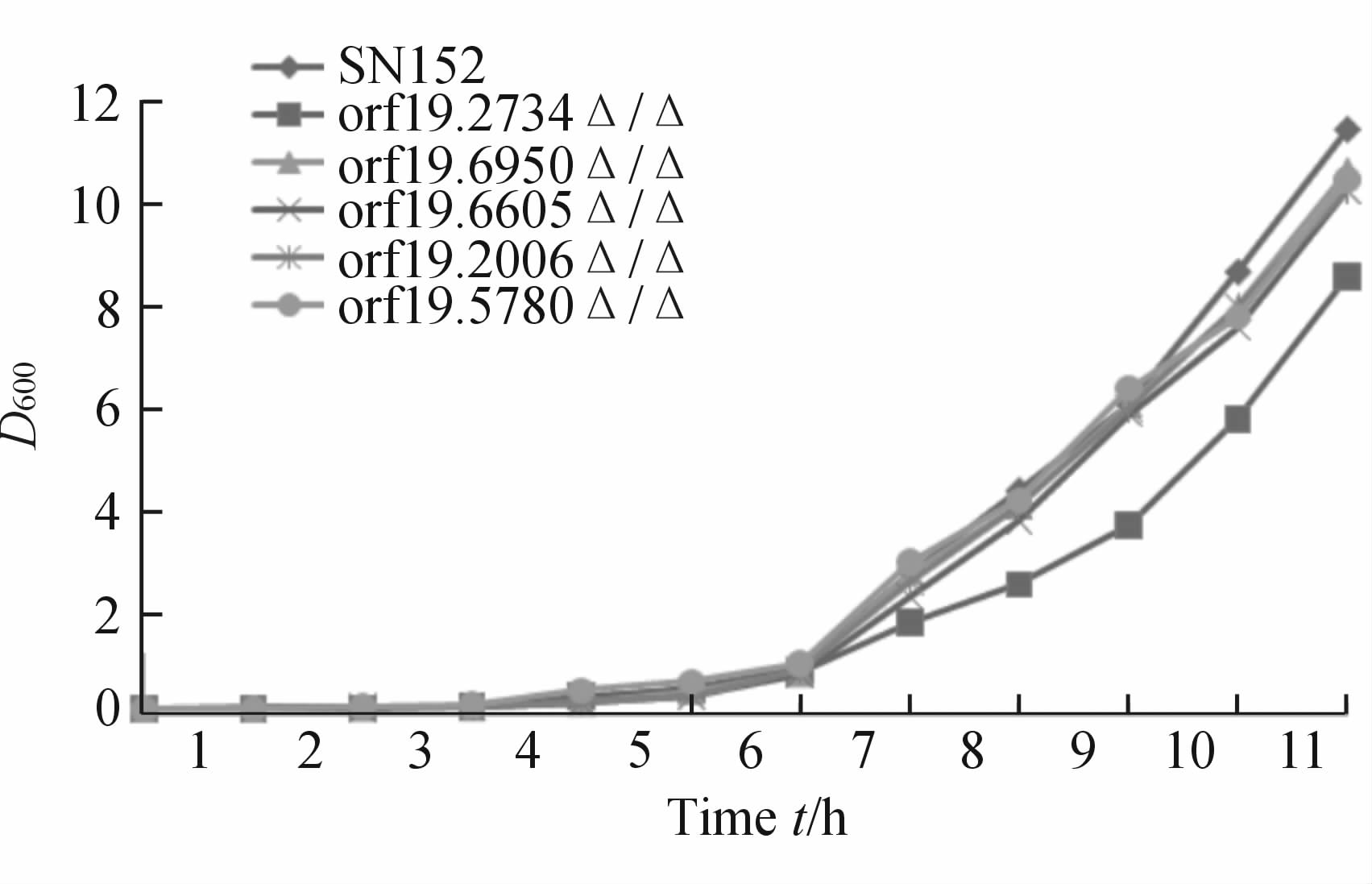
图 2可见,ORF19.2734 基因缺失菌orf19.2734Δ/Δ的生长在6 h之后较野生菌 C. albicans SN152缓慢,而其他基因缺失菌表现均与野生菌一致。提示 ORF19.2734 基因能起到维持白假丝酵母菌正常生长的作用。
|
图 2 各菌株生长曲线 Fig 2 Time-growth curve of C. albicans SN152 and the mutants D600 was detected at indicated time points |
图 3所示,与野生菌SN152相比,orf19.2734Δ/Δ菌株对酮康唑、布雷菲尔德菌素的敏感性升高,对两性霉素B耐受,对其他刺激的敏感性无明显改变;orf19.6950Δ/Δ、orf19.6605Δ/Δ、orf19.2006Δ/Δ、orf19.5780Δ/Δ菌株对各刺激的敏感性与野生菌相比,未见明显差异。结果提示,ORF19.2734 基因可提高白假丝酵母菌对酮康唑的耐受及对两性霉素B的敏感性。

|
图 3 应激敏感性实验 Fig 3 Sensitivity to various stresses of C. albicans with wild-type SN152 and the mutants Adaptation to C. albicans with wild-type SN152 and orf19.2734Δ/Δ,orf19.6950Δ/Δ,orf19.6605Δ/Δ,orf19.2006Δ/Δ,orf19.5780Δ/Δ mutants were all grown to mid-log phase and then spotted in 5-fold dilutions onto yeast extract peptone dextrose (YPD) plates with or without chemical agents as indicated. The concentrations of cells were 1×107cells/mL,2×106 cells/mL,4×105 cells/mL,8×104 cells/mL,1.6×104 cells/mL,and 3.2×103 cells/mL. Growth differences were detected after a 48 h incubation period. FLC:Fluconazole; KTC: Ketoconazole; MCZ: Miconazole; AmB: Amphotericin B; BFA: Brefeldin A; HU: Hydroxyurea; CFW: Calcofluor white |
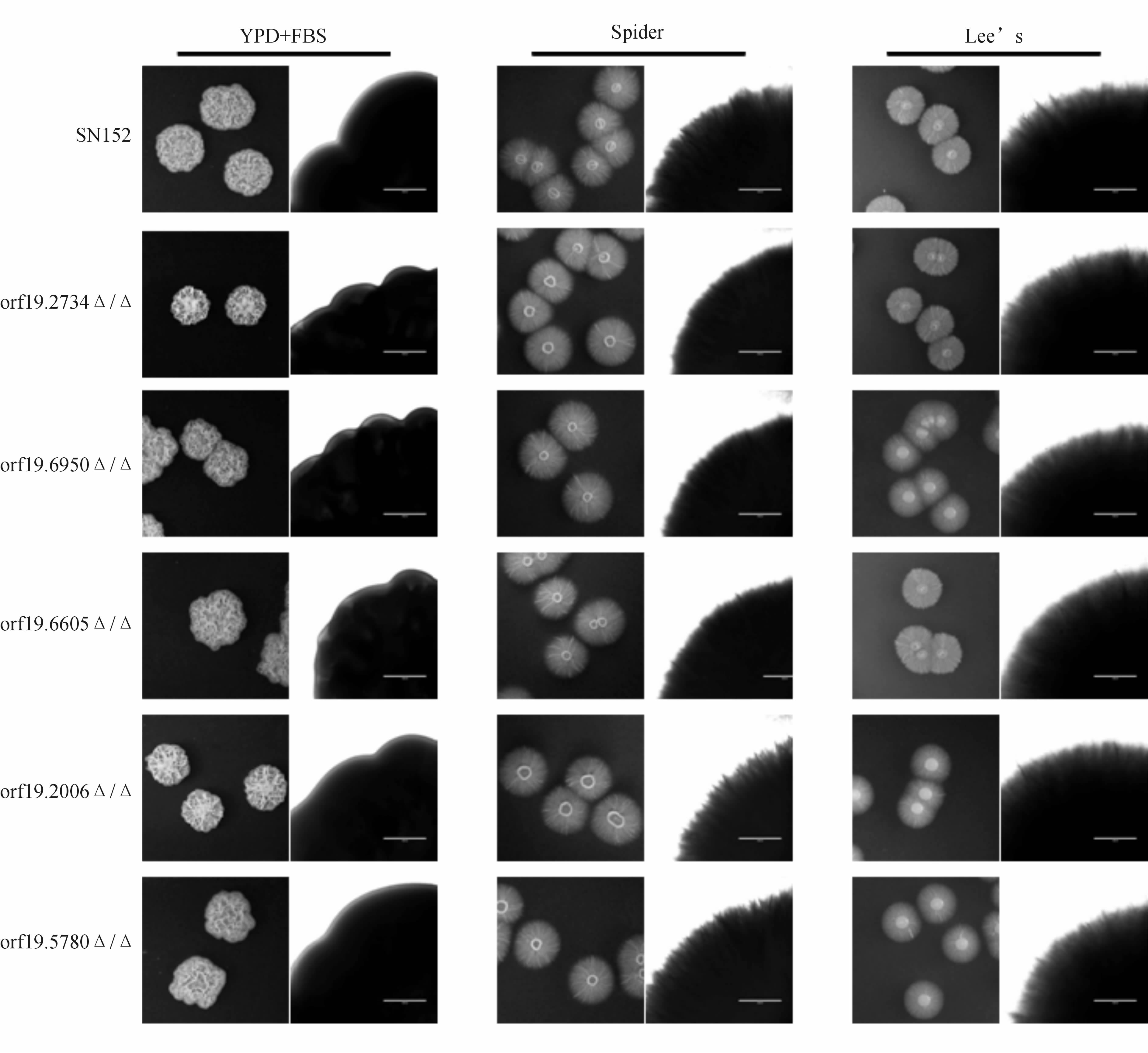
结果如图 4所示,与野生菌SN152相比,各基因敲除菌在固体10%FBS的YPD、Spider、Lee’s 培养基上都能形成表面皱缩的菌落,菌落边缘有密集细长的菌丝。敲除菌 orf19.2734 Δ/Δ因本身生长速率较野生菌株慢,固体菌落相对其他菌略小。在液体培养液中,各基因敲除菌均能形成菌丝,与野生菌SN152相当(图 5)。结果提示,各基因不影响白假丝酵母菌菌丝形成。
|
图 4 野生菌SN152与各基因缺失菌在固体菌丝诱导培养基上菌丝形成能力 Fig 4 Filamentous growth of C. albicans with wild-type SN152,orf19.2734Δ/Δ,orf19.6950Δ/Δ,orf19.6605Δ/Δ,orf19.2006Δ/Δ,and orf19.5780Δ/Δ mutants on solid yeast extract peptone dextrose (YPD) C. albicans with wild-type SN152,orf19.2734Δ/Δ,orf19.6950Δ/Δ,orf19.6605Δ/Δ,orf19.2006Δ/Δ,and orf19.5780Δ/Δ were grown on solid YPD plus 10% fetal bovine serum,Spider medium at 37℃ for 5 days,Lee’s medium at 25℃ for 10 days,and then photographed. Bar=1 000μm. |

|
图 5 野生菌SN152与各基因缺失菌在液体菌丝诱导培养液中菌丝形成能力 Fig 5 Filamentous growth of C. albicans with wild-type SN152,orf19.2734Δ/Δ,orf19.6950Δ/Δ,orf19.6605Δ/Δ,orf19.2006Δ/Δ,and orf19.5780Δ/Δ mutants in liquid yeast extract peptone dextrose (YPD) C. albicans with wild-type SN152 and the mutants were grown in liquid YPD plus 10% fetal bovine serum,Spider,and Lee’s media at 37℃ for 3 h,and then photographed. Bar=100μm. |
考察各基因缺失菌液泡形态的结果显示,各基因缺失菌经FM4-64染色后,都能在激光共聚焦显微镜下观察到完整的液泡形态,液泡轮廓清楚,境界清晰,提示 ORF19.27342、 ORF19.6950、 ORF19.6605、 ORF19.2006、 ORF19.5780 基因并不改变液泡形态(图 6)。

|
图 6 激光共聚焦显微镜观察各菌株液泡形态 Fig 6 Fluorescence photomicrographs of vacuole morphology of C. albicans strains Vacuole morphology in yeast cells of C. albicans with wild-type SN152,the orf19.2734Δ/Δ,orf19.6950Δ/Δ,orf19.6605Δ/Δ,orf19.2006Δ/Δ,and orf19.5780Δ/Δ mutants were stained with FM4-64 to label vacuoles and chased in yeast extract peptone dextrose medium for 2 h at 30℃. Cells were then observed by bright field (BF) microscopy and uorescence microscopy at excitation wavelength 558 nm and emission wavelength 734 nm for FM4-64. |
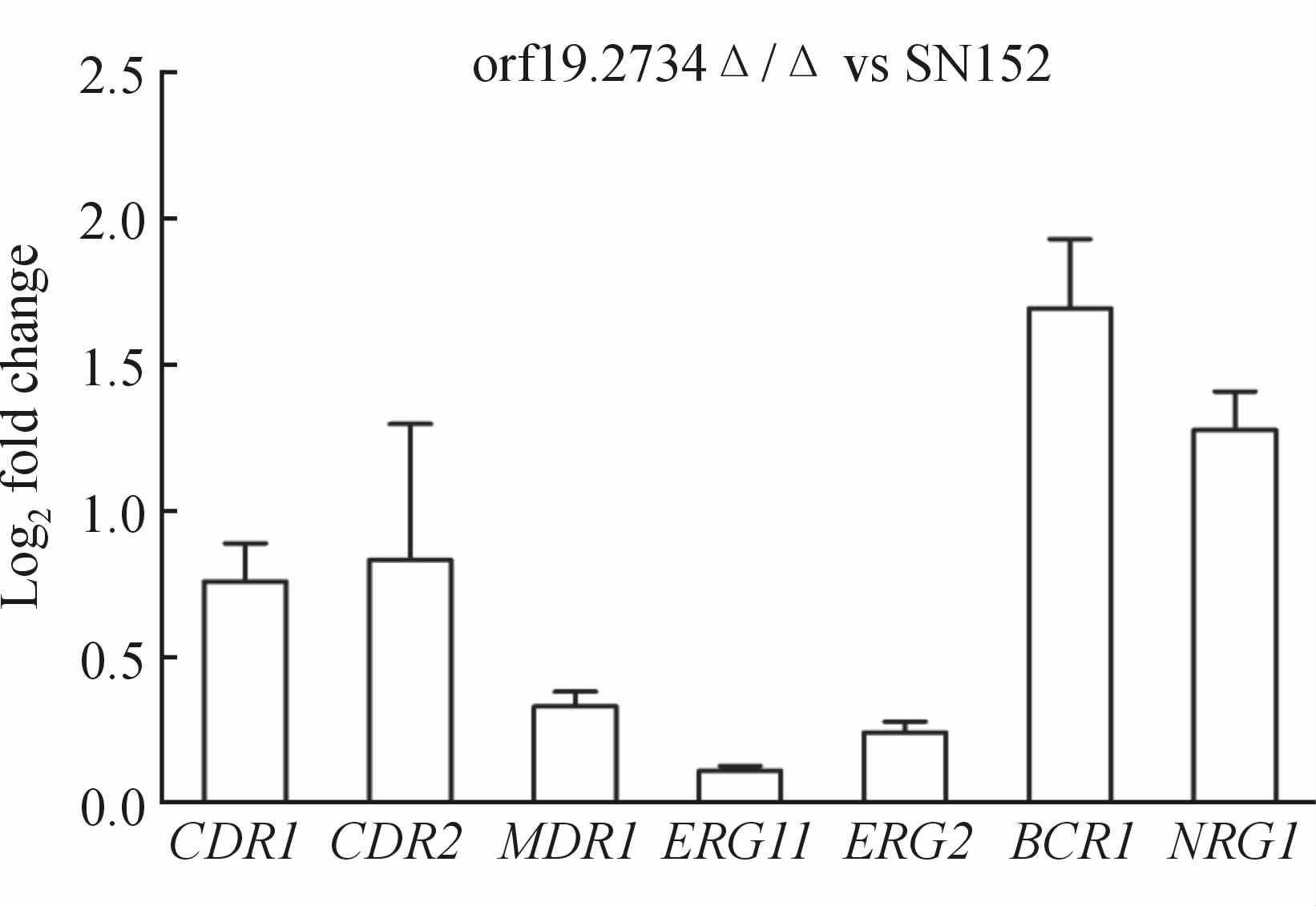
结果如图 7所示,在不加酮康唑药物作用下,orf19.2734Δ/Δ菌株与野生菌SN152相比 MDR1、 ERG11、 ERG2 基因表达水平下调;加入酮康唑(2 μg/mL)刺激2 h后,如图 7、图 8所示orf19.2734Δ/Δ菌株与野生菌SN152各基因表达水平与加药前无明显差异;结果说明 ORF19.2734 基因缺失菌可能通过下调 MDR1、 ERG11、 ERG2 基因,增加胞内药物浓度、降低Erg11p活性,从而提高对酮康唑的敏感性。
|
图 7 RT-PCR比较orf19. 2734Δ/Δ菌株和野生菌SN152基因表达量差异
Fig 7 RT-PCR analysis of the selected genes in orf19. 2734Δ/Δ and wild-type SN152 strains
n=3,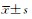
|
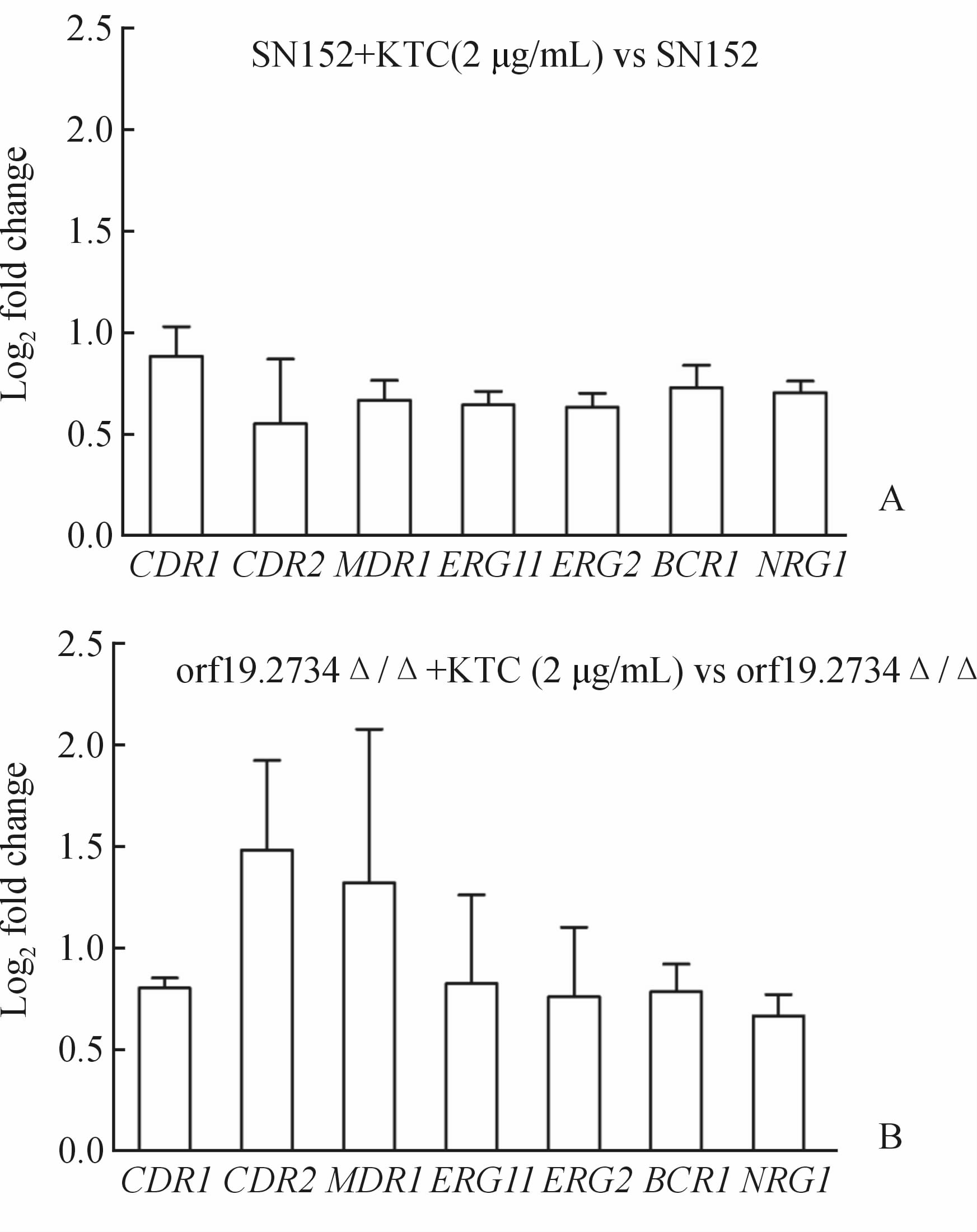
|
图 8 RT-PCR分别比较药物处理前后野生菌SN152(A)和orf19.2734Δ/Δ菌株(B)基因表达量差异
Fig 8 RT-PCR analysis of selected genes in the wild-type SN152 (A) and orf19.2734Δ/Δ strains (B)before and after treatmentn=3,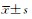
|
本研究通过同源重组的方法成功构建 ORF19.2734、 ORF19.6950、 ORF19.6605、 ORF19.2006、 ORF19.5780 等5个白假丝酵母菌液泡相关的未知功能基因的基因缺失菌,并考察了各基因缺失菌酵母态及菌丝态生长情况,以及对各种刺激的敏感性等表型。研究发现 ORF19.2734 缺失后酵母态细胞生长速率减缓,对唑类、布雷菲尔德菌素药物的敏感性增加,而对两性霉素B敏感性降低。较野生菌SN152,其他各基因缺失菌酵母态及菌丝态生长、对各种刺激敏感性均未见明显差异。Palmer等[1,2]实验发现液泡相关 VPS11 基因缺失后会破坏液泡形态,而液泡在维持细胞酵母态、菌丝态、假菌丝态的形态转换和介导包吞作用方面有重要意义。所以本实验考察了各基因缺失菌的液泡形态。尽管CGD数据库预测上述基因可能与液泡功能相关,但本研究结果显示,上述各基因缺失菌的液泡形态未见明显变化,提示上述基因不改变液泡形态。
麦角甾醇是念珠菌细胞膜的主要甾醇,对细胞膜的流动性、完整性、通透性,维护多种细胞膜结合酶功能发挥都具有重要作用。唑类药物是麦角甾醇的生物合成抑制剂,阻断麦角甾醇的合成过程,导致细胞膜通透性改变,从而发挥抗真菌活性。目前发现的唑类抗真菌药物耐药机制包括唑类药物靶酶表达量的升高[9]、外排相关基因的过表达[10]、生物被膜形成[11]等。唑类药物是目前临床上使用最普遍的抗真菌药物,但由于其仅具有抑菌作用,长期或大量应用极易促使耐药菌株的产生,因此研究真菌细胞耐药分子机制,有助于为临床克服耐药性产生提供依据。白假丝酵母菌对唑类耐受的机制之一是通过高表达靶酶Erg11p,使麦角甾醇生物合成受抑制程度减弱,进而使麦角甾醇含量增加[12]。Liu等[13]实验表明,药物外转运相关基因 MDR1、 CDR1、 CDR2 也在唑类药物刺激下表达上调,促进药物从胞内泵出胞外,使细胞内药物浓度降低,导致真菌产生耐药; ERG2 基因也被证实与麦角甾醇合成通路相关; NRG1、 BCR1 是菌丝负调控转录因子。由于 ORF19.2734 基因缺失菌株对酮康唑敏感,因此我们考察了 ORF19.2734 基因缺失菌在酮康唑作用后上述基因的表达水平。本研究发现 ORF19.2734 基因缺失菌对酮康唑敏感性升高,并采用RT-PCR的方法考察了 ORF19.2734 基因缺失菌的唑类药物靶酶Erg11p,外排相关基因 CDR1、CDR2、MDR1 ,以及耐药相关基因 ERG2 的表达量。结果显示,ORF19.2734 基因缺失菌与亲本菌相比,MDR1、ERG11、ERG2 基因表达量降低。推测 ORF19.2734 基因可能通过下调 MDR1、 ERG11、 ERG2 基因,增加胞内药物浓度、降低Erg11p活性,从而提高对酮康唑的敏感性,ORF19.2734 基因可能是抗白假丝酵母菌耐药性产生的潜在靶点,值得进一步研究该基因功能。
液泡主要通过提高白假丝酵母菌对压力的耐受能力及诱导菌丝生长等方面帮助白假丝酵母菌发挥其致病性[1,2]。Zhang等[14]研究发现,液泡通过V-ATPase活性调节白假丝酵母菌细胞内pH值,pH值升高可以降低白假丝酵母菌形成菌丝的能力,从而降低毒力;唑类药物如氟康唑可以减少细胞的麦角甾醇合成,升高液泡内的pH值。这是目前特别重视的一个唑类药物耐药途径,相关的研究还不是十分深入。Zhang等[14]还发现敲除编码V-ATPase这一稳定细胞内环境pH酶的亚基的基因,细胞可以表现出与麦角甾醇合成受限的菌株类似的表型,揭示了液泡参与白假丝酵母菌对唑类药物的耐受。因此,进一步筛选和研究液泡功能相关基因,可能发现白假丝酵母菌新的耐药机制。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Palmer G E.Vacuolar trafficking and Candida albicans pathogenesis[J].Commun Integr Biol, 2011, 4:240-242. |
| [2] | Palmer G E, Kelly M N, Sturtevant J E.The Candida albicans vacuole is required for differentiation and efficient macrophage killing[J].Eukaryot Cell, 2005, 4:1677-1686. |
| [3] | Noble S M, Johnson A D.Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans[J].Eukaryot Cell, 2005, 4:298-309. |
| [4] | Reuss O, Vik A, Kolter R, Morschhäuser J.The SAT1 flipper, an optimized tool for gene disruption in Candida albicans[J].Gene, 2004, 341:119-127. |
| [5] | Sherman F.Getting started with yeast[J].Methods Enzymol, 1991, 194:3-21. |
| [6] | Lee K L, Buckley H R, Campbell C C.An amino acid liquid synthetic medium for the development of mycelial and yeast forms of Candida albicans[J].Sabouraudia, 1975, 13:148-153. |
| [7] | Liu H, Kähler J, Fink G R.Suppression of hyphal formation in Candida albicans by mutation of a STE12 homolog[J].Science, 1994, 266:1723-1726. |
| [8] | Chapa-Y-Lazo B, Lee S, Regan H, Sudbery P.The mating projections of Saccharomyces cerevisiae and Candida albicans show key characteristics of hyphal growth[J].Fungal Biol, 2011, 115:547-556. |
| [9] | Feng L J, Wan Z, Wang X H, Li R Y, Liu W.Relationship between antifungal resistance of fluconazole resistant Candida albicans and mutations in ERG11 gene[J].Chin Med J (Engl), 2010, 123:544-548. |
| [10] | Basso L R Jr, Gast C E, Mao Y, Wong B.Fluconazole transport into Candida albicans secretory vesicles by the membrane proteins Cdr1p, Cdr2p, and Mdr1p[J].Eukaryot Cell, 2010, 9:960-970. |
| [11] | Tobudic S, Lassnigg A, Kratzer C, Graninger W, Presterl E.Antifungal activity of amphotericin B, caspofungin and posaconazole on Candida albicans biofilms in intermediate and mature development phases[J].Mycoses, 2010, 53:208-214. |
| [12] | Jacquier N, Schneiter R.Mechanisms of sterol uptake and transport in yeast[J].J Steroid Biochem Mol Biol, 2012, 129:70-78. |
| [13] | Liu T T, Lee R E, Barker K S, Lee R E, Wei L, Homayouni R, et al.Genome-wide expression profiling of the response to azole, polyene, echinocandin, and pyrimidine antifungal agents in Candida albicans[J].Antimicrob Agents Chemother, 2005, 49:2226-2236. |
| [14] | Zhang Y Q, Gamarra S, Garcia-Effron G, Park S, Perlin D S, Rao R.Requirement for ergosterol in V-ATPase function underlies antifungal activity of azole drugs[J].PLoS Pathog, 2010, 6:e1000939. |
 2014, Vol. 35
2014, Vol. 35


