2. 北方医院感染科, 西安 710043;
3. 深圳创新中药及天然药物联合研究实验室, 深圳 518057
2. Department of Infectious Diseases, Northern Hospital, Xi'an 710043, Shaanxi, China;
3. Joint Lab for New Drug Research of TCM and Natural Medicine of Shenzhen, Shenzhen 518057, Guangdong, China
川芎味辛性温,入肝、胆、心包经,有活血化瘀、行气止痛、祛风通络之功,香附具有行气疏肝、调经止痛之功,二者配伍可气血并调、理气解郁、活血止痛[1]。药理学研究发现,川芎配伍香附后可不同程度减少痛经模型小鼠的扭体次数,延长扭体潜伏期[2] ,降低大鼠的全血黏度[3];此外还可治疗植物神经功能紊乱、血管舒缩障碍导致的偏头痛[4]。阿魏酸(ferulic acid,FA)为川芎行气止痛的主要成分,具有一定的促血管新生、降压、抗脑缺血、抗缺血性心肌再灌注损伤、镇痛、缓解血管痉挛等作用[5,6]。
川芎和香附配伍前后醇提液中FA含量变化已有报道[7],但是香附对川芎中FA在正常及偏头痛模型大鼠体内的药代动力学影响还未见文献报道。本文采用高效液相色谱法(HPLC)研究正常及偏头痛模型大鼠体内川芎-香附配伍后香附对川芎中FA的药代动力学影响,为临床应用提供依据。
1 材料和方法 1.1 仪器
Agilent1100系列高效液相色谱仪(美国安捷伦公司);BP221S电子分析天平(德国赛多利斯公司);KQ5200DE型数控超声波清洗仪(昆山市超声仪器有限公司);电子调温电热套98-1-N型(天津市泰斯特仪器有限公司);SENCO型旋转蒸发器(上海申生科技有限公司);TGL-16G高速离心机(上海安亭科学仪器公司)。
1.2 药品与试剂
川芎、香附药材(购于西安市万寿路药材市场,由西北大学房敏峰教授鉴定);FA对照品(中国食品药品检定研究院,批号:110773-200611);肝素钠注射液(河北常山生化药业有限公司,批号:100109);色谱级甲醇(美国斯百全公司);实验用水为超纯水;其他试剂均为分析纯。
1.3 实验动物SPF级雄性SD大鼠(购自西安交通大学实验动物中心,合格证号:陕医动证字2006105),5个月龄,体质量200~230 g。
1.4 川芎及川芎-香附合煎液的制备称取干燥至恒质量的川芎药材粗粉(过40目筛)100 g,置于2 000 mL圆底烧瓶中,10倍量水浸泡1 h后,加热回流提取3次(2 h、2 h、1 h),合并提取液,减压浓缩至50 mL(生药量以川芎计2.0 g/mL),4℃冷藏备用。按川芎与香附1∶1配比,同法制备川芎-香附合煎液。川芎和川芎-香附合煎液用双蒸水稀释100倍,过0.45 μm水系微孔滤膜,按1.7.1项下条件分析FA的含量分别为2.10 mg/mL和2.29 mg/mL。
1.5 硝酸甘油偏头痛模型大鼠的制备取健康SD大鼠皮下注射硝酸甘油注射剂(10 mg/kg)制作偏头痛模型[8,9,10,11,12],于造模后3 min左右与正常组动物比较,模型组动物出现明显的双耳发红、前肢挠头、爬笼次数增多、烦躁不安等现象,此现象在5 h后消失。
1.6 动物分组及药代动力学实验取正常SD大鼠24只,随机分为正常川芎组、正常川芎-香附组,模型川芎组、模型川芎-香附组,每组6只。模型组大鼠自由饮水,禁食12 h后按1.5项下条件操作制作偏头痛病理模型。4组动物分别灌服对应的药材提取液(均以FA计,按20 mg/kg剂量给药),并分别于给药后0、2、5、10、15、30、45、60、120、180、300、480 min从大鼠眼底静脉丛取血0.5 mL,置肝素化离心管中8 000×g离心10 min,吸取上清液,置于-20℃保存。各时间点取完血后腹腔注射0.5 mL生理盐水以补充血容量。
1.7 FA血药浓度的测定 1.7.1 色谱条件色谱柱:Agilent TC-C18(4.6 mm×150 mm,5 μm); 流动相:0.2 %甲酸水(A)-甲醇(B),梯度洗脱(0~28 min,10~30% B;28~68 min,30~70% B;68~72 min,70% B);检测波长:322 nm;柱温:30℃;流速:0.6 mL/min;进样量:50 μL。
1.7.2 对照品溶液的制备精密称取FA对照品3.8 mg,置于10 mL棕色容量瓶中,用甲醇定容,制得浓度为0.38 mg/mL FA对照品储备液,4℃冷藏备用。
1.7.3 血浆样品的前处理取1.6项下血浆0.2 mL,加入20 μL 10%高氯酸水溶液沉淀蛋白,涡旋2 min,加入0.6 mL乙酸乙酯,涡旋2 min,8 000×g离心10 min,移取全部乙酸乙酯层(上层),再用相同体积的乙酸乙酯重复萃取2次,合并3次乙酸乙酯萃取液,室温下氮气保护吹干,残渣用甲醇∶0.2%甲酸水=20∶80超声溶解,过0.22 μm微孔有机滤膜,取续滤液进样分析。
1.8 方法学考察 1.8.1 专属性、线性关系及检测限分别取空白血浆供试品溶液和空白血浆+对照品供试品溶液在1.7.1项色谱条件下进样分析,考察方法的专属性。在200 μL空白血浆中加入用甲醇稀释的系列浓度FA对照品溶液各20 μL,配制成FA浓度分别为0.38、0.76、1.52、3.80、5.70、7.60、9.50 mg/L的系列空白血浆+标品供试品溶液,按1.7.3项下方法处理,在1.7.1项液相条件下进样分析,以浓度(X,mg/L)为横坐标、以峰面积(Y)为纵坐标,绘制标准曲线;同时以逐步稀释法确定检测限。
1.8.2 精密度和回收率取空白血浆,分别加入适量的FA对照品溶液,得到0.38、3.8、9.5 mg/L空白血浆+对照品溶液,每个浓度6份;同时配制相同浓度的以水为基质的对照品溶液,按照1.7.3项下方法处理,按1.7.1项液相条件下进样分析,同一样品在1 d内重复进样6次,6 d内连续测定6次,求得3个浓度的日内和日间精密度。以血浆中FA与水溶液中FA的含量之比计算提取回收率。
1.8.3 稳定性本实验分别考察了冻融周期、温度及贮存时间对样品稳定性的影响。
冻融稳定性: 将在-20℃的条件下冷冻24 h的0.38、3.8、9.5 mg/L的空白血浆+FA对照品样品取出,于室温下解冻,在1.7.1项色谱条件下,进样分析,记录峰面积,根据标准曲线计算FA的浓度。完全解冻后样品再次冷冻24 h,重复6次。
短期稳定性:将0.38、3.8、9.5 mg/L的空白血浆+FA对照品样品,室温下放置2、4、6、8、12、24 h,按1.7.3项下样品制备方法对血样进行前处理,在1.7.1项色谱条件下进样分析。
长期稳定性:将0.38、3.8、9.5 mg/L的空白血浆+FA对照品样品置于-20℃冷冻保存,分别于冻存1、2、4、8周后取出,置于室温下解冻,按1.7.3项下方法处理样品,在1.7.1项色谱条件下进样分析。
1.9 统计学处理采用SPSS 16.0软件和t检验对川芎组和川芎-香附组大鼠的药代动力学参数进行统计学分析,所得结果用 ±s 表示,检验水准(α)为0.05。血药浓度数据用DAS 2.0软件处理得到药代动力学参数。
2 结 果 2.1 HPLC方法学考察结果 2.1.1 专属性及检测限
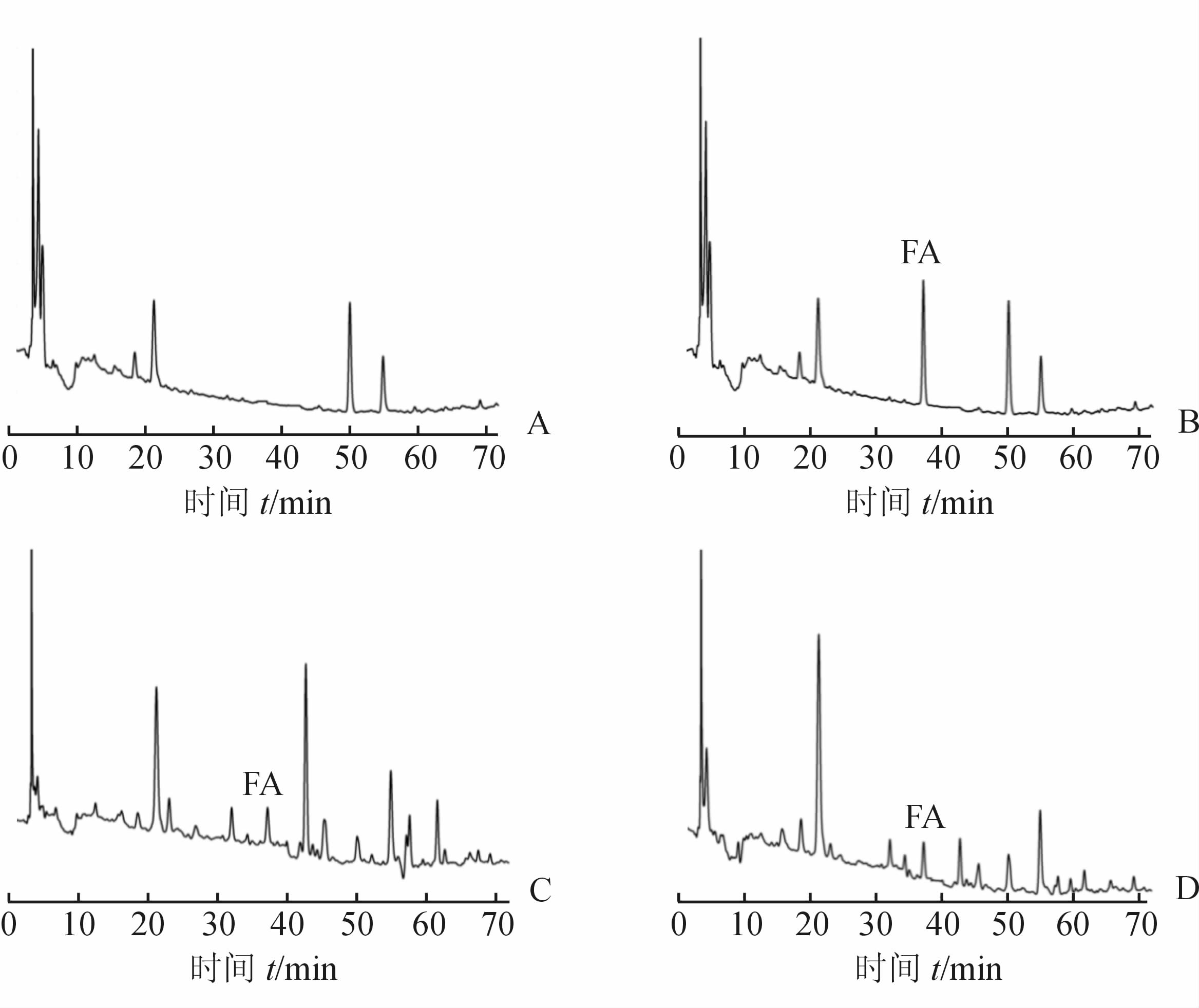
图 1为空白血浆、空白血浆+FA对照品溶液及含药血浆色谱图。结果显示,空白血浆中的内源性物质与FA分离良好,不影响FA的检测,且基线较平稳,噪音小。在拟定色谱条件下FA的检测限为0.13 mg/L(S/N=3),定量限为0.30 mg/L(S/N=10)。符合血浆样品测定要求。
|
图 1 HPLC法测定阿魏酸(FA)血药浓度色谱图 A:空白血浆;B:空白血浆+FA对照品溶液;C: 正常大鼠灌胃川芎提取液后血浆;D:正常大鼠灌胃川芎-香附提取液后血浆 |
线性方程为:Y=18.692 X-0.374 3,r=0.999 8(n=6),表明血样中FA在浓度为0.38~9.50 mg/L范围内具有良好的线性关系。
2.1.3 精密度和回收率求得3个浓度提取回收率为(95.45±2.57)%、(93.24±2.66)%、(89.93±4.87)%。日内精密度RSD和日间精密度RSD分别为3.03%、2.89%、0.42%和3.13%、4.17%、0.74%。结果表明方法精密度和回收率良好,符合测定要求。
2.1.4 稳定性实验FA 3个浓度冻融稳定性结果分别为(91.67 ± 0.02)%、(95.6 ± 0.14)%、(97.61 ± 0.13)%;短期稳定性结果分别为(89.25±0.02)%、(85.93 ± 0.14)%、(94.88 ± 0.29)%;长期稳定性结果分别为(90.26 ± 0.03)、(86.05 ± 0.28)%、(92.21 ± 0.61)%。表明冻融稳定性、短期稳定性及长期稳定性均良好,符合测定要求。
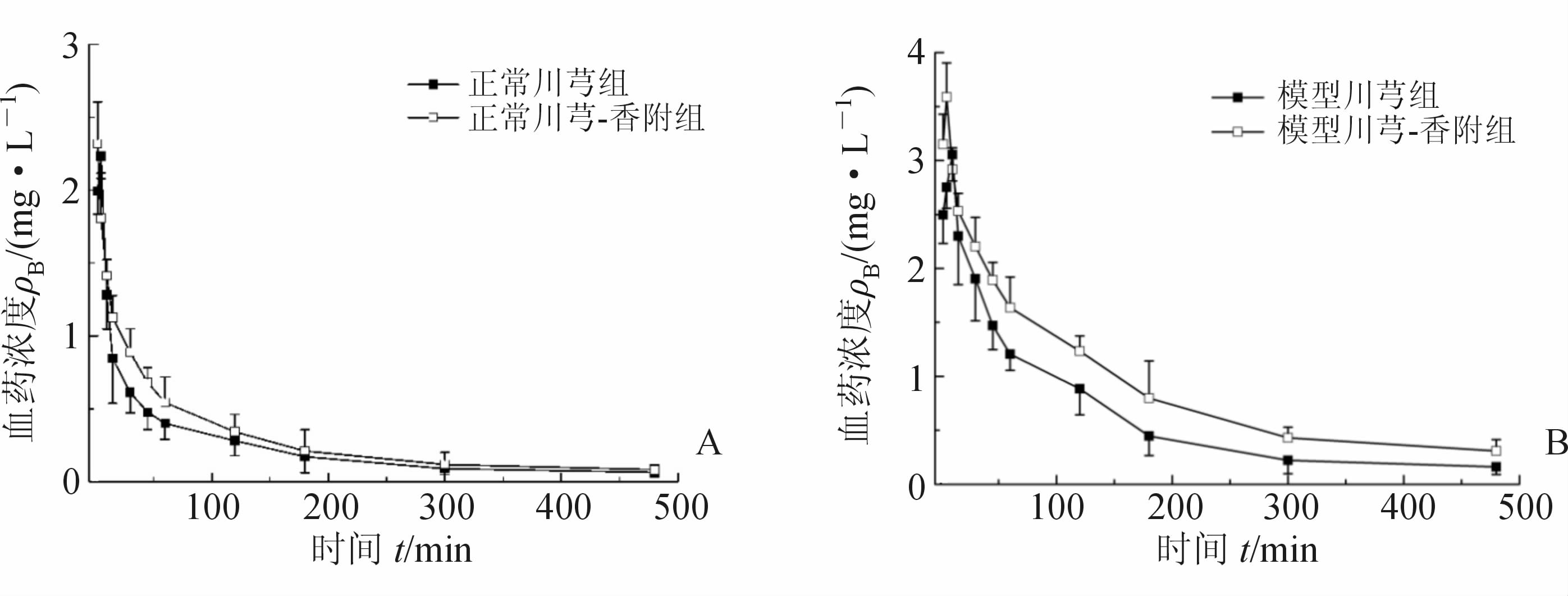
2.2 药代动力学实验结果血药浓度-时间曲线见图 2,FA的药代动力学参数见表 1。
|
图 2 阿魏酸在正常大鼠(A)和偏头痛模型大鼠(B)体内的血药浓度-时间曲线
n=6,
|
| 表 1 阿魏酸(FA)在正常及模型大鼠体内的药代动力学参数 |
可以看出,FA在正常大鼠和模型大鼠体内的代谢均呈现二室开放模型。与正常川芎组对比,正常川芎-香附组中FA的吸收半衰期(t1/2Ka)缩短(P<0.05),达峰时间提前(P<0.05),但其他参数与配伍前差异并无统计学意义。与模型川芎组比较,模型川芎-香附组中FA的达峰浓度(Cmax)、药物浓度-时间曲线下面积(AUC(0-t)、AUC(0-∞))、分布半衰期(t1/2α)、表观分布容积增大(P<0.01或P<0.05),达峰时间提前(P<0.05),清除率降低(P<0.01)。
3 讨 论 3.1 HPLC色谱条件的选择
本研究对FA的色谱条件进行了优化。考察了等度洗脱和梯度洗脱2种方式以及不同配比乙腈-水、甲醇-水、乙腈-甲酸水、甲醇-甲酸水等流动相系统。结果显示,采用甲醇-0.2%甲酸水溶液作为洗脱系统最佳,此条件下药材中的FA以及血浆中的内源性物质和代谢产物实现良好分离,基线平稳,FA色谱峰对称性良好,保留时间适宜。选择FA的最大吸收波长 322 nm为检测波长,响应值同等最高,保证了FA的检测灵敏度。
3.2 血浆样品前处理方法的选择对不同蛋白沉淀剂进行了筛选,先后比较了3倍于血浆量的乙腈、甲醇、乙醇,以及0.1倍于血浆量的10%高氯酸、10%三氯乙酸等试剂沉淀蛋白的效果,最终确定血样前处理方法为0.1倍于血浆量的10% 高氯酸沉淀蛋白,3倍于血浆量的乙酸乙酯萃取3次,此方法能使0.38、3.8、9.5 mg/L的空白血浆+FA对照品样品回收率均在85% 以上,满足生物样品检测要求。 3.3 药代动力学考察结果分析
对比正常组和模型组中FA的药代动力学数据可以发现,与正常组相比,模型组中FA的Cmax和AUC(0-t)均增大(P<0.01),Tmax均推迟(P<0.05)、CL/F下降(P<0.01),表观分布容积减小(P<0.05),说明在偏头痛病理条件下,香附能促进川芎中FA更多地吸收入血,机体对其吸收和清除变慢,使其在体内的停留时间和作用时间延长,从而能更好地发挥药效。本实验结果提示香附对川芎起到了协同增效作用,在病理状态下尤为显著。由于某些中药在某一证候存在的情况(机体处于特定病理状态)下才能体现其药效,仅在正常生理状态下进行中药成分的代谢研究则不能全面评价其药效,还必须考察病理状态下中药成分在体内的吸收、分布、生物转化、消除等药代动力学过程。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 刘庆林.川芎药对的临床应用解析[J].中医药学刊, 2004, 22:1730-1731. |
| [2] | 张斯杰, 郭建博, 王晓莉, 徐静华, 徐 晖, 刘东春.川芎-香附提取物对原发性痛经模型动物的作用[J].沈阳药科大学学报, 2013, 30:383-387. |
| [3] | 雍德卿, 冯孟林.黄芪、归尾、香附、川芎、赤芍等配伍对正常大鼠血液流变学的影响[J].山东医药工业, 2000, 19:29-30. |
| [4] | 程 敏.川芎-香附药对源流及功用初探[J].时珍国医国药, 2011, 22:1420-1421. |
| [5] | 胡益勇, 徐晓玉.阿魏酸的化学和药理研究进展[J].中成药, 2006, 28:253-255. |
| [6] | 王 筠, 袁 卓, 张军平.阿魏酸对人脐静脉血管内皮细胞ECV304的增殖作用[J].中医药学报, 2007, 35:4-6. |
| [7] | 张文娟, 徐 媛, 王庆伟.HPLC法分析川芎-香附配伍前后指标成分的变化[J].中国医药导报, 2011, 8:96-98. |
| [8] | 杨 胜, 张定堃, 苏柘僮, 徐佳丽, 杨金辉.川芎-白芷药对不同配比不同剂型对偏头痛动物模型的影响[J].中国实验方剂学杂志, 2011, 17:225-228. |
| [9] | 黄月芳, 楼招欢, 余 芳.天麻钩藤颗粒对硝酸甘油致偏头痛模型大鼠的影响[J].中华中医药杂志, 2012, 27:227-230. |
| [10] | 华 赞.ROCKⅡ、核因子-kappaB及COX-2在偏头痛模型大鼠脑干的表达变化[D].中南大学, 2009. |
| [11] | 付先军, 宋旭霞, 周永红, 胡怀强, 刘 伟, 王栋先, 等.硝酸甘油型实验性偏头痛大鼠模型行为症状学评价[J].中华神经医学杂志, 2005, 4:449-451. |
| [12] | Tassorelli C, Greco R, Wang D, Sandrini M, Sandrini G, Nappi G.Nitroglycerin induces hyperalgesia in rats—a time-course study[J].Eur J Pharmacol, 2003, 464(2-3):159-162. |
 2014, Vol. 35
2014, Vol. 35


