2. 南通大学附属海安医院肿瘤科, 南通 226600;
3. 南京医科大学附属无锡市人民医院肝胆外科, 无锡 214000;
4. 南京医科大学附属无锡市人民医院病理科, 无锡 214000
2. Department of Oncology, Haian Hospital of Nantong University, Nantong 226600, Jiangsu, China;
3. Department of Hepatobiliary Surgery, Wuxi People's Hospital, Nanjing Medical University, Wuxi 214000, Jiangsu, China;
4. Department of Pathology, Wuxi People's Hospital, Nanjing Medical University, Wuxi 214000, Jiangsu, China
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,尤其以亚太地区居多,严重危害人类健康[1]。深入研究肝细胞癌发生发展过程中重要的基因对肝癌细胞增殖、迁移等机制的影响,对疾病诊治具有重大意义。Shc1(Src homology 2 domain containing transforming protein 1)基因位于人类1号染色体2区1带,编码蛋白为p52ShcA、p46ShcA和p66ShcA(其中p66Shc在人肝组织中表达量极少),早年被认为具有参与抑制神经细胞凋亡及调节受体酪氨酸激酶通路等功能。随着对其研究的深入,人们发现Shc1基因在乳腺癌[2]、胃肠肿瘤细胞[3,4]、肺癌[5]等多种肿瘤细胞生长中具有重要作用。Shc1基因在肝癌中的研究刚刚起步,Yoshida等[6]发现p52ShcA、p46ShcA高表达于LEC(Long-Evans Cinnamon)大鼠肝细胞癌中,并且p46ShcA的酪氨酸磷酸化参与LEC大鼠慢性乙型肝炎发展为肝细胞癌的过程。目前对人肝细胞癌中Shc1的研究较少,本研究观察了人肝癌组织中Shc1的表达情况,分析其表达与临床特征之间的关系,并采用基因干扰的方法抑制肝癌SMMC-7721细胞的Shc1表达水平,观察其对肝癌细胞增殖、迁移等生物学特性的影响,探讨Shc1在人肝癌发生、发展中的作用。
1 材料和方法 1.1 病例资料收集2013年1月至2013年6月南京医科大学附属无锡市人民医院肝胆外科手术切除的肝癌及癌旁组织标本33例和相应的临床资料(性别、年龄、肿瘤大小、肿瘤数目、TNM分期、有无肝硬化、Child-Pugh分级、AFP、病理Edmondson分级、血管脉管侵犯癌栓等方面)。 所有标本的病理诊断均由3位以上高年资病理医师进行诊断核对。每例患者术前均未接受任何抗肿瘤治疗,采集癌组织及相应癌旁组织(距肿瘤边缘2 cm)各200 g,立即置于液氮中保存。所取标本均经患者本人及家属同意。
1.2 主要材料
人正常肝细胞HL-7702(以下简称L-02)及5种肝癌细胞MHCC-97L、MHCC-LM3、SMMC-7721、PLC/PRF/5及Hep-G2均为本实验室存储。DMEM高糖培养液购自Hyclone公司;无支原体优级胎牛血清购自杭州四季青公司;0.25%胰酶-EDTA、Opti-MEM无血清培养基购自Invitrogen公司;青霉素、链霉素溶液购自Hyclone公司;MTT试剂购自Biosharp公司;TRIzol试剂、Lipofectamine 2000、无核酶水购自Invitrogen公司,反转录试剂盒、SYBR○ R Premix EX TaqTMⅡ实时定量PCR试剂盒购自TaKaRa公司,Shc1、β-actin基因PCR引物(HPLC级制品)由TaKaRa公司设计、合成;Shc1抗体、GAPDH抗体购自R&D system公司;二抗羊抗鼠IgG购自康为公司;Shc1_siRNA购自GenePharma公司。
1.3 肝组织和肝细胞中Shc1基因、蛋白的检测将33例肝癌和33例癌旁组织各分成2份,分别用于实时定量PCR和蛋白质印迹检测。
1.3.1 实时定量PCR检测用TRIzol试剂提取总RNA,参照反转录试剂盒说明合成cDNA。人Shc1引物序列F: 5′-ATG GCC GCA GAC TGC AAA C-3′,R: 5′-GTC TTT GGC AAC ATA GGC GAC ATA C-3′;β-actin引物序列F:5′-AGA GCC TCG CCT TTG CCG ATC C-3′,R:5′- CTG GGC CTC GTC GCC CAC ATA-3′。参照SYBR○ R Premix EX TaqTM Ⅱ实时荧光定量PCR试剂盒使用说明,应用ABI-PCR仪行实时PCR反应,每个模板设3个复孔,取平均CT值,以2-ΔCT (ΔCT=CTShc1-CTβ-actin)表示Shc1基因的相对表达量。
1.3.2 蛋白质印迹检测RIPA裂解液提取上述各组织和细胞中的总蛋白,BCA法分别测其浓度,加4×上样缓冲液后100℃ 5 min煮沸。行SDS-PAGE后,湿转至硝酸纤维素膜,将膜用5%脱脂奶粉封闭2 h,加入Shc1一抗(1∶1 000,R&D system)、GAPDH一抗(1∶5 000,R&D system)于4℃共同孵育过夜,加入二抗(羊抗鼠抗体,1∶5 000,康为公司)室温孵育1 h,ECL增强发光,应用凝胶成像仪(Alphaimager HP)拍照,采集的曝光时间为4 s、8 s和16 s。在肝癌细胞中筛选出Shc1蛋白表达量最高的一种细胞进行基因干扰实验。
1.3.3 免疫组织化学检测33例肝癌和33例癌旁组织标本经10%中性甲醛溶液固定后常规组织处理,4 μm厚连续切片,采用免疫组化SP法进行免疫组化染色,严格参照试剂盒说明操作。一抗采用鼠抗人Shc1 抗体(1∶50,R&D system),二抗为生物素标记的羊抗鼠抗体(1∶1 000,北京中杉金桥生物技术有限公司)。染色时用已知阳性切片作阳性对照,用PBS代替一抗作阴性对照。结果判定以胞质内出现棕黄色颗粒为Shc1蛋白阳性,胞质内不出现黄色颗粒为阴性。图像采用Olympus显微照相系统采集。
1.4 细胞基因干扰Shc1的小干扰RNA(small interference RNA,siRNA)、阴性对照siRNA和荧光FAM-siRNA由GenePharma公司设计、合成。特异性Shc1-siRNA序列:sense 5′-CAC CUG ACC AUC AGU ACU ATT-3′,antisense 5′-UAG UAC UGA UGG UCA GGU GTT-3′。阴性对照siRNA序列:sense 5′-UUC UCC GAA CGU GUC ACG UTT-3′,antisense 5′-ACG UGA CAC GUU CGG AGA ATT-3′。FAM-siRNA序列:sense 5′-UUC UCC GAA CGU GUC ACG UTT-3′,antisense 5′-ACG UGA CAC GUU CGG AGA ATT-3′。FAM是一种绿色荧光基团,由蓝光激发,激发波长480 nm,发射波长520 nm,转染效率的高低可以通过荧光标记的siRNA(FAM-siRNA)实现。将细胞分为4组:空白组、对照组、干扰组、荧光组。肝癌细胞培养于含10%胎牛血清、1×108 U/L青霉素和100 mg/L链霉素的DMED培养液中,置于37℃、5%CO2的培养箱中培养,0.25%胰酶-EDTA消化传代。将细胞分别接种于6孔板中,每孔细胞密度为5×105/2 mL。利用Lipofectamine 2000将上述siRNA按每孔100 pmol分别添加至各组细胞中,空白组不转染。转染6 h后,使用倒置荧光显微镜观察转染效率,并拍照记录。转染24 h后通过实时定量PCR反应检测各组细胞Shc1基因的表达情况,用蛋白质印迹法检测各组细胞Shc1蛋白(p52ShcA、p46ShcA和p66ShcA)的表达情况。
1.5 细胞增殖与迁移能力的测定 1.5.1 细胞增殖测定将肝癌细胞以3 000/100 μL的密度接种于96孔板,设3个分组(空白组、干扰组、对照组),每组设8个复孔。采用MTT法连续8 d检测各组细胞的光密度(D450)值。以D450值为纵坐标、时间为横坐标绘制细胞生长曲线图。
1.5.2 细胞划痕愈合实验将肝癌细胞以5×105/2 mL的密度接种于6孔板(板的背面划横线,间隔1 cm一道,横穿过孔。每孔3条线),设3个分组(空白组、干扰组、对照组)。24 h后用200 μL黄吸头进行垂直于背面横线的划痕(每孔划痕3道,并与背面横线交叉,形成9个观察点)。PBS洗细胞3次,去除划下的细胞,加入无血清培养液。放入37℃、5%CO2培养箱中培养,在0、12、24 h取样,10倍镜下拍照。采用Image-Pro Plus 6.0软件计算划痕面积和长度,划痕距离=面积/长度,迁移距离=0 h距离-当前距离。
1.6 统计学处理利用Excel软件计算PCR结果,AlphaView SA软件计算各组蛋白条带的相对灰度值,使用GraphPad Prism-5.0软件对Shc1表达差异、siRNA干扰效率、细胞生长曲线、细胞划痕实验进行计算、分析、制图等,采用Image-Pro Plus 6.0分析计算细胞划痕愈合实验图片。采用SPSS 19.0软件进行统计学分析,计量资料以 ±s 表示,组间差异的比较采用t检验;计数资料以百分比表示,组间差异的比较采用Fisher精确法检验。检验水准(α)为0.05。
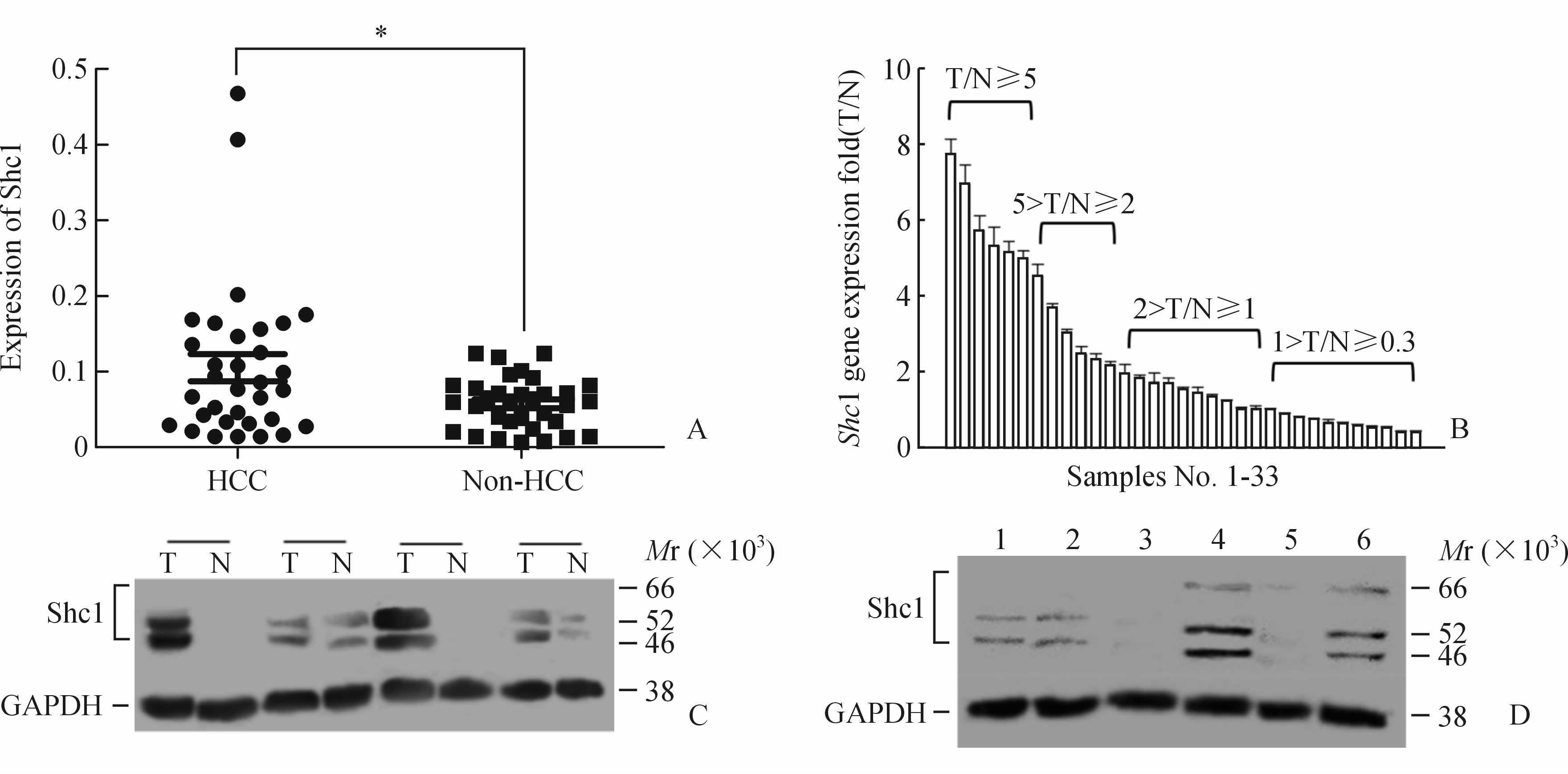
2 结 果 2.1 Shc1基因及其蛋白在人肝癌组织和癌旁组织中的表达实时定量PCR结果显示,33例肝癌组织中Shc1的表达(0.105±0.018)高于相应的癌旁组织(0.057±0.005,P<0.05),见图 1A;在33对标本中,22/33(66.7%)例Shc1基因上调(癌组织表达量/癌旁组织表达量≥1),其中12/33(36.4%)Shc1基因明显上调(癌组织表达量/癌旁组织表达量≥2),11/33(33.3%)Shc1基因存在轻度下调(癌组织表达量/癌旁组织表达量<1),见图 1B。蛋白质印迹结果显示,33例肝癌和相应的癌旁组织中,Shc1蛋白3个亚型(p52ShcA、p46ShcA和p66ShcA)中的p52ShcA、p46ShcA均有表达,未检测到p66ShcA在人肝组织中表达(图 1C),故本实验主要检测的是p52ShcA和p46ShcA的蛋白总量。将癌组织Shc1相对表达量/癌旁组织Shc1相对表达量≥1定义为Shc1阳性表达(+),癌组织Shc1相对表达量/癌旁组织Shc1相对表达量<1定义为Shc1阴性表达(-),则肝癌组织Shc1阳性率为66.7%(22/33)。
|
图 1 肝细胞癌标本及肝癌细胞系中Shc1的表达 Fig 1 Expression of Shc1 in hepatocellular carcinoma (HCC) specimens and cell lines A: The RNA levels of Shc1 in 33 HCCs specimens and adjacent tissue detected by RT-PCR. *P<0.05. B: Shc1 gene expression ratio of HCC(T)/adjacent tissue(N) to cancer. n=6, ±s . C: Expression of Shc1 protein(p52ShcA,p46ShcA and p66ShcA) in HCC(T) and adjacent tissue(N) from 4 random samples. D: Expression of Shc1 protein in normal liver cells and hepatoma cells. 1: HL-7702; 2: MHCC-97L; 3: MHCC-LM3; 4: SMMC-7721; 5: PLC/PRF/5; 6: Hep-G2 |
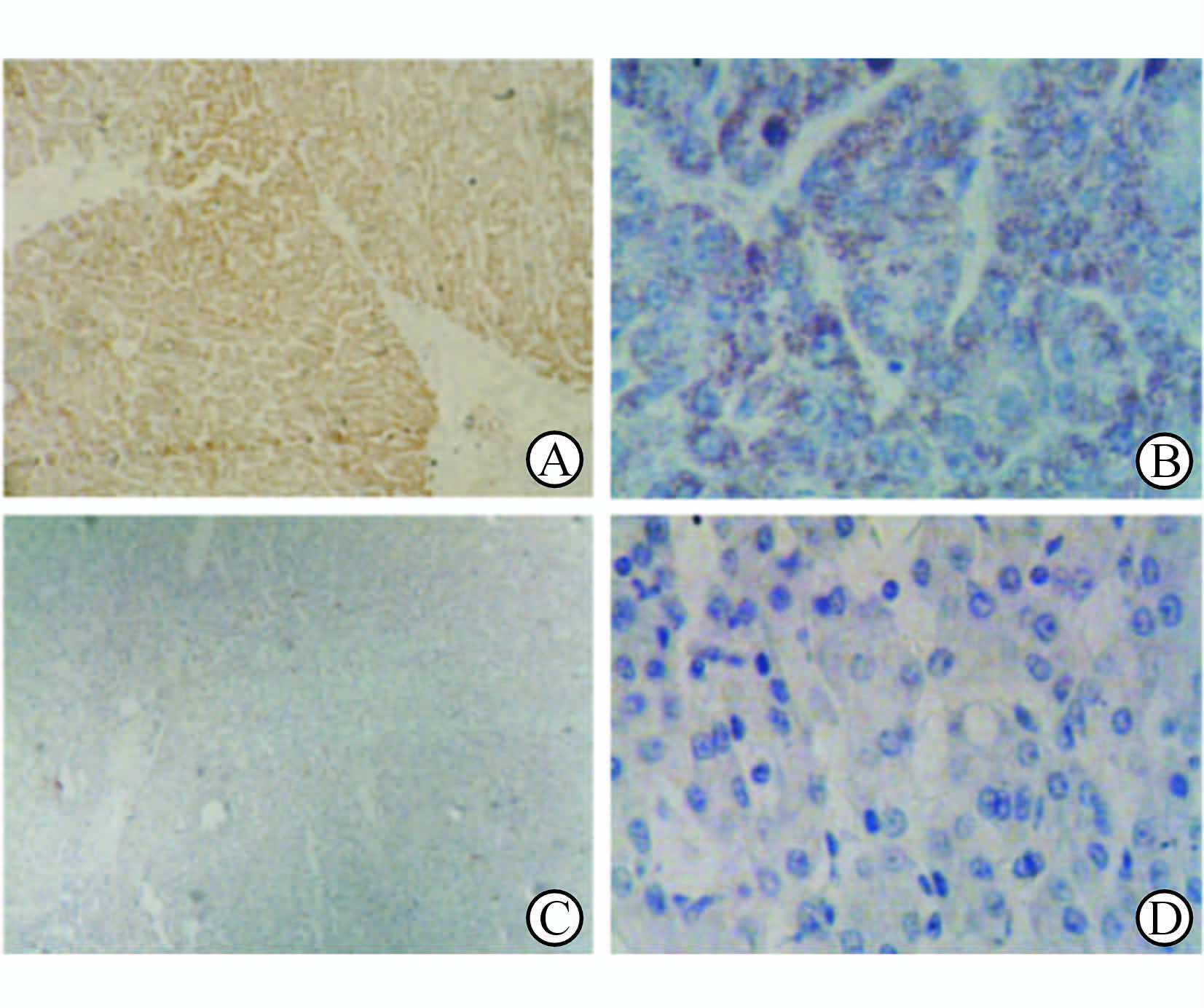
免疫组化结果显示,Shc1在肝细胞癌组织和癌旁组织中的表达阳性率分别为75.8%(25/33)、15.2%(5/33)。Shc1主要表达在肝细胞癌组织的胞质中,且明显强于癌旁组织 (图 2) 。
|
图 2 肝细胞癌(A,B)和癌旁组织(C,D) Shc1表达的免疫组化染色结果 Fig 2 Immunohistochemical staining of Shc1 protein expression in hepatocellular carcinoma(HCC,A,B)and adjacent tissues (Non-HCC,C,D) Original magnification: ×40 (A,C),×200 (B,D) |
将Shc1蛋白的表达情况(阳/阴性)与相应临床病理特征(性别、年龄、肿瘤大小、肿瘤数目、TNM分期、HBVAg、有无肝硬化、Child-Pugh分级、AFP、病理Edmondson分级、血管脉管主干的侵犯等)采用SPSS软件进行Fisher精确法计算P值。结果显示:33对样本中,无肝硬化的患者Shc1阳性率(100%)高于伴肝硬化的患者(54.2%),术前Child-Pugh分级A级的患者Shc1阳性率(75.9%)高于B级或C级的患者(0%),术前检测血中AFP阳性患者Shc1阳性率(79.2%)高于AFP阴性患者(33.3%),术后病理EdmondsonⅢ、Ⅳ级患者Shc1阳性率(84.2%)高于Ⅰ、Ⅱ级的患者(42.9%),且以上差异均有统计学意义(P<0.05)。Shc1蛋白阳性率与性别、年龄(≤55岁和>55岁)、肿瘤大小(<5 cm和≥5 μm)、肿瘤数目(单个和多个)、TNM分期(Ⅰ/Ⅱ和Ⅲ/Ⅳ)、HBVAg(阳性/阴性)、血管脉管主干的侵犯(有/无)差异无统计学意义(P>0.05)。见表 1。
| 表 1 Shc1蛋白表达情况与临床病理特征之间的关系 Tab 1 Relationship between Shc1 protein expression and clinical characteristics of hepatocellular carcinoma |
蛋白质印迹结果显示,在5种肝癌细胞及1种正常肝细胞中,SMMC-7721细胞中Shc1蛋白表达量(主要检测p52ShcA和p46ShcA的蛋白总量)高于其他4种肝癌细胞及正常人肝HL-7702细胞(图 1D)。遂采用SMMC-7721细胞行下一步细胞学增殖与迁移实验。
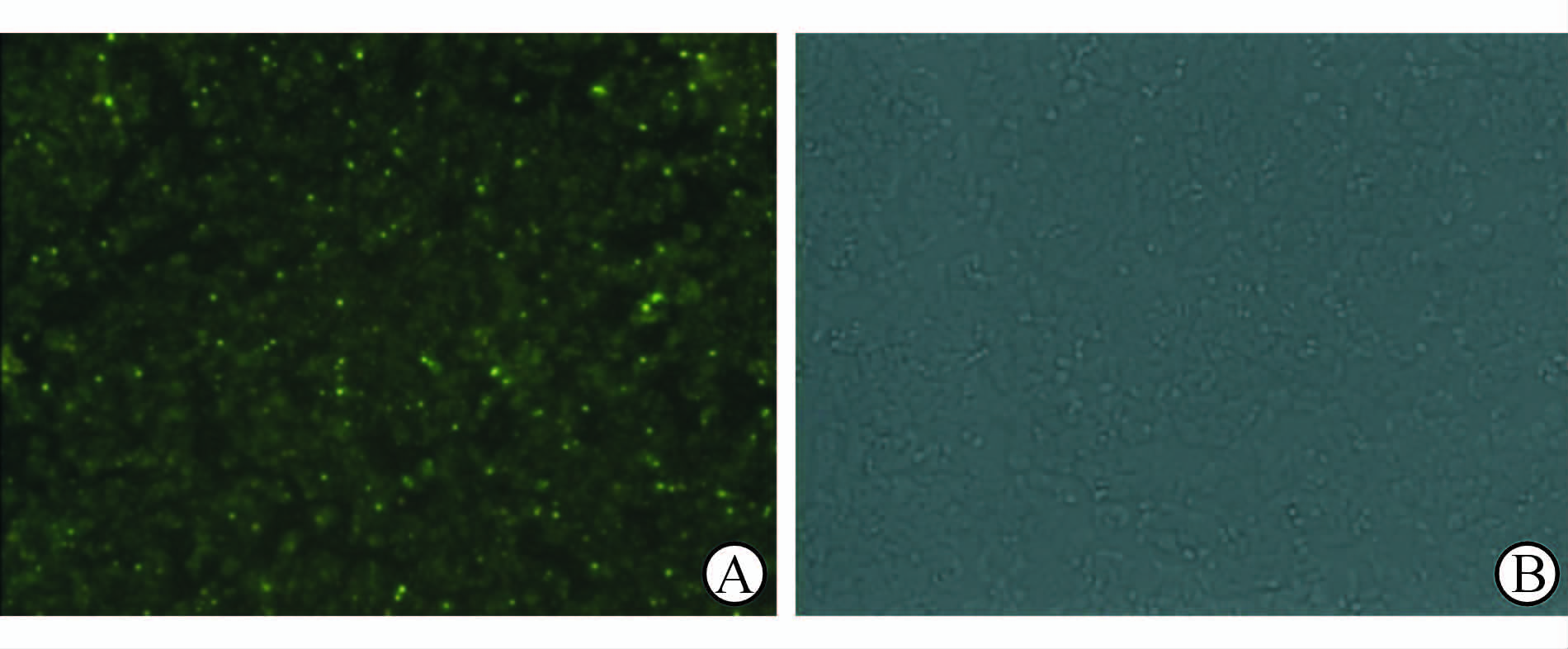
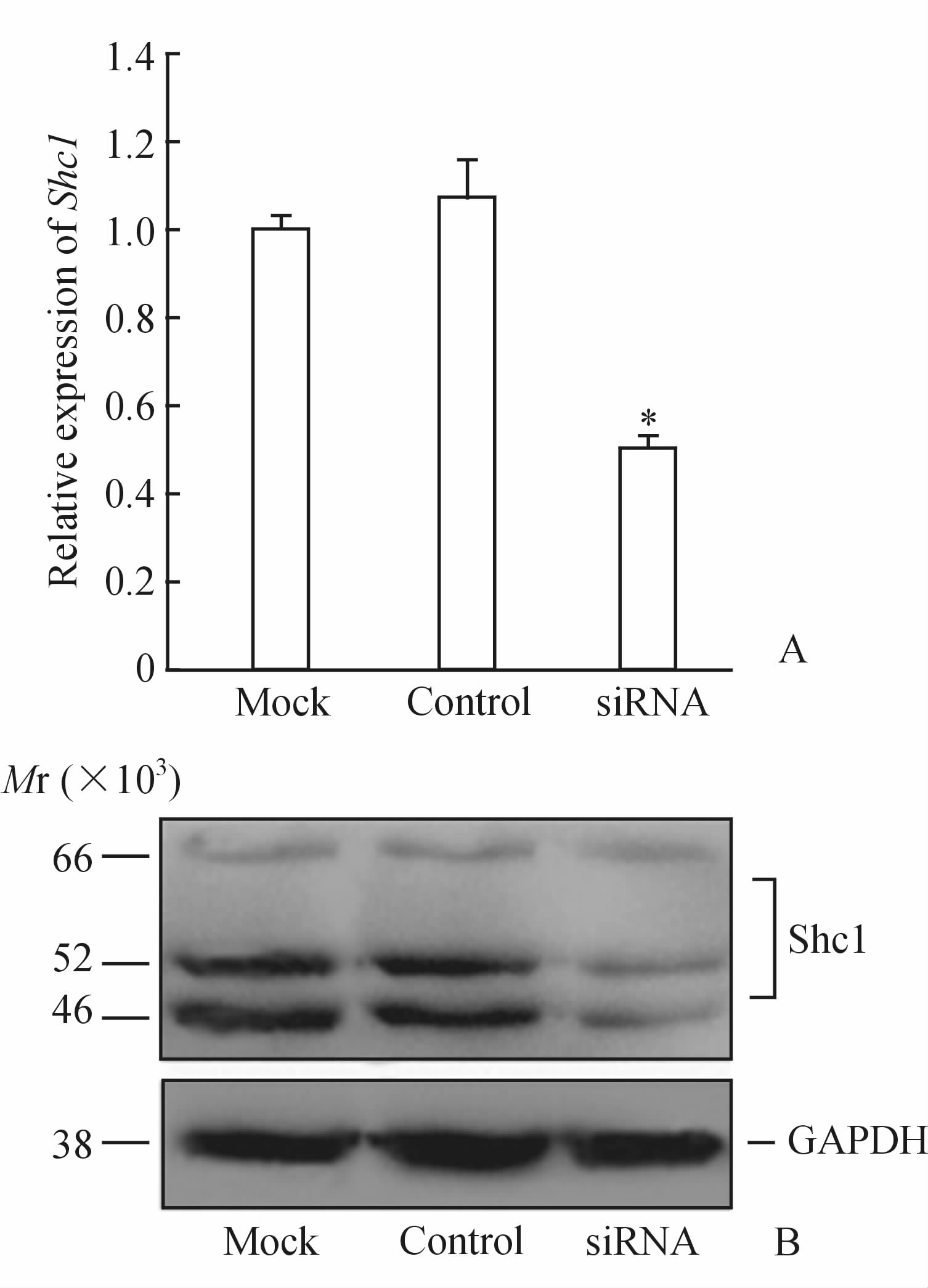
2.4 干扰肝癌细胞Shc1表达对细胞增殖和迁移的影响使用Lipofectamine 2000瞬时转染siRNA至SMMC-7721细胞中,6 h后观察荧光细胞转染效率,利用荧光显微镜自带计数软件进行分析,结果如图 3所示,转染效率为65%。转染24 h后通过荧光定量PCR检测3组细胞(空白组、对照组、干扰组) Shc1 的表达水平,结果显示,干扰组SMMC-7721细胞中 Shc1 的表达低于对照组,差异有统计学意义(P<0.05,图 4A);同时采用蛋白质印迹法验证了对照组与干扰组SMMC-7721细胞中Shc1蛋白的表达情况(图 4B)。上述结果说明采用siRNA成功干扰了SMMC-7721细胞中Shc1的表达。
|
图 3 转染6 h后观察荧光细胞转染效率 Fig 3Fluorescent cell transfection efficiency after 6 hours A:Fluorescence microscopy; B: Ordinary microscope. Original magnification:×100 |
|
图 4 转染24 h后各组细胞中 Shc1 基因(A)、蛋白(B)的表达情况 Fig 4 Expression of Sh1 gene (A) andprotein(B) in SMMC-7721 cells 24 h after transfection *P<0.05 vs control group; n=6, ±s |
采用MTT法测细胞生长曲线,结果显示,干扰Shc1的表达后,随着时间的延长,与对照组、空白组相比,SMMC-7721细胞的生长明显受到抑制(P<0.05),而空白组与对照组SMMC-7721细胞生长差异无统计学意义(P>0.05)。见图 5。

|
图 5 MTT法测细胞生长曲线 Fig 5 Cell growth curve by MTT method *P<0.05 vs blank group and control group; n=8, ±s |
细胞划痕实验结果显示,干扰Shc1的表达后12和24 h,SMMC-7721细胞的迁移距离比对照组、空白组减少,差异有统计学意义(P<0.05,图 6)。
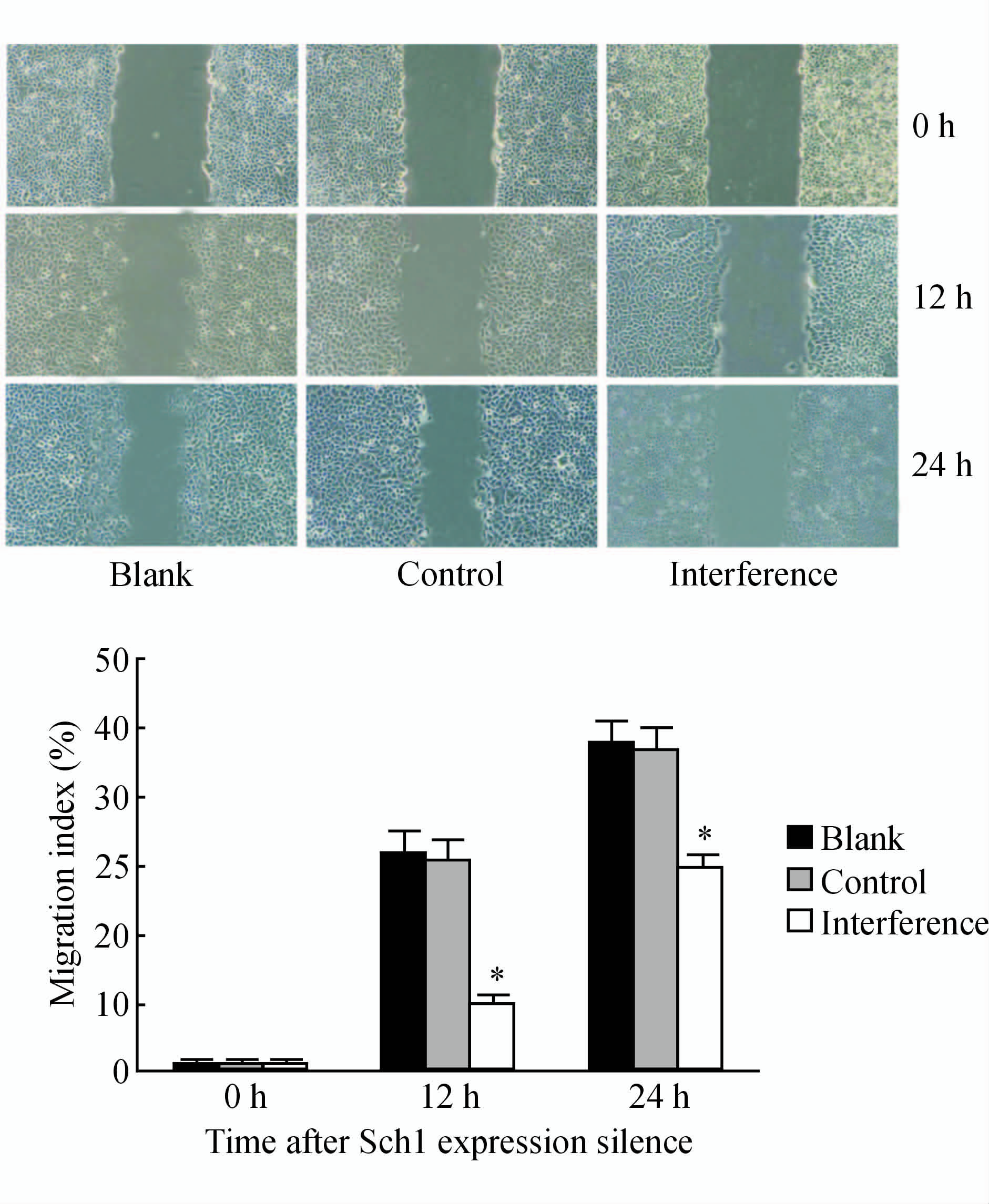
|
图 6 细胞划痕愈合实验结果 Fig 6 Cell wound healing assay *P<0.05 vs blank or control group; n=9, ±s |
Shc(Src homologue and collagen protein)基因家族包括Shc1(即ShcA)、Shc2 和Shc3(即N-Shc) 3个成员。其中Shc1编码3个分子:p52ShcA、p46ShcA和p66ShcA。Shc家族蛋白在结构上都具有特有结构域PTB-CH1-SH2,PTB(phosphotyrosine-binding)和SH2(Src homology 2)是两个磷酸酪氨酸结合区域,CH1(collagen-homology 1)含有酪氨酸磷酸化位点,是Shc蛋白信号输出的区域[7]。p46ShcA、p52ShcA作为典型的接头蛋白在传递受体型酪氨酸蛋白激酶信号中有重要作用,通过GRB2/SOS链接着激活受体酪氨酸激酶的Ras通路但其在肿瘤中的机制探索还需进一步研究[7]。p66Shc蛋白则参与氧化应激、细胞凋亡及衰老等过程的调控。例如,Koch等[8]发现p66shcA能降低酒精性肝病患者自体的抗氧化防御系统,促进肝病发展。Shc高表达于早期的神经组织[9] (主要包含神经干细胞和神经祖细胞),且通过抑制细胞凋亡保护神经细胞。Trinei等[10]指出,在外界氧应激引起的细胞凋亡过程中,p66ShcA被证明是p53的下游分子并对其介导的凋亡过程有着重要的作用。Shc1在老年大鼠的肝脏、大脑中选择性上调,提示Shc促进了正常细胞衰老过程[11]。
近年来,Shc过表达与癌变的关系逐渐引起人们的重视,其中以Shc1(即ShcA)最为突出。有研究者发现甲状腺癌细胞中存在高水平的Shc[12]。在成神经细胞瘤的研究中发现,敲除N-Shc后癌细胞的自发凋亡率明显增加,说明N-Shc在肿瘤中的过多表达抑制了肿瘤细胞的凋亡[7]。 Veeramani等[13] 发现,p66ShcA在肿瘤细胞中似乎具有促进增殖的作用。目前在肝细胞癌中Shc1的表达以及细胞学影响等方面的研究较少。
本研究发现,在人肝细胞癌组织中的Shc1基因明显高表达于癌旁组织(P<0.05),提示Shc1的高表达能促进肝细胞癌形成,这与Yoshida等[6]在动物实验中研究结果相符合。此外,Yoshida等[6]还发现在LEC大鼠正常肝脏和肝细胞癌组织中无p66ShcA,而本研究采用蛋白质印迹法也未在人肝癌、癌旁组织中发现p66ShcA蛋白表达。本研究还发现,无肝硬化的患者Shc1阳性率(100%)高于伴肝硬化的患者(54.2%),这可能与非肝硬化所致肝癌的发病机制有关,为探索治疗此类肝癌新方法提供了有效的信息。Child-Pugh分级是评判患者肝脏手术术前肝功能情况的准确指标,肝癌手术要求患者术前为Child-Pugh A级,或Child-Pugh B级调整后为Child-Pugh A级,术前Child-Pugh分级A级的患者Shc1阳性率(75.9%)高于B级或C级的患者(0%),而Child-Pugh A级患者的肝功能优于B级或C级,在肝功能较优的肝癌患者中Shc1表达水平较高,但由于本研究中B/C级患者较少(仅4例),该结果还需加大样本进一步验证。AFP作为肝癌的特异性肿瘤指标,已在临床诊断、病理诊断中得到了广泛的应用,术前检测血中AFP阳性患者 Shc1阳性率(79.2%)高于AFP阴性患者(33.3%),说明Shc1基因的表达与AFP水平有关,为研究AFP阳性肝细胞癌的发病机制提供线索。病理检查是肝癌诊断的金标准,术后病理EdmondsonⅢ、Ⅳ级患者Shc1阳性率(84.2%)高于Ⅰ、Ⅱ级的患者(42.9%),提示Shc1的表达与肝细胞癌的分化程度有关。并且免疫组化发现Shc1主要表达于肝癌细胞的胞质中,在癌旁组织中表达较少,为肝癌的Shc1免疫组化诊断进一步发展奠定基础。对正常肝细胞和肝癌细胞进行研究,发现肝癌SMMC-7721、Hep-G2、MHCC-97L细胞中Shc1表达量高于正常肝细胞L-02,而在肝癌MHCC-LM3、PLC/PRF/5细胞中的表达量低于L-02细胞,说明肝癌Shc1上调现象存在于一部分肝癌细胞。笔者选取Shc1表达量最高的SMMC-7721细胞进行研究,利用siRNA干扰SMMC-7721细胞Shc1的表达,发现其生物学特性如生长增殖、细胞迁移等受到抑制,说明降低Shc1的表达能抑制肝癌细胞的生长。
综上所述,Shc1基因在肝细胞癌组织中高表达,且与是否肝硬化、术前Child分级、术前AFP水平、病理Edmondson分级相关。干扰Shc1的表达可以抑制肝癌SMMC-7721细胞的增殖、迁移能力。
目前Shc1参与乳腺癌、前列腺癌、肺癌、胃肠道肿瘤细胞增殖的过程已经比较明确,但其致癌机制仍未完全清楚。Yoshida等[6]发现,p46ShcA的酪氨酸磷酸化参与了大鼠慢性乙型肝炎发展为肝细胞癌的过程。Veeramani等[14]发现,前列腺癌中p66Shc水平的升高与细胞内活性氧簇(ROS)有关。Galimov等[4]研究发现,雌激素及其受体可能与ShcA共同参与了结肠癌的发生、发展,并且这个过程中也涉及ROS通路。这或许会为研究人肝细胞癌中Shc1作用机制方面提供帮助。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Forner A, Llovet J, Bruix J.Hepatocellular carcinoma[J].Lancet, 2012, 379:1245-1255. |
| [2] | Jackson J G, Yoneda T, Clark G, Yee D.Elevated levels of p66 Shc are found in breast cancer cell lines and primary tumors with high metastatic potential[J].Clin Cancer Res, 2000, 6:1135-1139. |
| [3] | Murayama Y, Miyagawa J, Oritani K, Yoshida H, Yamamoto K, Kishida O, et al.CD9-mediated activation of the p46 Shc isoform leads to apoptosis in cancer cells[J].J Cell Sci, 2004, 117(Pt 15):3379-3388. |
| [4] | Galimov E R, Sidorenko A S, Tereshkova A V, Pletyushkina O Y, Chernyak B V, Chumakov P M.The effect of p66shc protein on the resistance of the RKO colon cancer cell line to oxidative stress[J].Mol Biol, 2012, 46:126-133. |
| [5] | 陈 娜, 王晓洋, 杜 玮, 孙亚楠, 李西川, 马振毅, 等.在A549细胞中靶向p66ShcshRNA的沉默效应[J].天津医科大学学报, 2012, 18:10-13. |
| [6] | Yoshida S, Masaki T, Feng H, Yuji J, Miyauchi Y, Funaki T, et al.Enhanced expression of adaptor molecule p46 Shc in nuclei of hepatocellular carcinoma cells:study of LEC rats[J].Int J Oncol, 2004, 25:1089-1096. |
| [7] | 田 芳, 胡长春, 朱婉儿.N-Shc蛋白功能的研究进展[J].中国老年学杂志, 2009, 29:3303-3306. |
| [8] | Koch O R, Fusco S, Ranieri S C, Maulucci G, Palozza P, Larocca L M, et al.Role of the life span determinant P66(shcA) in ethanol-induced liver damage[J].Lab Invest, 2008, 88:750-760. |
| [9] | Conti L, Sipione S, Magrassi L, Bonfanti L, Rigamonti D, Pettirossi V, et al.Shc signaling in differentiating neural progenitor cells[J].Nat Neurosci, 2001, 4:579-586. |
| [10] | Trinei M, Giorgio M, Cicalese A, Barozzi S, Ventura A, Migliaccio E, et al.A p53-p66Shc signalling pathway controls intracellular redox status, levels of oxidation-damaged DNA and oxidative stress-induced apoptosis[J].Oncogene, 2002, 21:3872-3878. |
| [11] | Sone K, Mori M, Mori N.Selective upregulation of p66-Shc gene expression in the liver and brain of aged rats[J].Arch Gerontol Geriatr, 2012, 55:744-748. |
| [12] | De Falco V, Guarino V, Malorni L, Cirafici A M, Troglio F, Erreni M, el al.RAI(ShcC/N-Shc)-dependent recruitment of GAB 1 to RET oncoproteins potentiates PI-3-K signalling in thyroid tumors[J].Oncogene, 2005, 24:6303-6313. |
| [13] | Veeramani S, Yuan T C, Lin F F, Lin M F.Mitechondrial redox signaling by p66Shc is involved in regulating androgenic growth stimulation of human prostate cancer cells[J].Oneogene, 2008, 27:5057-5068. |
| [14] | Veeramani S, Chou Y W, Lin F C, Muniyan S, Lin F F, Kumar S, et al.Reactive oxygen species induced by p66Shc longevity protein mediate nongenomic androgen action via tyrosine phosphorylation signaling to enhance tumorigenicity of prostate cancer cells[J].Free Radic Biol Med, 2012, 53:95-108. |
 2014, Vol. 35
2014, Vol. 35


