颈动脉粥样硬化是2型糖尿病(T2DM)患者常见的大血管并发症,被认为是心脑血管事件的重要危险因素[ 1 ]。研究表明,颈动脉内中膜厚度(carotid intima-media thickness,CIMT)是T2DM患者心血管疾病的一个独立危险因素,被确立为心血管事件的标记物[ 2 ]。近年来发现血清脑源性神经营养因子(brain derived neurotrophic factor,BDNF)在T2DM中含量异常,并与动脉粥样硬化有关;血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种血管炎性因子,在T2DM及颈动脉粥样硬化中亦含量增高。本研究拟通过观察T2DM患者血清BDNF、VEGF含量的变化及其与CIMT的关系,探讨BDNF、VEGF与颈动脉粥样硬化的关系。 1 资料和方法 1.1 研究对象
兰州大学第二医院糖尿病二科2013年6月至10月收治住院的T2DM患者120例,其中男性50例,女性70例。纳入标准:(1)符合1999年WHO制定的2型糖尿病诊断标准;(2)至少使用1种降糖药物或者胰岛素(或者胰岛素类似物)治疗3个月以上,且药物或胰岛素剂量稳定1个月以上者。排除标准:精神病患者,有酗酒或吸毒史者,严重肝、肾功能不全及心力衰竭、妊娠及哺乳、急性期感染、合并其他内分泌疾病者。根据颈动脉超声检查结果,分为T2DM非颈动脉粥样硬化组[56例,男23例,女33例,年龄45~79(62.8±8.8)岁,其中高血压患者13例(23.21%)]和T2DM合并颈动脉粥样硬化组[64例,男27例,女37例,年龄48~79(62.2±8.4)岁,其中高血压患者15例(23.44%)]。健康对照组按照年龄、性别与病例组均衡原则,选取同期我院体检中心体检空腹血糖<6.1 mmol/L及餐后2 h血糖<7.8 mmol/L的体检者60例,男28例,女32例,年龄44~78(61.8±9.2)岁,其中高血压患者10例(16.67%)。本研究经兰州大学第二医院伦理委员会审查批准,所有受试者均签署知情同意书。
1.2 研究方法 1.2.1 临床基线资料及一般生化指标的测定
由专人记录所有受试者的年龄、性别、糖尿病病程、血压等;受试者在研究前1 d晚禁食8~12 h,次日清晨8:00~9:00采集前臂肘静脉血3 mL,分为2份,4℃下离心10 min(2 000 r/min),1份用于测定血清空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c),其中FPG使用葡萄糖氧化酶法测定,TC、TG、HDL-c、LDL-c使用全自动生化分析仪测定;另1份分离血清并分装于EP管中,-40℃冰箱冻存,待收齐样本后使用ELISA法测定血清BDNF、VEGF浓度,ELISA试剂盒购自兰州科迈公司,批间变异<10%,批内变异<10%。稳态模型胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(FINS,mIU/L)×FPG(mmol/L)/22.5。 1.2.2 颈动脉血管超声检查
采用美国GE LOGIQ P6型多普勒超声诊断仪,首先自颈动脉起始处作纵向扫查,逐次显示颈总动脉、颈总动脉分叉处、颈内动脉和颈外动脉。然后沿血管走行做横切扫查,观察动脉内膜有无增厚、斑块部位、大小和回声特点。本研究中将CIMT≥1.0 mm定义为颈动脉内中膜增厚,CIMT<1.0 mm为颈动脉正常。动脉粥样斑块形成定义为CIMT>1.5 mm或局部隆起凸出管壁0.5 mm或超过环绕CIMT值的50%。T2DM合并颈动脉粥样硬化包含CIMT增厚和(或)斑块形成[ 3 ]。 1.3 统计学处理
使用SPSS 19.0软件对数据进行统计分析。非正态分布数据经取自然对数转换为正态分布。计量资料使用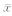 ±s表示,两组间比较使用独立样本t检验,多组间比较使用单因素方差分析。相关性分析采用Pearson相关分析和logistic回归分析。检验水准(α)为0.05。
±s表示,两组间比较使用独立样本t检验,多组间比较使用单因素方差分析。相关性分析采用Pearson相关分析和logistic回归分析。检验水准(α)为0.05。
2 结 果 2.1 各组一般临床资料比较
各组间糖尿病病程、年龄、TG、HDL-c 、收缩压(SBP)、舒张压(DBP)差异无统计学意义。合并颈动脉粥样硬化组及非颈动脉粥样硬化组TC、LDL-c、FPG、lgHOMA-IR高于健康对照组(F=4.546,3.662,27.932,30.795,均P<0.05),非颈动脉粥样硬化组与合并颈动脉粥样硬化组上述指标间差异无统计学意义。合并颈动脉粥样硬化组糖化血红蛋白(HbA1c)高于非颈动脉粥样硬化组(t=-3.204,P<0.05)。具体数据见表 1。
|
|
表 1 各组受试者一般情况比较 |
健康对照组血清BDNF高于非颈动脉粥样硬化组及合并颈动脉粥样硬化组(F=32.788,P<0.05),VEGF水平低于非颈动脉粥样硬化组及合并颈动脉粥样硬化组(F=17.360,P<0.05)。具体数据见表 2。
|
|
表 2 各组间颈动脉内中膜厚度、血清脑源性神经营养因子、血管内皮生长因子水平的比较 |
Pearson相关分析结果显示,颈动脉粥样硬化与VEGF、lgHOMA-IR、FPG正相关(r分别为0.339、0.307、0.348,均P<0.05),与BDNF负相关(r=-0.420,P<0.05)。VEGF与CIMT、lgHOMA-IR、FPG正相关(r分别为0.341、 0.216、0.279,均P<0.05),与BDNF负相关(r=-0.482,P<0.05)。BDNF与CIMT、VEGF、lgHOMA-IR、FPG负相关(r分别为-0.527、-0.482、-0.342、-0.444,均P<0.05)。
以颈动脉粥样硬化为应变量,以年龄、TC、TG、HDL-c、LDL-c、FPG、SBP、DBP、lgHOMA-IR、BDNF、VEGF为自变量进行logistic回归分析,结果显示lgHOMA-IR、VEGF、BDNF进入回归方程,且VEGF[OR(95%CI):1.021(1.001~1.040)]、lgHOMA-IR[OR(95%CI):5.026(1.213~20.612)]为颈动脉粥样硬化的危险因素,BDNF[OR(95%CI):0.828(0.719~0.937)]为颈动脉粥样硬化的保护因素(表 3)。
|
|
表 3 颈动脉粥样硬化与其他检测指标的回归分析 |
研究报道约73%的T2DM患者并发颈动脉疾病,CIMT值是诊断颈动脉粥样硬化的直接指标,颈动脉粥样硬化与T2DM患者心脑血管事件密切相关[ 4 ]。动脉粥样硬化的主要发病机制是血管内皮功能受损及炎症反应。糖尿病状态下,高糖、缺血和缺氧等多种因素影响着血管生成相关因子的表达[ 5 ]。近年来发现BDNF不仅影响血浆葡萄糖的代谢,而且在动脉粥样硬化等心血管代谢性疾病中也起着重要作用[ 6 ]。Krabbe等[ 7 ]的研究证实,高血糖可抑制大脑向血液释放BDNF,T2DM患者血清BDNF含量下降,且BDNF浓度与FPG及lgHOMA-IR负相关。本研究中T2DM患者血清BDNF含量下降,且血清BDNF浓度与FBG及lgHOMA-IR负相关,与Krabbe等[ 7 ]的研究一致。同时本研究还发现,从健康对照组、非颈动脉粥样硬化组到合并颈动脉粥样硬化组,血清BDNF水平逐渐下降,经logistic回归分析发现BDNF是颈动脉粥样硬化的保护因子,且BDNF与CIMT负相关,推测BDNF可能阻碍CIMT的进展,对颈动脉粥样硬化具有保护作用。
研究报道BDNF可以通过与VEGF作用调节影响炎症反应的相关炎性因子[ 8 ]。段薇等[ 9 ]报道T2DM并发大血管病变患者血清VEGF浓度升高,认为VEGF诱导的内皮细胞迁移及血管生成与糖尿病血管并发症有关,同时动物实验表明VEGF可促进家兔动脉粥样硬化斑块的形成和发展,并与其失稳定有关[ 10 ]。本研究发现,从健康对照组、非颈动脉粥样硬化组到合并颈动脉粥样硬化组,血清VEGF水平逐渐上升,与BDNF变化趋势相反,且相关分析发现,两者负相关。Logistic回归分析提示VEGF为颈动脉粥样硬化的危险因素,推测血清低浓度BDNF及高浓度VEGF共同参与颈动脉粥样硬化的发生、发展。
本研究中,血清BDNF与VEGF负相关。研究发现BDNF能够与细胞表面的TrkB受体结合,降低VEGF的表达水平[ 11 ],由此推测正常情况下BDNF可能抑制VEGF分泌。研究报道,血清BDNF浓度与糖尿病病程负相关[ 12 ],随着糖尿病病程的延长,高糖及胰岛素抵抗将会抑制BDNF的分泌,血清BDNF浓度下降,其抑制VEGF分泌的作用减弱,血清VEGF的浓度上升并促进血管病变的发生及发展,最终导致动脉粥样硬化的发生。
本研究显示,合并动脉粥样硬化组与非动脉粥样硬化组FPG 、TC、TG、HDL-c 、LDL-c 、SBP、DBP水平差异均无统计学意义,未发现血糖、血脂、血压等传统血管危险因素的相关影响,这可能与大多数患者服用药物使血糖、血脂、血压控制相对理想有关,也可能与样本含量不足有关。本研究仅从血清BDNF、VEGF水平变化的角度探讨其在T2DM合并颈动脉粥样硬化发病机制中的作用,其具体机制尚待更深一步的研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Ringleb P A. Diabetes mellitus, intima-media-dicke und stenosen der A. carotis[J]. Der Diabetologe, 2009, 5: 628-636. |
| [2] | Okayama K I, Mita T, Gosho M, Yamamoto R, Yoshida M, Kanazawa A, et al. Carotid intima-media thickness progression predicts cardiovascular events in Japanese patients with type 2 diabetes[J]. Diabetes Res Clin Pract, 2013, 101: 286-292. |
| [3] | Touboul P J, Hennerici M G, Meairs S, Adams H, Amarenco P, Bornstein N, et al. Mannheim carotid intima-media thickness and plaque consensus (2004-2006-2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011[J]. Cerebrovasc Dis, 2012, 34: 290-296. |
| [4] | Kadoglou N P, Avgerinos E D, Liapis C D. An update on markers of carotid atherosclerosis in patients with Type 2 diabetes[J]. Biomark Med, 2010, 4: 601-609. |
| [5] | Navaratna D, Fan X, Leung W, Lok J, Guo S, Xing C, et al. Cerebrovascular degradation of TRKB by MMP9 in the diabetic brain[J]. J Clin Invest, 2013, 123: 3373-3377. |
| [6] | Chaldakov G. The metabotrophic NGF and BDNF: an emerging concept[J]. Arch Ital Biol, 2011, 149: 257-263. |
| [7] | Krabbe K S, Nielsen A R, Krogh-Madsen R, Plomgaard P, Rasmussen P, Erikstrup C, et al. Brain-derived neurotrophic factor (BDNF) and type 2 diabetes[J].Diabetologia, 2007, 50: 431-438. |
| [8] | Halade G V, Ma Y, Ramirez T A, Zhang J, Dai Q, Hensler J G, et al. Reduced BDNF attenuates inflammation and angiogenesis to improve survival and cardiac function following myocardial infarction in mice[J]. Am J Physiol Heart Circ Physiol, 2013, 305: H1830-H1842. |
| [9] | 段 薇, 张 锦, 张学梅, 孙丽鹏. 内皮抑素和血管内皮生长因子与2型糖尿病大血管病变的关系[J]. 中国动脉硬化杂志, 2006, 14: 799-801. |
| [10] | 方 莉, 苗 旺. 颈动脉粥样硬化斑块患者血清血管内皮生长因子研究[J]. 中国实用神经疾病杂志, 2011, 14: 67-68. |
| [11] | Au C W, Siu M K, Liao X, Wong E S, Ngan H Y, Tam K F, et al.Tyrosine kinase B receptor and BDNF expression in ovarian cancers -Effect on cell migration, angiogenesis and clinical outcome[J]. Cancer Lett, 2009, 281:151-161. |
| [12] | He M, Wang J. Decreased serum brain-derived neurotrophic factor in Chinese patients with Type 2 diabetes mellitus[J].Acta Biochim Biophys Sin(Shanghai), 2014, 46:426-427. |
 2014, Vol. 35
2014, Vol. 35


