2. 解放军92330部队医院, 青岛 266102;
3. 解放军522医院药材科, 洛阳 471003
2. Hospital of PLA No. 92330 Troop, Qingdao 266102, Shandong, China;
3. Department of Pharmaceutics, No. 522 Hospital of PLA, Luoyang 471003, Henan, China
氯吡格雷是一种噻吩并吡啶类血小板聚集抑制剂,选择性地阻断二磷酸腺苷(ADP)与血小板受体的结合,以阻止ADP介导的糖蛋白GPⅡb/Ⅲa复合物的活化,发挥抑制血小板聚集的作用,氯吡格雷还能阻断其他激动剂通过释放ADP引起的血小板聚集[1]。临床上使用的主要是其硫酸盐,可防治因血小板高度聚集引起的心、脑和其他动静脉的循环障碍疾病[2]。
目前市场上有多种氯吡格雷制剂,主要为原研药波立维、国产仿制品帅克和泰嘉等。氯吡格雷分子结构中包含1个不对称碳原子,存在2种对映异构体:R型和S型,其中S型为氯吡格雷制剂的活性成分,R型为氯吡格雷有关物质项,在产品的生产和储存过程中S型氯吡格雷可能会转变成R型氯吡格雷,因此需要建立适合的检测方法监测制剂中R型氯吡格雷的含量[3]。为了更有效地控制硫酸氢氯吡格雷片的质量,本研究建立高效液相色谱法(HPLC)测定硫酸氢氯吡格雷片中2种成分的含量,并比较了3个厂家生产的硫酸氢氯吡格雷制剂的差异。
1 仪器和试剂
Agilent 1260高效液相色谱仪(配四元泵,自动进样器,在线脱气机,柱温箱和紫外检测器,chemstation工作站);ULTRON ES-OVM手性色谱柱(4 .6 mm×150 mm,5 μm,Shinwa Chemical Industries,日本);BS110S电子分析天平(Sartorius,德国);SB100D超声波清洗机(新芝生物科技股份有限公司);硫酸氢氯吡格雷(S型)对照品(中国食品药品检定研究院提供);硫酸氢氯吡格雷有关物质(R型)对照品(法国赛诺菲安万特公司提供);A药品(商品名:波立维,规格:75 mg,批号:2A780,赛诺菲制药有限公司);B药品(商品名:帅克,规格:25 mg,批号:07130523,河南新帅克制药股份有限公司);C药品(商品名:泰嘉,规格:25 mg,批号:AA20130612,深圳信立泰药业股份有限公司);色谱纯乙腈;色谱纯甲醇;超纯水;分析纯磷酸二氢钾。
2 方法和结果 2.1 色谱条件
采用Agilent 1260高效液相色谱仪作为测定仪器,色谱柱为ULTRON ES-OVM(4 .6 mm×150 mm,5 μm)手性色谱柱(可用于氯吡格雷对映异构体分离[4]),流动相为0.01 mol/L的磷酸二氢钾溶液-乙腈(80∶20,V/V),流速为1 mL/min,柱温17℃,进样量10 μL,检测波长为220 nm。
2.2 对照品溶液制备精密称取干燥至恒质量的硫酸氢氯吡格雷S型和R型的对照品10.0 mg和7.6 mg,分别置于10 mL和250 mL容量瓶中,加适量流动相溶解后并稀释至刻度,摇匀后即为对照品贮备液。2种对照品浓度分别为:硫酸氢氯吡格雷(S型)溶液1 mg/mL,氯吡格雷R型溶液30.4 μg/mL。
2.3 供试品溶液的配制取3种药品各20片,精密称质量,研细,取相当于20片药品的平均质量的药物细粉(帅克和泰嘉取3个平均质量的细粉,原因是帅克和泰嘉中氯吡格雷含量为25 mg,波立维为75 mg),加于5 mL甲醇超声5 min使其溶解,转移至100 mL容量瓶中用流动相定容,稀释使测定R型的供试品溶液为500 μg/mL(以氯吡格雷含量计),测定S型的供试品溶液为100 μg/mL(以氯吡格雷含量计)。试液进样前均过0.45 μm微孔滤膜。
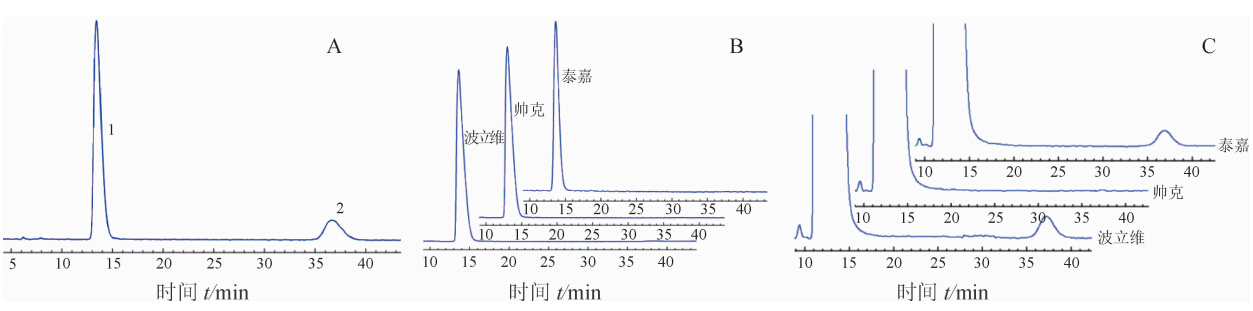
2.4 系统适应性实验取2.2项下对照品溶液,用流动相稀释制成每1 mL中含硫酸氢氯吡格雷S型43 μg、氯吡格雷R型10 μg的溶液。分别吸取上述溶液和波立维、帅泰、泰嘉3组供试品溶液(约为100 μg/mL)注入液相色谱仪进行分析,记录色谱图(图 1)。结果主峰的拖尾因子小于2.0,主峰与杂质峰达到基线分离,主峰的理论塔板数为1 584,符合质量标准的规定。
|
图 1 硫酸氢氯吡格雷质量控制的HPLC图谱 A:对照品溶液.1:S型氯吡格雷;2:R型氯吡格雷.B:3个厂家制剂中S型氯吡格雷的含量测定.C:3个厂家制剂中R型氯吡格雷的含量测定.35~40 min出现的峰为杂质峰,帅克中杂质峰未出现 |
2.5 标准曲线制备
每组含7个不同浓度梯度的溶液,其中氯吡格雷S型浓度由低到高依次为50、60、70、80、90、100、117 μg/mL,氯吡格雷R型浓度由低到高依次为1.52、3.04、6.08、9.12、12.16、18.24、30.4 μg/mL。分别取各溶液10 μL注入液相色谱仪,以峰面积(y)对浓度(x,μg/mL)进行线性回归,氯吡格雷标准曲线为:y=21.140x+9.213 5,r=0.999 8,氯吡格雷R型标准曲线为:y=18.649x+0.103 5,r=0.999 8。结果表明,氯吡格雷浓度在50~117 μg/mL范围内、R型氯吡格雷浓度在1.52~30.04 μg/mL范围内,与峰面积之间的线性关系良好。
2.6 精密度实验分别精密吸取低、中、高3个浓度梯度的2种对照品混合溶液,于1 d之内连续进样6次,以及连续3 d分别进样,计算RSD,进行日内精密度和日间精密度考察。S型氯吡格雷的日内和日间精密度均在1%以下,R型氯吡格雷的日内和日间精密度均在2%以下(表 1),表明该方法精密度良好,符合测定含量的要求。
|
|
表 1 氯吡格雷及其R型对照品溶液精密度实验结果 |
2.7 重复性实验
取药品A研碎后的粉末6份,各约1片质量,精密称定,按2.3项下方法配制成溶液,按2.1项下色谱条件测定,所得6份供试品中氯吡格雷S型、R型的含量RSD分别为1.86%和1.97%,表明该方法重复性良好。
2.8 稳定性考察按2.3项下方法配制供试品溶液后,分别放置0、4、8、12 h取供试品溶液(药品A)10 μL,按2.1项下色谱条件进样测定。氯吡格雷S型和R型的峰面积RSD分别为0.27%和0.75%,表明含量测定用供试品溶液在12 h内稳定。
2.9 回收率实验分别精密称取硫酸氢氯吡格雷及R型对照品约100 mg和2 mg(各3份),分别置100 mL量瓶中,按处方比例加入微晶纤维素、羟丙纤维素及硬脂酸镁等辅料,加流动相溶解并稀释至刻度,摇匀,过滤,精密量取续滤液照2.1项下色谱条件进样测定,记录色谱图,计算得平均回收率分别为99.7%和98.8%,RSD分别为0.37%和0.91%,符合含量测定方法要求。
2.10 样品含量测定取2.3项下配制的供试品溶液,按照2.1项下色谱条件进样测定,结果见表 2。
|
|
表 2 3个厂家氯吡格雷制剂样品的含量测定结果 |
3 讨 论
文献[5,6]报道氯吡格雷在波长218 nm左右有最大紫外吸收,考虑到干扰因素,根据文献[7]将检测波长设定为220 nm,在此波长氯吡格雷的2种对映异构体都有较大的吸收。色谱柱的柱温对氯吡格雷制剂中各组分的分离产生影响,柱温过高会影响到主成分S型氯吡格雷与其水解产物(图 1C中10 min以内出现的色谱峰)的分离[8],对主成分的测定产生干扰,因此柱温不宜太高,我们选用的Agilent1260色谱仪柱温调节范围为低于室温10~80℃之间,检测柱温设为17℃既可使S型氯吡格雷与其水解产物达到基线分离,又可以满足在夏季室温较高时的测定要求。在制剂中作为杂质的R型氯吡格雷的含量较低(质量标准为≤1.0%),与作为有效成分的S型氯吡格雷之间含量差别很大,在供试品溶液配制方面,要准确测定杂质(R型氯吡格雷)的含量需配置较高浓度的供试品溶液(以氯吡格雷有效成分计),这时S型氯吡格雷的色谱峰会产生明显的拖尾现象,因此我们把测定S型氯吡格雷含量时的溶液浓度配制为100 μg/mL(以氯吡格雷有效成分计),此时主峰不会有拖尾现象,而把测定R型氯吡格雷含量时的溶液浓度配制为500 μg/mL(以氯吡格雷有效成分计),以准确测定出R型氯吡格雷的含量。
氯吡格雷(S型)原料药和制剂中,需要重点控制其R型对映异构体的含量,特别是在原料药、制剂及长期储存过程中,作为杂质的R型氯吡格雷的含量会产生较大的变化[9]。本研究建立了HPLC法测定硫酸氢氯吡格雷片活性成分及其有关物质含量,方法学考察表明所建立的方法适合同时检测硫酸氢氯吡格雷片中活性成分及其有关物质,所选的色谱柱能够将氯吡格雷的对映异构体很好分离,方法的精密度、重复性、准确度均良好,可作为硫酸氢氯吡格雷片的含量控制方法。本实验利用建立的方法对3个厂家生产的氯吡格雷进行了检测,结果显示波立维中氯吡格雷活性成分的含量最接近标示量,帅克和泰嘉中氯吡格雷活性成分(S型氯吡格雷)含量相近,虽然符合质量标准(95%~105%),但已经接近了含量标准的下限。3种产品在氯吡格雷有关物质(R型氯吡格雷)含量方面,波立维最高(0.32%),帅克未检出,但都在质量标准(≤1.0%)范围内。
S型氯吡格雷的原料药有晶型Ⅰ和晶型Ⅱ两种晶型,晶型不同会对S型氯吡格雷的稳定性产生影响[10,11],波立维采用的是较稳定且有专利保护的晶型Ⅱ原料药,国内仿制品采用的是稳定性稍差的晶型Ⅰ原料药,制剂工艺和储存条件的不同也会影响S型氯吡格雷及杂质的含量。从测定结果来看,2种国产的氯吡格雷制剂有效成分及杂质含量均符合质量标准。长期储存过程中氯吡格雷制剂的活性成分可能会发生构型转化,含量会减少,有关物质的含量会增加,还有待进一步考察。
| [1] | Lynch D R Jr, Dantzler D M Jr, Zhao D. Prasugrel versus clopidogrel for acute coronary syndromes[J]. N Engl J Med, 2013, 368: 188. |
| [2] | Bhatt D L, Cryer B L, Contant C F, Cohen M, Lanas A, Schnitze T J, et al. Clopidogrel with or without omeprazole in coronary artery disease[J]. N Engl J Med, 2010, 363: 1909-1917. |
| [3] | Liu Y G, Gu X H. Pharmacology of chiral drugs[M]//Lin G Q, You Q D, Cheng J F. Chiral drugs: chemistry and biological action. Hoboken, New Jersey: John Wiley & Sons, 2011: 323-345. |
| [4] | Mohan A, Hariharan M, Vikraman E, Subbaiah G, Venkataraman B R, Saravanan D. Identification and characterization of a principal oxidation impurity in clopidogrel drug substance and drug product[J]. J Pharm Biomed Anal, 2008, 47: 183-189. |
| [5] | Gurav S, Venkatamahesh R. Development and validation of derivative UV-spectropotometric methods for quantitative estimation of clopidogrel in bulk and pharmaceutical dosage form[J]. Int J of Chem Tech Res, 2012, 4: 497-501. |
| [6] | 吕 洁, 孟祥军, 王凤秋.高效液相色谱法测定硫酸氢氯吡格雷的含量[J].中国医药导报, 2011, 8: 60-61. |
| [7] | Sinha P K, DamLe M C, Bothara K G. A Validated stability indicating HPTLC method for determination of aspirin and clopidogrel bisulphate in combined dosage form[J]. Eurasian J Anal Chem, 2009, 4: 152-160. |
| [8] | Gomez Y, Adams E, Hoogmartens J. Analysis of purity in 19 drug product tablets containing clopidogrel: 18 copies versus the original brand[J]. J Pharm Biomed Anal, 2004, 34: 341-348. |
| [9] | Durga Rao D, Kalyanaraman L, Sait S S, Venkata Rao P. A validated stability-indicating normal phase LC method for clopidogrel bisulfate and its impurities in bulk drug and pharmaceutical dosage form[J]. J Pharm Biomed Anal, 2010, 52: 160-165. |
| [10] | Raijada D K, Prasad B, Paudel A, Shah R P, Singh S. Characterization of degradation products of amorphous and polymorphic forms of clopidogrel bisulphate under solid state stress conditions[J]. J Pharm Biomed Anal, 2010, 52: 332-344. |
| [11] | Raijada D K, Singh S, Bansal A K. Influence of microenvironment pH, humidity, and temperature on the stability of polymorphic and amorphous forms of clopidogrel bisulfate[J]. AAPS PharmSciTech, 2010, 11: 197-203. |
 2014, Vol. 35
2014, Vol. 35


