2. 上海交通大学医学院附属仁济医院心内科, 上海 200127
2. Department of Cardiology, Renji Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200127, China
脑胶质瘤占中枢神经系统肿瘤的44.69%,其中恶性胶质瘤占70%,患者常常预后差,病死率高,即使经手术切除治疗其复发率仍高达70%~90%,5年生存率极低[1]。结合新的基因疗法和分子靶向治疗可以提高肿瘤患者的生存率,但目前尚未发现针对胶质瘤的特别有效的关键靶基因,寻找新的治疗靶点已经成为胶质瘤综合治疗领域的前沿课题[2]。
视网膜母细胞瘤蛋白结合锌指蛋白(retinoblastoma protein-interacting zinc finger gene,RIZ)是一种甲基转移酶,其功能单位为PR锌指结构域,具有抑制肿瘤发生的作用。RIZ1表达水平降低与肿瘤发生、进展等密切相关,被定义为一种抑癌基因,可能同p53基因一样,有望成为肿瘤预防、监测、治疗的新靶点。但是RIZ1在胶质瘤中的表达情况及其与胶质瘤患者预后间的关系,目前国内外尚无报道。本研究应用免疫组织化学染色方法检测RIZ1在不同级别星型胶质细胞瘤中的表达,并分析其与肿瘤恶性程度和预后等的相关性。
1 材料和方法1.1 标本收集和信息采集
收集2008年2月至2010年9月在第二军医大学长征医院神经外科手术治疗、具有详细临床和随访资料的胶质瘤患者的肿瘤标本进行研究,所有肿瘤标本均为术中获取,即刻行甲醛溶液固定和石蜡包埋切片,由长征医院病理科两位经验丰富的专家根据WHO中枢神经系统肿瘤分级标准(2007),分别独立对肿瘤行病理分级和分类,WHOⅠ~Ⅱ级为低级别胶质瘤(low grade glioma,LGG),WHO Ⅲ~Ⅳ级为高级别胶质瘤(high grade glioma,HGG)。正常脑组织(normal brain tissue,NBT)标本从两位因车祸致开放性颅脑创伤死亡、无任何先天疾病的患者获得。本组胶质瘤病例共51例,其中男性32例、女性19例,男女比例1.68∶1.00,年龄22~75岁,中位年龄46岁,随访时间11~66个月。临床统计资料还包括肿瘤大小、肿瘤切除程度、病理级别、肿瘤无进展生存期(progress free survival,PFS)和总生存期(overall survival,OS)。本研究经第二军医大学长征医院医学伦理委员会审核批准,患者或其代理人均签署知情同意书。
1.2 免疫组化染色检测RIZ1和Ki-67的表达石蜡切片行二甲苯脱蜡和梯度水化,3% H2O2室温孵育5~10 min以封闭内源性过氧化物酶,5%~10%正常兔血清封闭液室温下孵育20 min;分别加RIZ1(Abnova,Taipei,Taiwan)一抗(1∶300)和Ki-67 (Dako,Glostrup,Denmark) 一抗(1∶75),4℃孵育过夜。1×TBST冲洗3次,加入二抗,室温孵育30 min。DAB显色,复染,封片。用非免疫血清替代一抗作为阴性对照。两位经验丰富的病理学专家分别独立地对免疫染色和临床病理学特征进行评估,在400×放大倍数下,取3块染色最明显的区域计算1 000个细胞中染色阳性细胞的百分比均数。以阳性细胞百分比的中位值为界分为高表达和低表达组。
1.3 统计学处理采用SPSS 21.0 软件进行统计分析,作图软件采用Graph pad Prism5。计量资料以x±s表示,计数资料以百分比表示。组间差异比较采用单因素方差分析,RIZ1的表达程度与临床病理资料间的关系采用Kruskal-Wallis检验,Spearman相关系数检验RIZ1和Ki-67的免疫反应之间的相关性。Kaplan-Meier法进行生存分析并绘制生存曲线。使用log-rank检验对可能影响预后的因素进行单因素分析,将其中P<0.2的因素纳入Cox多因素回归分析。检验水准(α)为0.05。
2 结 果2.1 RIZ1和Ki-67在胶质瘤中的免疫组化染色结果
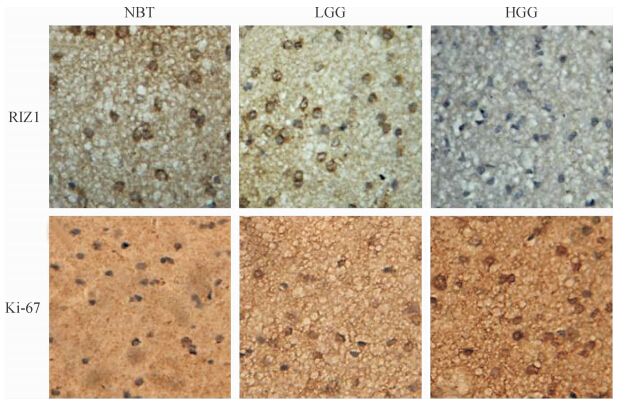
免疫组化染色显示RIZ1在正常脑组织和不同级别胶质瘤中的表达情况不同(图 1),RIZ1蛋白在正常组织中表达程度最高,低级别胶质瘤中RIZ1染色阳性率[(48.83±4.34)%]较高,而高级别胶质瘤中阳性率[(7.55±4.39)%]最低,不同级别胶质瘤组间差异有统计学意义(P<0.000 1);高级别胶质瘤中Ki-67的表达[(40.10±10.17)%]高于低级别胶质瘤[(6.92±1.96)%],差异有统计学意义(P<0.000 1)。同级别胶质瘤中RIZ1与Ki-67的表达呈负相关(r=-0.813 0,P<0.000 1)。详见图 2。
|
图 1 RIZ1和Ki-67在不同级别胶质瘤中的免疫组化染色结果 Fig 1 Immunohistochemical staining results of RIZ1 and Ki-67 in gliomas of different grades NBT:Normal brain tissue;LGG:Low grade glioma;HGG:High grade glioma.Original magnification:×400 |

|
图 2 RIZ1和Ki-67的表达及两者间的相关性 Fig 2 Immunoreactivity intensities of RIZ ,Ki-67 and their correlation LGG:Low grade glioma;HGG:High grade glioma |
2.2 RIZ1的表达强度与临床病理特征的关系
统计分析结果显示,患者的年龄和肿瘤病理级别与RIZ1表达强度有关,年龄小于50岁和低级别肿瘤中RIZ1的表达水平分别高于年龄≥50岁和高级别肿瘤患者,差异有统计学意义(P分别为0.027和0.000);RIZ1的表达水平与患者性别、肿瘤大小等无关。见表 1。
|
|
表 1 RIZ1的表达与临床病理学特征间的关系 Tab 1 Relationship between RIZ1 immunoreactivity and clinicopathologic features of glioma patients |
2.3 RIZ1的表达水平与患者PFS和OS间的关系
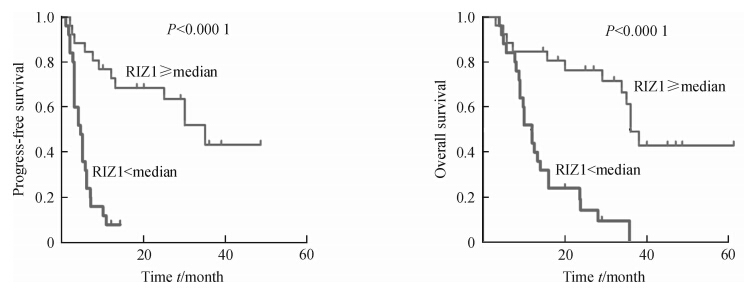
生存曲线显示RIZ1高表达患者的PFS和OS高于RIZ1低表达患者,差异有统计学意义(均P<0.000 1,图 3),单因素分析提示RIZ1的高表达和Ki-67的低表达的患者预后较好(P<0.000 1,P=0.001),而年龄、性别、肿瘤大小等与预后无关(表 2)。多因素Cox回归分析发现,RIZ1的高表达是胶质瘤患者预后的保护因素(P=0.000,HR=0.164,95%CI:0.071~0.378)。
|
图 3 RIZ1的表达与患者无进展生存期(PFS)和总生存期(OS)的关系 Fig 3 Relationship of RIZ1 immunoreactivity with progress-free survival and overall survival of patients with gliomas |
|
|
表 2 临床病理各指标与胶质瘤患者预后的关系 Tab 2 Relationship between clinicopathologic features and prognosis of glioma patients |
3 讨 论
RIZ1是由Buyse等[3]发现的一种肿瘤抑制基因,定位于1号染色体短臂3区6带(1p36.23)[4],该染色体区域在许多人类肿瘤中发生缺失。RIZ1表达下调或丢失可见于乳腺癌、卵巢癌、肝癌、结直肠癌、慢性髓性白血病、黑素瘤、嗜铬细胞瘤等多种肿瘤疾病[5,6]。遗传机制和表观遗传机制是RIZ1失活的主要原因[7,8,9,10]。目前RIZ1与胶质瘤发病间的关系国内外尚未见报道。我们应用免疫组化染色方法发现RIZ1在正常脑组织中高表达,随着肿瘤级别的增加其表达水平降低,即低级别胶质瘤中RIZ1的染色程度高于高级别胶质瘤;Ki-67是公认的肿瘤恶性度指标,研究中我们发现RIZ1与Ki-67的表达呈负相关;临床病理资料统计分析结果也显示RIZ1的表达强度与肿瘤级别和患者年龄负相关;生存分析结果显示RIZ1的高表达与患者术后PFS和OS正相关。以上这些发现可初步证实RIZ1高表达和肿瘤恶性程度负相关,RIZ1可能参与了胶质瘤的发生和发展。
目前尚无研究证实RIZ1如何参与胶质瘤的发生和发展,Liu等[11]利用基因芯片技术结合RT-PCR、蛋白质印迹和免疫组化等技术,发现随着脑膜瘤恶性程度的增加,RIZ1的表达水平逐渐下降;利用慢病毒转染技术高表达RIZ1,能够抑制脑膜瘤细胞增殖,诱导恶性脑膜瘤细胞凋亡。 他们还证实了RIZ1的过表达与c-myc的下调相关。也有文献报道在其他肿瘤发病机制中,RIZ1与胶质瘤发病三大核心通路中的p-53通路和RB通路相关,且与NF-κB、AKT、TNF-α、c-myc等胶质瘤辅助通路相关[10,12,13],据此我们推测RIZ1极有可能通过调控p-53、RB、NF-κB等通路参与脑胶质瘤的发生和发展、恶性增殖和侵袭等,但具体机制尚待下一步实验去深入研究。
本研究结果表明RIZ1的表达与胶质瘤的发生发展关系密切,提示RIZ1的表达水平有可能作为判断脑胶质瘤恶性程度的一个辅助指标。这为进一步研究、寻找基因治疗新靶点和阐明恶性脑胶质瘤的发生、发展机制打下基础。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Chen J, McKay R M, Parada L F. Malignant glioma: lessons from genomics, mouse models, and stem cells[J]. Cell, 2012, 149:36-47. |
| [2] | Ostrom Q, Cohen M L, Ondracek A, Sloan A, Barnholtz-Sloan J. Gene markers in brain tumors: what the epileptologist should know[J]. Epilepsia, 2013, 54 Suppl 9:25-29. |
| [3] | Buyse I M, Shao G, Huang S.The retinoblastoma protein binds to RIZ, a zinc-finger protein that shares an epitope with the adenovirus E1A protein[J].Proc Natl Acad Sci USA, 1995, 92: 4467-4471. |
| [4] | Dong S, Zhang P, Liang S, Wang S, Sun P, Wang Y. The role of the retinoblastoma protein-interacting zinc finger gene 1 tumor suppressor gene in human esophageal squamous cell carcinoma cells[J]. Oncol Lett, 2013, 6:1656-1662. |
| [5] | Emterling A, Wallin A, Arbman G, Sun X F. Clinicopathological significance of microsatellite instability and mutated RIZ in colorectal cancer[J]. Ann Oncol, 2004, 15:242-246. |
| [6] | Shimura H, Mori N, Wang Y H, Okada M, Motoji T. Aberrant methylation and decreased expression of the RIZ1 gene are frequent in adult acute lymphoblastic leukemia of T-cell phenotype[J]. Leuk Lymphoma, 2012, 53:1599-1609. |
| [7] | Khaenam P, Niibori A, Okada S, Jearanaikoon P, Araki N, Limpaiboon T. Contribution of RIZ1 to regulation of proliferation and migration of a liver fluke-related cholangiocarcinoma cell[J]. Asian Pac J Cancer Prev, 2012, 13:4007-4011. |
| [8] | Mori N, Yoshinaga K, Tomita K, Ohwashi M, Kondoh T, Shimura H, et al. Aberrant methylation of the RIZ1 gene in myelodysplastic syndrome and acute myeloid leukemia[J]. Leuk Res, 2011, 35:516-521. |
| [9] | Poetsch M, Dittberner T, Woenckhaus C. Frameshift mutations of RIZ, but no point mutations in RIZ1 exons in malignant melanomas with deletions in 1p36[J]. Oncogene, 2002, 21: 3038-3042. |
| [10] | Canote R, Du Y, Carling T, Tian F, Peng Z, Huang S.The tumor suppressor gene RIZ in cancer gene therapy (review)[J]. Oncol Rep, 2002, 9: 57-60. |
| [11] | Liu Z Y, Wang J Y, Liu H H, Ma X M, Wang C L, Zhang X P, et al. Retinoblastoma protein-interacting zinc-finger gene 1 (RIZ1) dysregulation in human malignant meningiomas[J]. Oncogene, 2013, 32: 1216-1222. |
| [12] | Noman A S, Koide N, Iftakhar-E-Khuda I, Dagvadorj J, Tumurkhuu G, Naiki Y, et al. Retinoblastoma protein-interacting zinc finger 1, a tumor suppressor, augments lipopolysaccharide-induced proinflammatory cytokine production via enhancing nuclear factor-kappaB activation[J]. Cell Immunol, 2010, 264: 114-118. |
| [13] | Noman A S, Koide N, Iftakhar-E-Khuda I, Dagvadorj J, Tumurkhuu G, Naiki Y, et al. Retinoblastoma protein-interacting zinc finger 1 (RIZ1) participates in RANKL-induced osteoclast formation via regulation of NFATc1 expression[J]. Immunol Lett, 2010, 131: 166-169. |
 2014, Vol. 35
2014, Vol. 35


