2. 重庆医科大学第一附属医院急诊科, 重庆 400016;
3. 四川大学华西医院生物治疗国家重点实验室遗传工程与小鼠中心, 成都 610000
2. Department of Emergency, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China;
3. Center of Gene Engineered Mice, State Key Laboratory of Biotherapy, West China Hospital, Sichuan University, Chengdu 610000, Sichuan, China
肌醇加氧酶(myo-inositol oxygenase,Miox) 最初在大鼠肾脏提取物中发现并纯化,但从大鼠肾脏中分离得来的Miox蛋白并不稳定,因此关于Miox的机制及特性研究进展很慢。直至20世纪80年代,有人用电泳分离的方法才得到纯度较高的蛋白[ 1 ]。肌醇(myo-inositol,MI)是生理肌醇的异构体,在许多组织和细胞中作为第二信使合成的前体被使用,同时其还可以作为一种有机渗透物质参与渗透压调节[ 2 ]。MI代谢的第一个限速步骤即是受到Miox加单氧酶的催化,这个过程主要在肾皮质的近端小管发生[ 3 ]。Miox催化MI分解的酶促反应主要氧化裂解MI环状分子的第6位和第1位碳原子之间的键并产生D-葡糖醛酸,D-葡糖醛酸在随后的一系列步骤中逐步分解,并最终进入磷酸戊糖途径进行循环代谢。研究发现,Miox在小鼠肾小管近端小管中表达明显高于其他器官。此外,Miox在糖尿病并发症器官(如神经组织、视网膜等)中也有少量表达[ 4,5,6,7 ]。然而关于Miox在胚胎发育中的作用至今尚未见报道。本研究通过半定量反转录聚合酶链反应(RT-PCR)和整胚原位杂交的方法观察Miox在爪蟾胚胎发育过程中的时间和空间表达谱,为以后研究Miox在肾脏发育过程中的作用提供理论基础。 1 材料和方法 1.1 主要试剂
实验所需爪蟾由四川大学华西医院遗传工程小鼠中心馈赠。RT-PCR试剂盒、Hind Ⅲ 和BamH Ⅰ限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶、T3和T7 RNA聚合酶均购于Fermentas公司。地高辛标记的UTP、Anti-digoxigenin-AP及Purple AP Substract均购于Roche公司。 TRIzol购于Invitrogen公司,PCR引物合成和DNA测序均由生工生物工程(上海)股份有限公司完成。羊抗地高辛碱性磷酸酶标记的抗体及封闭用正常羊血清购于北京中杉金桥生物技术有限公司。 1.2 爪蟾胚胎的获取及制备
于成熟的非洲爪蟾背部注射500~800 IU的人绒毛膜促性腺激素(HCG)促进排卵。体外受精后,胚胎用2%盐酸半胱氨酸(pH 7.8~8.0)进行脱膜,将脱膜后的胚胎培养在0.1 mol/L 磷酸盐缓冲液( pH 7.4)缓冲液中。将用于原位杂交的胚胎固定在4%多聚甲醛中,4℃过夜。然后将胚胎经25%、50%、75%、100%浓度的甲醇各处理5 min,梯度脱水。脱水后的胚胎保存在-20℃的冰箱中。 1.3 RT-PCR检测Miox表达
分别收集爪蟾第1、3、7、11、17、20、22、26、28、34、38、40、41、45期共14个时期的胚胎,将收集的胚胎放入研钵,加入少量液氮迅速研磨后转入1.5 mL 离心管,按50~100 mg组织/1 mL TRIzol混匀,反复吹打,室温放置5 min使其充分裂解;4℃,1 000×g离心10 min;将上清液转移到新的离心管中,加入200 μL氯仿,振荡混匀,室温放置15 min;4℃,1 000×g离心15 min;吸取上层水相至新的离心管中;加入500 μL异丙醇混匀,室温放置5~10 min;4℃,以不超过1 000×g的速度离心10 min,可在管底见微小白色沉淀,丢弃上清液;加入1 mL 75%乙醇,温和振荡,悬浮沉淀;4℃,以不超过7 500×g的速度离心5 min,丢弃上清;重复1次;室温干燥RNA 5~10 min,用30 μL DEPC水溶解沉淀,测定浓度并于-20℃保存。将RNA反转录为cDNA,采用PCR扩增包含大部分编码区及部分3′端非翻译区的Miox基因cDNA序列( 扩增片段长度为896 bp)。引物序列:上游引物5′-GCA AGC TTG TGT TCA GTG ACA CCA-3′,下游引物 5′-GCG GAT CCA ATC TTC ACA ATC CTC-3′。扩增条件:95℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸 1 min,共35个循环;最后72℃延伸10 min。将扩增产物经1.5%琼脂糖凝胶电泳后,在凝胶成像系统下观察Miox基因在各个时期的表达情况。用Image J对凝胶图像进行灰度扫描,并进行统计学分析。RNA反转录成cDNA以后的cDNA产物作为阳性对照,未反转录成cDNA的RNA作为阴性对照。 1.4 胚胎整体原位杂交检测Miox表达
将Miox cDNA的PCR扩增片段克隆在pBST-Ⅱ载体的Hind Ⅲ和BamH Ⅰ多克隆位点之间,并对重组质粒进行测序和鉴定。重组质粒经T3 RNA聚合酶体外转录获得反义RNA探针,并用地高辛标记。胚胎整体原位杂交方法参照Harland [ 8 ]报道的方法,在5 mL玻璃小瓶中收集15~20个包含胚胎发育各个时期的胚胎,将探针稀释到杂交缓冲液中,浓度为100 ng/500 μL,并在65℃水浴锅中孵育过夜。经过一系列洗涤过程,用羊抗地高辛碱性磷酸酶抗体1∶12 000稀释,4℃孵育过夜。用Purple AP Substract显色底物避光显色,待染色清晰即可停止染色。染色后的胚胎经30%蔗糖处理24 h,使用OTC包埋剂包埋胚胎,进行冠状位切片,切片厚度30 μm。切下来的组织转移到圆盖玻片上,放置于24孔板中,90%甘油封片。在ZEISS AxioCam MRc5体视显微镜镜下观察并拍照。 1.5 统计学处理
采用SPSS19.0软件进行统计学分析,数据以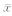 ±s表示,多组资料比较采用单因素方差分析,两组资料比较采用t检验。检验水准(α)为0.05。
±s表示,多组资料比较采用单因素方差分析,两组资料比较采用t检验。检验水准(α)为0.05。
2 结 果 2.1 Miox基因在爪蟾胚胎发育过程中的时间表达模式
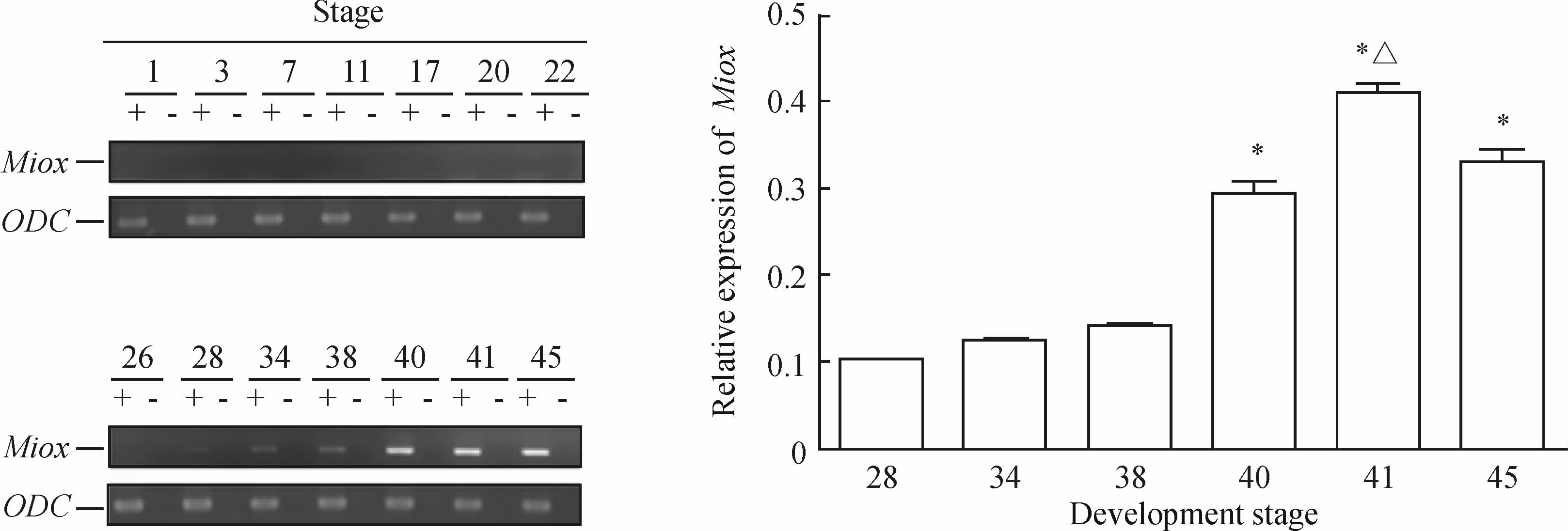
运用半定量RT-PCR检测Miox基因在爪蟾胚胎发育过程中的时间表达模式发现,Miox基因在爪蟾胚胎发育第26期前均无表达。当胚胎发育至第28期开始Miox基因有很微量表达,随着胚胎发育的进展,胚胎发育第34、38期其表达水平继续轻微上调,但是差异仍无统计学意义(P>0.05)。与胚胎发育第28、34期相比,第40、41、45期Miox表达上调(P<0.05);与胚胎发育第40期相比,第41期表达上调(P<0.05);然而,与胚胎发育第41期相比,第45期表达下调(P<0.05)。见图 1。
|
图 1 RT-PCR 分析Miox基因在爪蟾胚胎发育过程中的时间表达模式
Fig 1 Temporal expression patterns of myo-inositol oxygenase(Miox) gene during development of Xenopus laveis embryos at different stages
ODC:Ornithine decarboxylase;+: With reverse transcription; - : Without reverse transcription.*P<0.05 vs stage 28 or stage 34;△P<0.05 vs stage 40 or stage 45. n=50,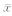 ±s ±s
|
运用整体原位杂交方法测Miox基因在爪蟾胚胎发育过程中的空间表达模式,结果(图 2)发现:胚胎发育30期以前均未能在爪蟾的任何器官检测到Miox表达,从33期开始,Miox在爪蟾前肾有很微弱的表达,随着胚胎发育的进展,Miox的表达逐渐升高。与RT-PCR结果相类似,直至胚胎发育第39~40期,Miox的表达达到最高,并且在随后的时期都以同样高的水平表达。另外我们还发现,Miox基因在爪蟾胚胎发育过程中均仅仅在原肾小管表达。

|
图 2 原位杂交检测Miox基因在爪蟾胚胎发育过程中的空间表达谱 Fig 2 Spatial expression patterns of myo-inositol oxygenase(Miox) gene during development of Xenopus laveis embryos as analyzed by whole-mount in situ hybridization Picture Q is a larger version of Xenopus laveis head of picture P; The directions of sections of picture R and S are along the line of picture J and P,respectively. Pt:Pronephros tubule; St:Stage.Original magnification: ×90 (A-Q),×200 (R-S) |
前肾的发育可以分为以下几个阶段:前肾原基的形成(initiation of pronephric anlage,第12.5期),肾发生(nephrogenesis,第20期),细胞定向分化(cellular differentiation,第25期),器官成熟及终末分化(maturation and terminal differentiation,第29/30~第35/36期),泌尿功能的形成(formation of excretory function,第40期以后)[ 9,10 ]。
间质上皮转化(mesenchymal-epithelial transition,MET)在肾脏发育特别是肾小管发生中发挥着重要作用。肾脏间充质细胞经过MET后最终分化形成原肾小管。转化生长因子β(TGF-β)是调节MET的一个关键因子[ 11,12 ]。有研究发现,Miox的过度表达可以诱导TGF-β表达和活性的增加,间质部分特异性标记基因如Vimentin表达的增加和部分上皮特异性标记基因如E-cadherin表达的降低[ 6 ],提示Miox发挥着抑制MET过程的作用。另一方面,Miox是催化肌醇代谢的限速酶。作为一个渗透调节物,肌醇耗竭可以改变Na+ /K+ -ATP酶[ 5 ]。而Na+ /K+ -ATP酶在肾脏发育后期功能形成阶段发挥着重要作用,它通过吸收水分及离子在细胞内外形成电化学梯度从而维持肾脏的渗透调节功能[ 13,14 ]。因此我们推测Miox在肾脏发育后期的渗透调节中发挥着重要作用。
作为一个肾脏特异性表达基因,Miox在肾脏发育过程中发挥的作用迄今还未见报道。我们用RT-PCR和整胚原位杂交的方法对Miox在胚胎发育过程中的表达作了时间和空间上的表达谱分析。RT-PCR结果显示,至胚胎发育第26期均未检测到Miox基因在爪蟾胚胎中的表达;胚胎发育第28期Miox在胚胎前肾有很微量表达;随着胚胎的发育Miox表达逐渐升高,第41期时Miox表达达到顶峰,在胚胎发育第45期,表达明显下调。整体原位杂交结果显示,胚胎发育第33期才检测到Miox表达(这可能是因为RT-PCR的灵敏度优于整体原位杂交技术),并且Miox在爪蟾胚胎发育过程中仅仅在前肾小管表达。从Miox的时间和空间表达模式来看,Miox基因很可能在肾脏发育的成熟及终分化(29/30期到35/36期)阶段以及肾脏开始排泄阶段(40期以后)发挥着作用,然而这方面还尚未有研究。
综上所述,本研究在肾脏发育领域观察了Miox的表达,分析了Miox在经典模式生物爪蟾胚胎发育过程中的时间和空间表达模式,发现Miox在胚胎发育过程中始终都在原肾小管表达。提示Miox可能成为肾脏特别是原肾小管的一个特异性标记基因。从Miox的表达模式推测Miox基因很可能在肾脏发育的成熟及终分化阶段以及肾脏开始排泄阶段发挥作用。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
( 志谢 感谢四川大学华西医院遗传工程与小鼠中心的全体成员为本实验提供的支持和帮助! )
| [1] | Arner R J, Prabhu K S, Thompson J T, Hildenbrandt G R, Liken A D, Reddy C C. myo-Inositol oxygenase: molecular cloning and expression of a unique enzyme that oxidizes myo-inositol and D-chiro-inositol[J]. Biochem J, 2001, 360: 313-320. |
| [2] | Holub B J. Metabolism and function of myo-inositol and inositol phospholipids[J]. Annu Rev Nutr, 1986, 6: 563-597. |
| [3] | Prabhu K S, Arner R J, Vunta H, Reddy C. Up-regulation of human myo-inositol oxygenase by hyperosmotic stress in renal proximal tubular epithelial cells[J]. J Biol Chem, 2005, 280: 19895-19901. |
| [4] | Lu Y, Liu C, Miao X, Xu K, Wu X, Liu C. Increased expression of myo-inositol oxygenase is involved in the tubulointerstitial injury of diabetic nephropathy[J]. Exp Clin Endocrinol Diabetes, 2009, 117: 257-265. |
| [5] | Yang B, Hodgkinson A, Millward B A, Demaine A G. Polymorphisms of myo-inositol oxygenase gene are associated with type 1 diabetes mellitus[J]. J Diabetes Complications, 2010, 24: 404-408. |
| [6] | Xie P, Sun L, Oates P J, Srivastava S K, Kanwar Y S.Pathobiology of renal-specific oxidoreductase/myo-inositol oxygenase in diabetic nephropathy: its implications in tubulointerstitial fibrosis[J]. Am J Physiol Renal Physiol, 2010, 298: F1393-F1404. |
| [7] | Arner R J, Prabhu K S, Krishnan V, Johnson M C, Reddy C C. Expression of myo-inositol oxygenase in tissues susceptible to diabetic complications[J]. Biochem Biophys Res Commun, 2006, 339: 816-820. |
| [8] | Harland R M. In situ hybridization: an improved wholemount method for Xenopus embryos[J]. Methods Cell Biol, 1991, 36: 685-695. |
| [9] | Vize P D, Seufert D W, Carroll T J, Wallingford J B. Model systems for the study of kidney development: use of the pronephros in the analysis of organ induction and patterning[J]. Dev Biol, 1997, 188: 189-204. |
| [10] | Raciti D, Reggiani L, Geffers L, Jiang Q, Bacchion F, Subrizi A E, et al. Organization of the pronephric kidney revealed by large-scale gene expression mapping[J]. Genome Biol, 2008, 9: R84. |
| [11] | Brandli A W. Towards a molecular anatomy of the Xenopus pronephric kidney[J]. Int J Dev Biol, 1999, 43: 381-395. |
| [12] | Herzlinger D. Inductive interactions during kidney development[J]. Semin Nephrol, 1995, 15: 255-262. |
| [13] | Uochi T, Takahashi S, Ninomiya H, Fukui A, Asashima M. The Na+, K+-ATPase alpha subunit requires gastrulation in the Xenopus embryo[J]. Dev Growth Differ, 1997, 39: 571-580. |
| [14] | Eid S R, Brändli A W.Xenopus Na, K-ATPase: primary sequence of the beta2 subunit and in situ localization of alpha1, beta1, and gamma expression during pronephric kidney development[J]. Differentiation, 2001, 68(2-3): 115-125. |
 2014, Vol. 35
2014, Vol. 35


