现在普遍认为,肝脏是放射较敏感的器官之一[1],并且肝脏辐射损伤是临床放射性治疗(包括腹腔恶性肿瘤的放疗和骨髓移植射线预处理)、平时核事故及战时核辐射的常见并发症。以往研究表明,细胞凋亡及某些凋亡相关基因表达改变是辐射损伤的重要机制[2,3],常见的Bcl-2家族成员含有4个短的保守BH结构域:BH1~BH4,而BH3-only亚族是指仅含有BH3结构域的一组蛋白,包括依赖p53上调的凋亡调节子(p53 up-regulated modulator of apoptosis,PUMA)、Bad等多个成员。BH3-only亚族作为Bcl-2家族中一类重要的促凋亡分子,通过其独特的BH3结构域与该家族的其他成员如Bcl-2、Bcl-xL和Bax等相互作用,引起线粒体外膜通透性增加,继而其内容物如细胞色素C(cytochrome C)等释放入胞质并启动下游凋亡信号,因此BH3-only分子在凋亡调节中起着关键作用[4],然而肝脏辐射损伤所引起的细胞凋亡与BH3-only亚族成员间关系的研究尚不多见。本研究拟通过检测凋亡相关蛋白表达和细胞凋亡的动态变化来系统地探讨肝脏辐射损伤机制。
1 材料和方法 1.1 实验动物与辐照方法
SPF 级 BALB/c 雄性小鼠24只,6~7 周龄,体质量(22.7±0.9)g,购自上海西普尔-必凯实验动物有限公司[许可证号:SCXK(沪)2008-0016]。适应性喂养1周后,随机分为6组,每组4只,即:对照组(0 h),未接受辐照;辐照组设5个时相:4、6、12、24、48 h。用60Co γ 射线辐照源(第二军医大学辐照中心提供)同时对辐照组进行12 Gy全身一次性均匀照射,剂量率为2.5 Gy/min。
1.2 主要材料及试剂一抗:Bcl-2、Bax抗体购自Trevigen公司;Bcl-xL、Bad抗体购自Epitomics公司;PUMA、Caspase 3、Caspase 8抗体购自Cell Signaling Technology公司;β-actin抗体购自Santa Cruz公司;锌指状转录抑制因子Slug抗体由美国哈佛大学医学院吴文书博士惠赠。二抗:山羊抗鼠HRP标记IgG、山羊抗兔HRP标记IgG购自Jackson ImmuoResearch公司;兔抗鸡HRP标记IgG购自Proteintech Group公司。蛋白裂解液购自Promega公司;苯甲基磺酰氟(PMSF)、蛋白酶抑制剂购自深圳市创奇基因生物制品有限公司;Pierce BCA蛋白定量分析试剂盒、增强化学发光(ECL)底物购自Thermo Scientific公司。原位细胞凋亡检测(TUNEL染色)试剂盒购自Roche公司。
1.3 标本采集与病理检查各组小鼠于辐照4、6、12、24、48 h后处死并收集肝脏标本。将肝脏组织分别作如下处理:(1)4%多聚甲醛固定,石蜡包埋,制作3 μm厚切片,H-E染色,光镜观察组织病理改变;(2)2.5%戊二醛和1%锇酸固定,制作50~70 nm超薄切片,醋酸铀和柠檬酸铅双重染色,日立H-7000型透射电镜观察超微结构病理改变;(3)将剩余新鲜肝组织剪碎后速冻,液氮保存供后续实验使用。
1.4 原位细胞凋亡检测将各组肝组织石蜡块制作成3 μm厚切片,参考先前的方法[5],按TUNEL染色步骤操作,DAB显色,苏木精轻度复染后封片。凋亡细胞定量分析:在高倍镜下(×400)对各组切片随机计数5个视野内阳性细胞数,求出每个时间点的均数,进行统计分析。
1.5 蛋白质印迹分析检测根据先前的方法[6]处理各组肝总蛋白,按每泳道80~100 μg总蛋白量上样,12% SDS-PAGE分离。经电转、封闭后,一抗anti-PUMA、anti-Bcl-2、anti-Bcl-xL、anti-Bax、anti-Caspase 3、anti-Caspase 8、anti-β-actin(均为1∶1 000),anti-Bad(1∶5 000),anti-Slug(1∶10 000)4 ℃孵育过夜,相应HRP标记二抗(1∶10 000)室温孵育1 h;ECL法显影,DYVERSITY多功能成像仪(Syngene公司)摄影记录,每项实验均重复3次。蛋白表达定量分析:用ImageJ 1.41o软件求得条带积分光密度(D)值,蛋白相对表达水平=目的蛋白D值/内参蛋白β-actin D值,以0 h水平为基准,结果以相对倍数表示。
1.6 统计学处理计量数据以 ±s表示,应用SPSS 17.0统计软件包进行单因素方差分析,方差齐时组间比较采用LSD检验,方差不齐时组间比较采用Dunnett’s T3检验。检验水准(α)为0.05。
2 结 果 2.1 辐照后急性期病理改变
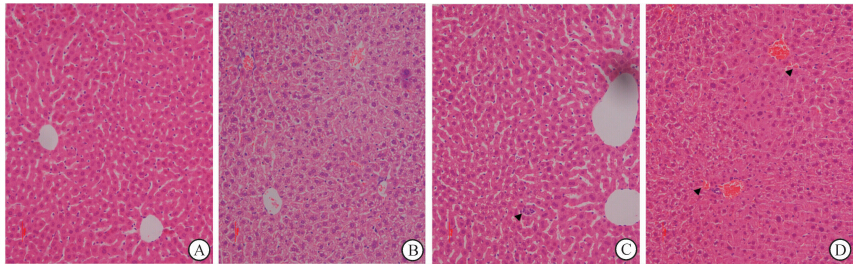
由图 1A可见,光镜下正常肝组织(0 h)见肝细胞形态规则,胞质染色均匀,肝索沿中央静脉呈放射状排列,肝窦清晰。辐照后4~6 h出现肝细胞胞质疏松化,部分细胞肿胀明显,互相挤压导致肝窦狭窄,符合肝细胞浊肿变性和气球样变性表现(图 1B)。图 1C、1D显示,辐照后12~24 h肝细胞变性呈弥漫性进行性加重,部分中央静脉充血,周围肝窦扩张,门管区附近肝窦变窄、消失,局部有散在点状坏死和出血灶(▲所示)。辐照后48 h肝细胞损伤以细胞变性为主,坏死少见。
|
图 1 辐照后小鼠肝组织病理学观察(H-E染色) Fig 1 Histopathology of mouse liver slides after irradiation(H-E staining) A: Normal non-irradiated liver slide (0 h); B: At 4 h after irradiation; C: At 12 h after irradiation; D: At 24 h after irradiation. Local hemorrhage and necrosis were shown (▲). Original magnification:× 200 |
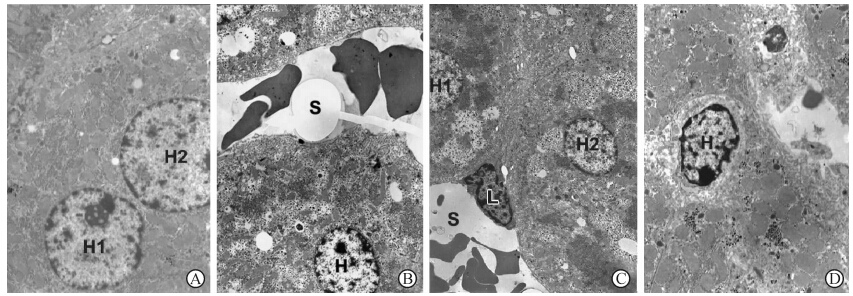
电镜显示正常肝细胞(0 h)胞质内含有大量糖原颗粒,细胞器丰富,以线粒体为主,核完整,核仁明显,染色质分布均匀(图 2A)。辐照后4 h,少量肝细胞即出现早期凋亡特征,表现为细胞核染色质边集,电子密度增强,核形不规整,核膜表面凹凸不平,核仁凝固,细胞体积变小,细胞质浓缩,线粒体轻度肿胀,糖原颗粒聚集成片(图 2B)。辐照后12 h,肝细胞形态除有凋亡改变外,还发现少量肝细胞坏死,表现为细胞核染色质凝集,细胞质电子密度增强,糖原颗粒聚集成片,细胞器结构不清,伴有游走淋巴细胞侵入肝实质(图 2C)。辐照后24 h,肝细胞凋亡多见,并以中期凋亡特征为主,表现为核内染色质凝聚、固缩,趋边呈月牙状,核膜孔消失,核膜呈波纹状皱缩,线粒体高度肿胀,细胞体积缩小,细胞连接出现缝隙(图 2D)。
|
图 2 辐照后小鼠肝超微病理学观察 Fig 2 Ultrastructural pathology of mouse liver slides after irradiation H: Hepatocyte; S: Hepatic sinusoid; L: Lymphocyte.A: Normal non-irradiated liver slide (0 h); B: At 4 h after irradiation; C: At 12 h after irradiation; D: At 24 h after irradiation. Original magnification:×3 500(A),×3 000(B),×2 500(C),×4 000(D) |
2.2 原位细胞凋亡检测结果
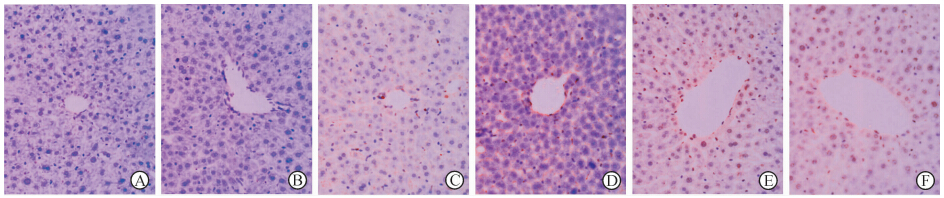
正常肝组织(0 h)平均每高倍视野可见到(0.20±0.45)个阳性细胞;辐照后4、6、12、24和48 h平均每高倍视野分别见到(4.20±0.84)、(12.40±1.82)、(14.20±2.05)、(66.20±4.38)和(72.40±7.02)个阳性细胞,以上阳性细胞仅指肝细胞和肝窦内皮细胞。其中除辐照后6 h和12 h、24 h和48 h间凋亡细胞数量差异无统计学意义(P>0.05)外,其余各组两两比较均差异有统计学意义(P<0.01)。原位细胞凋亡检测结果见图 3。
|
图 3 辐照后小鼠肝组织原位细胞凋亡检测(TUNEL染色) Fig 3 Detection of in situ apoptosis in mouse liver slides after irradiation(TUNEL staining) A: Normal non-irradiated liver slide (0 h); B: At 4 h after irradiation; C: At 6 h after irradiation; D: At 12 h after irradiation; E: At 24 h after irradiation; F: At 48 h after irradiation. Original magnification: × 400 |
2.3 辐照后肝脏凋亡相关蛋白的表达
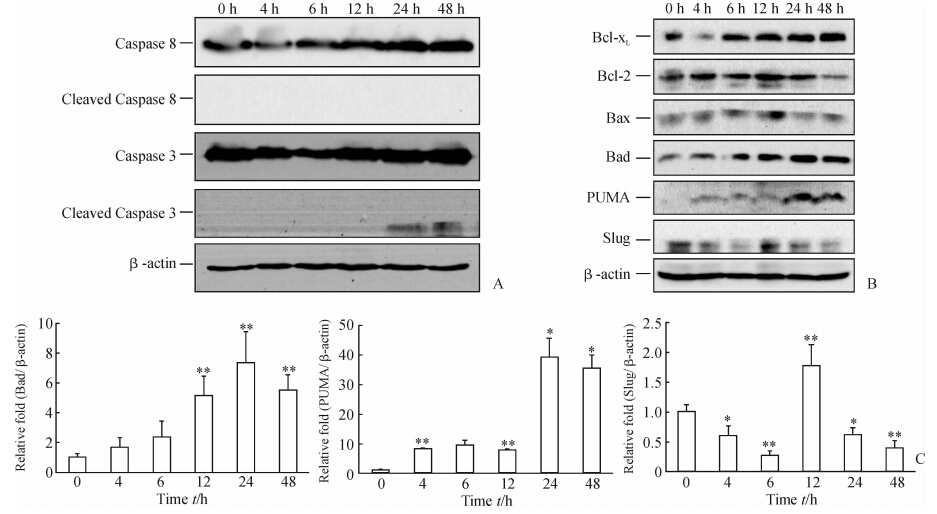
凋亡效应酶Caspase 8在辐照后48 h内未见激活,而Caspase 3在辐照后24~48 h检测到剪切片段(图 4A)。抗凋亡蛋白方面,Bcl-xL于辐照后6~48 h上调;Bcl-2于辐照后4~24 h上调,至48 h回落。促凋亡蛋白方面,作为凋亡执行者的Bax仅在辐照后12 h一过性上调(图 4B)。由图 4B和4C可见,作为凋亡调节者的BH3-only亚族成员,Bad蛋白表达呈上调趋势,同0 h水平比较,辐照后12、24、48 h表达量均上调(P<0.01);PUMA蛋白表达也呈上调趋势,同0 h水平比较,辐照后4、12 h表达量均上调(P<0.01),并于辐照后24~48 h维持在较高水平(P<0.05)。作为抑制PUMA转录的调节因子Slug,同基础水平(0 h)比较,仅在辐照后12 h轻度上调(P<0.01),其余时间点的表达量均低于基础水平并有统计学差异,即辐照后4、24 h(P<0.05)和辐照后6、48 h(P<0.01)。
|
图 4 蛋白质印迹分析检测辐照后小鼠肝脏凋亡相关蛋白表达 Fig 4 Expression of apoptosis-associated proteins in mouse liver after irradiation detected by Western blotting analysis PUMA: p53 up-regulated modulator of apoptosis. A: Immunoblot graph of activation of Caspase 3 and Caspase 8; B: Immunoblot graph of some Bcl-2 family members; C: Band density of Bad,PUMA and Slug were shown as relative fold. *P<0.05,**P<0.01 vs 0 h group. n=3,x±s |
3 讨 论
临床上将电离辐射所引起肝脏的损伤统称为放射性肝病,根据病程可划分为两个阶段:急性放射性肝炎期和后续发生的肝纤维化及肝硬化期,并提出引起急性放射性肝炎的最小单次照射剂量约为11 Gy[7]。因此本研究选择12 Gy γ 射线照射建立小鼠肝脏辐射损伤模型,通过光镜和电镜观察肝脏辐射损伤的病理特征,从而证实了该条件建模的可靠性。
结合透射电镜和光镜(H-E+TUNEL染色)的动态观察结果,定性定量地研究辐照后急性期肝损伤情况,我们发现上述检测结果能够互相吻合,显示辐照后48 h内肝损伤呈进行性加重趋势。值得指出的是,辐照后4 h即可观察到肝细胞超微结构的改变并提示有细胞凋亡发生,证实肝脏具有相当的辐射敏感性;辐照后12 h肝细胞同时出现凋亡和坏死两种损伤结局,此后肝细胞凋亡数量迅速跃升,并维持在较高水平,和李淑萍等[3]的结果类似,因此推测辐照后12 h可能是肝脏辐射损伤的临界点,这对今后开展科研和医疗工作具有一定的参考价值。
为深入研究辐射诱导肝细胞凋亡的发生机制,我们首先检测了凋亡酶Caspase家族的激活情况,Caspase 8作为死亡受体介导的凋亡通路关键环节,在辐照后未见激活;而作为凋亡执行者的Caspase 3却在辐照后24~48 h激活,与同时段TUNEL染色结果吻合,加之电镜显示该时间点肝细胞线粒体高度肿胀,提示线粒体途径介导的凋亡可能是辐射诱导肝细胞损伤的主要机制。其次,我们还检测了辐照后肝脏凋亡相关蛋白的表达情况,结果表明Bcl-2家族中抗凋亡和促凋亡成员的表达水平同时上调,其中Bax上调仅见于辐照后12 h,结合TUNEL染色结果分析,我们推测肝细胞凋亡增加并不完全依赖Bax的上调,而与BH3-only亚族成员PUMA和Bad的持续上调相关。我们先前的研究[5]报道了PUMA参与调节正常小鼠肝细胞的凋亡,体内实验发现上调肝内PUMA水平后,不仅能同步带动抗凋亡分子Bcl-xL上调,而且能显著诱导肝细胞凋亡和坏死,这一效应与PUMA介导的线粒体破坏和炎症细胞因子上调有关。而Galmiche等[8]报道Bad参与调节人肝癌细胞的凋亡敏感性,Bad的活性与其磷酸化水平呈负相关,单纯过表达Bad并不增加肝癌细胞凋亡,而在多激酶抑制剂索拉菲尼(sorafenib)的作用下,同时过表达Bad即可显著诱导凋亡,这可能与索拉菲尼降低Bad磷酸化水平,从而激活其功能有关。据此推测PUMA和Bad的上调可能是辐射诱导肝细胞凋亡的主要因素;而Bcl-xL和Bcl-2的上调可能只是一种保护性反应,并不能扭转肝细胞凋亡增多的局面。BH3-only亚族作为Bcl-2家族中一类特殊的促凋亡分子,在凋亡调控方面起着重要的作用,Shao等[9]报道γ 射线诱导PUMA上调会引起造血干/祖细胞凋亡,我们的研究也提示PUMA与辐照后肝细胞凋亡相关,说明PUMA介导的凋亡信号对于辐射损伤机制具有较为普遍的意义。此外Wu等[10]报道辐照后Slug上调能够抑制部分造血祖细胞凋亡,发挥一定的保护作用,其机制是锌指状转录抑制因子Slug能够与puma基因转录起始区的特殊位点结合,并抑制其他转录激活因子的活性,从而在转录水平阻断PUMA表达,我们发现在肝脏Slug仅于辐照后12 h升高,而在辐照后24~48 h回落,因而推测经过12 h损伤临界点后Slug未能继续发挥抑制效应。总之,BH3-only蛋白PUMA和Bad与辐照后急性期肝细胞凋亡有关,但何者占主导地位尚待进一步研究,探索辐照后磷酸化Bad的变化规律或许对回答该问题有所帮助;其次,Slug蛋白持续表达能否提高肝细胞的辐射抗性也值得继续研究。
本研究对辐射诱导肝细胞凋亡的机制提出了新的见解:BH3-only亚族成员PUMA和Bad的持续上调,保护性因子Slug的应答乏力可能是促进肝细胞凋亡的重要原因。因此在遗传和化学水平特异性地抑制BH3-only亚族的功能,或者诱导保护性因子Slug表达,比如通过特异性干扰RNA、BH3结构域封闭剂、Slug过表达载体等干预手段研究其抗辐射效应,可能会为筛选辐射防护药物提供新的思路。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 傅尚志, 张楚毅, 张景源. 电离辐射对肝脏的损伤[J]. 国外医学放射医学核医学分册, 1997, 21: 188-191. |
| [2] | 余日胜, 陈丽荣, 章伟敏, 丁文洪, 华建明, 程莉芬, 等. 高曝光剂量CT辐射致家兔肝组织发生病理变化的初步探讨[J]. 中华急诊医学杂志, 2006, 15:894-898. |
| [3] | 李淑萍, 何津祥, 李 敏, 杜兰宁, 刘兆辰. 不同剂量X射线照射对小鼠胸腺、脾脏、肝脏细胞凋亡及p53基因表达的影响[J]. 辐射防护, 2007, 27: 349-356. |
| [4] | Adams J M. Ways of dying: multiple pathways to apoptosis[J]. Genes Dev, 2003, 17: 2481-2495. |
| [5] | Chen S, Zheng J, Hao Q, Yang S, Wang J, Chen H, et al. p53-insensitive PUMA down-regulation is essential in the early phase of liver regeneration after partial hepatectomy in mice[J]. J Hepatol, 2010, 52: 864-871. |
| [6] | 陈 松, 郝 强, 杨生生, 陈 欢, 焦炳华, 蔡在龙. PUMA在小鼠肝再生早期的表达及其调控机制[J]. 第四军医大学学报, 2009, 30: 2731-2733. |
| [7] | 刘丽波, 王剑峰, 程光惠, 王铁君, 朴春姬, 陈大伟.《放射性肝病诊断标准》解读[J]. 国际放射医学核医学杂志, 2012, 36: 252-255. |
| [8] | Galmiche A, Ezzoukhry Z, Franois C, Louandre C, Sabbagh C, Nguyen-Khac E, et al. BAD, a proapoptotic member of the Bcl2 family, is a potential therapeutic target in hepatocellular carcinoma[J]. Mol Cancer Res, 2010, 8: 1116-1125. |
| [9] | Shao L, Sun Y, Zhang Z, Feng W, Gao Y, Cai Z, et al. Deletion of proapoptotic PUMA selectively protects hematopoietic stem and progenitor cells against high-dose radiation[J]. Blood, 2010, 115: 4707-4714. |
| [10] | Wu W S, Heinrichs S, Xu D, Garrison S P, Zambetti G P, Adams J M, et al. Slug antagonizes p53-mediated apoptosis of hematopoietic progenitors by repressing puma[J]. Cell, 2005, 123: 641-653. |
 2014, Vol. 35
2014, Vol. 35


