室性早搏(室早)是临床最常见的心律失常之一。大部分有室早的患者并无明显的器质性心脏病,这种室早称为特发性室早。特发性室早大多起源于流出道,其中70%~80%起源于右室流出道[ 1 ]。报道认为,过多的室早会影响左心功能[ 2,3 ],罕见的情况下,右室流出道室早能够诱发室颤或多形性室速[ 4,5 ]。虽然药物治疗有效果,但抗心律失常药物无法根除此类室早。根据目前指南,导管消融成为根治右室流出道室早的一线治疗方法[ 6 ]。以往多采用X线透视指导射频消融,但此方法存在标测和X线曝光时间长、操作难度大、疗效不确切等缺点[ 7 ];我们应用三维磁电解剖标测系统(CARTO3)指导射频消融治疗右室流出道室早,通过观察相关指标,探讨新标测方法的有效性及安全性。 1 资料和方法 1.1 一般资料
2011年1月至2013年6月,在本院连续住院行导管射频消融治疗的右室流出道室早患者共49例,其中男16例,女33例,年龄16~69(47±13)岁。其中常规电生理标测消融20例(常规组),CARTO3三维电生理标测系统指导消融29例(三维组)。病例入选标准:(1)24 h动态心电图室早总数≥10 000次。(2)有心悸、头晕、胸闷不适等症状,严重影响患者工作与生活,并且至少经1种抗心律失常药物治疗后疗效不佳或不能耐受药物治疗者。(3)心电图特点符合右室流出道室早:电轴右偏,Ⅱ、Ⅲ、aVF导联呈高幅R波,胸导联QRS波呈左束支阻滞形态,胸前导联R/S移行在V3或V4。(4)体检、胸片、超声心动图等常规检查排除器质性心脏病。标测与消融术前停用抗心律失常药物5个半衰期以上。 1.2 标测和消融方法 1.2.1 三维电生理标测和消融
穿刺右股静脉,留置7 F静脉鞘管,连接CARTO3三维电生理标测系统,温控消融导管送至右房内,构建右房三维模型,标记His束位置,消融导管通过右房室瓣后送至右室流出道,构建右室流出道三维模型,根据体表心电图特点,应用激动标测,标测到室早的最早激动部位为靶点(图 1),送消融导管至靶点,消融前起搏靶点,比较起搏心电图与患者自发室早心电图QRS波形态的吻合度(图 2)。普通消融导管为头端4 mm的温控消融导管(Biosense-Webster),温度45~55℃,功率30~40 W,消融有效则围绕靶点补充消融3~5个点。
|
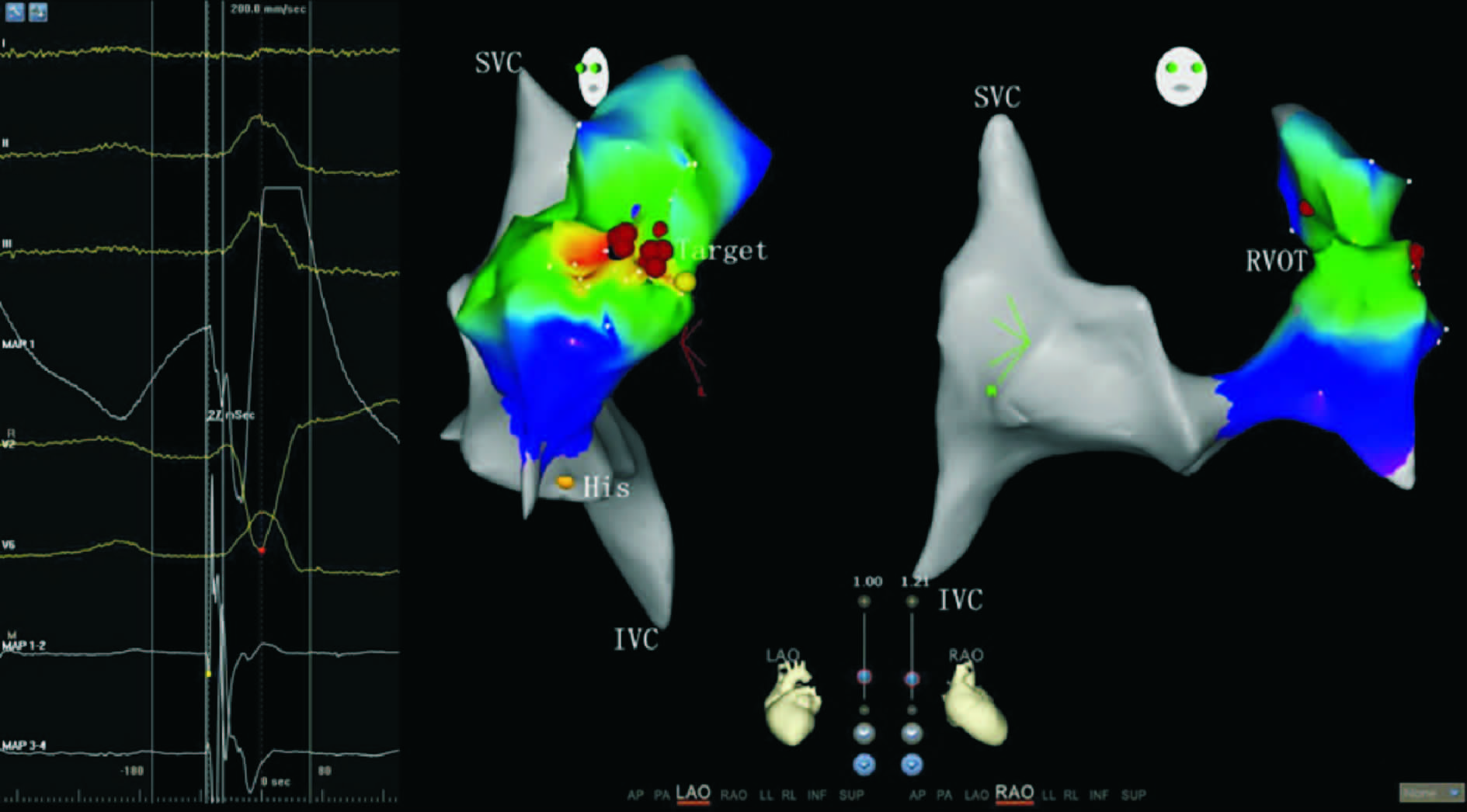
图 1 三维激动标测 左侧电图中,单极电图(MAP1)为QS型且下降支有顿挫,大头电图(MAP1-2)较体表心电图提前27 ms,结合起搏标测,考虑为室性早搏起源点;右侧三维模型中,红色圆点为消融点,左前斜(LAO)视图示起源于间隔面,右前斜(RAO)视图示起源于前部,因此判断室性早搏起源于前间隔.SVC:上腔静脉;IVC:下降静脉;His:希氏束;RVOT:右室流出道;Target:消融靶点 |
|
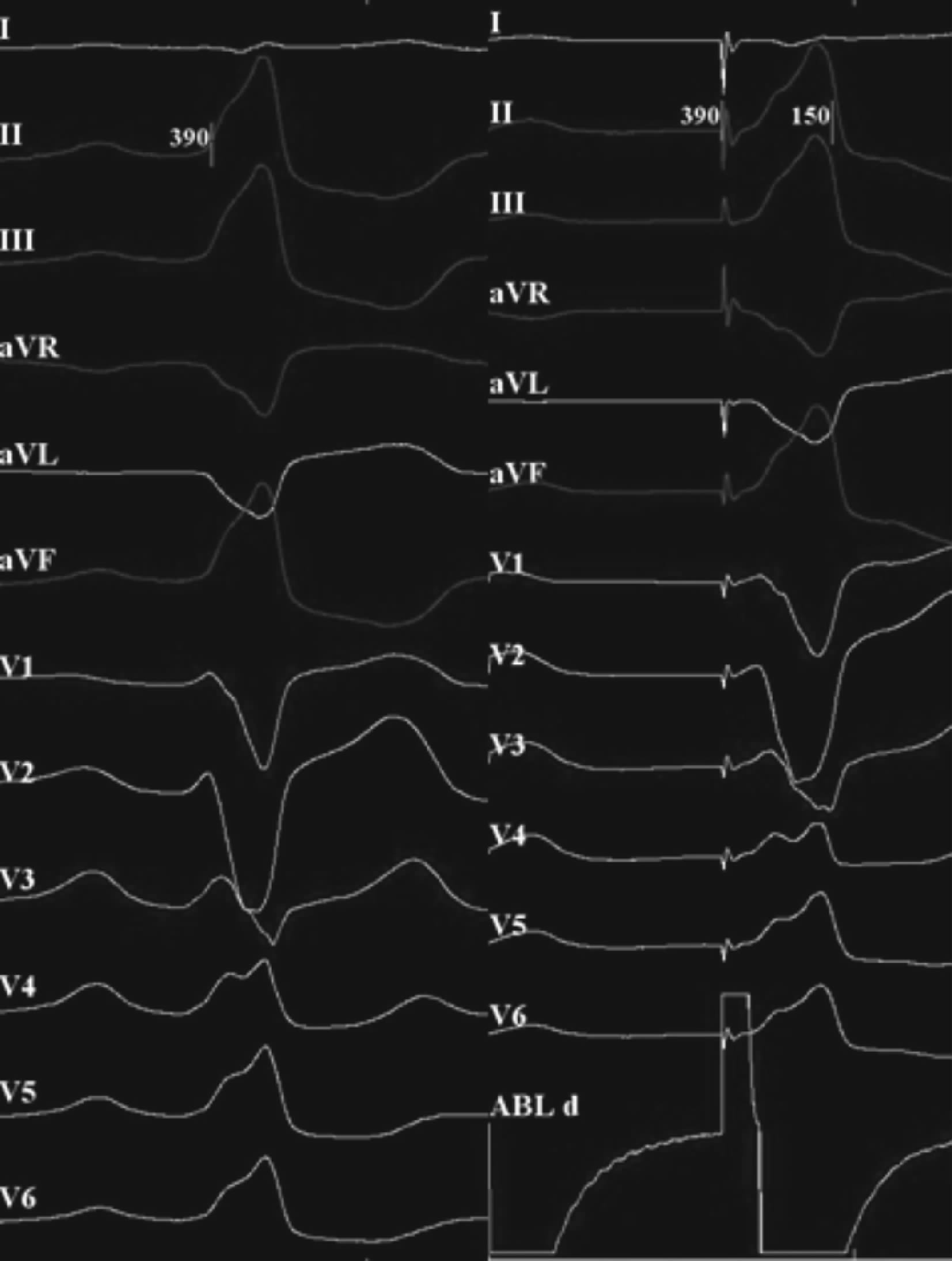
图 2 起搏标测 左侧为自发室性早搏体表心电图形态,右侧为起搏时体表心电图形态,两者类似,判断为室性早搏起源点 |
采用常规X线确定导管位置和消融靶点,标测和消融步骤与三维电生理标测消融方法类似。 1.3 消融终点
消融后室早消失,静脉滴注异丙肾上腺素及右心室程控刺激不能诱发室早。 1.4 术后随访
术后1、3、6个月门诊随访,通过患者症状、心电图、Holter动态心电图判断是否复发。患者在未服任何抗心律失常药物下心律失常相关症状消失、24 h动态心电图记录室早次数较术前减少90%以上作为消融成功的随访标准。 1.5 统计学处理
所有统计分析采用SPSS 18.0统计软件完成。计量资料采用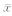 ±s表示,组间比较采用t检验;计数资料采用频数表示,组间比较采用Fisher确切概率法。检验水准(α)为0.05。
2 结 果
±s表示,组间比较采用t检验;计数资料采用频数表示,组间比较采用Fisher确切概率法。检验水准(α)为0.05。
2 结 果
常规组和三维组间性别和年龄无差异。三维组即刻成功率为100%(29/29);常规组即刻成功率为95%(19/20),1例术后仍有频发室早(每24 h 9 000次),由于子宫内膜出血导致贫血未再次行消融治疗。常规组有3例出现并发症,1例为迷走反射、1例为不完全性右束支传导阻滞、1例为室扑室颤行电复律,三维组无明显并发症。与常规组比较,三维组X线曝光时间、X线曝光量均明显缩短,但费用较常规组高(P<0.01)。两组手术总时间差异无统计学意义。具体数据详见表 1。随访6个月,常规组复发3例(15.0%),三维组无复发。
|
|
表 1 两组患者临床资料与射频消融结果比较 |
右室流出道是位于肺动脉瓣下方的形似漏斗的环形肌性管道。由于肺下心肌较长,肺动脉瓣比主动脉瓣位置更高。其好发心律失常可能与胚胎发育有关,最初心脏的出口部分是一根单一的心肌管,左心室是胚胎心脏的第一个腔,而右心室是在后续的发育过程中增加的[ 8 ],是由一个特定基因类型表达的肺下心肌延长形成的[ 9 ]。大多数特发性室性心律失常被认为是由环磷酸腺苷(cAMP)介导的钙依赖所致延迟后除极触发的[ 10,11 ]。快速刺激、异丙肾上腺素、氨茶碱、钙或者阿托品等可以促进心律失常的发生[ 12 ]。这些措施通过升高细胞内cAMP,活化蛋白激酶A(PKA),增加钙内流和兰尼碱受体磷酸化,导致肌质网内钙释放,从而活化电源性Na+/Ca2+交换,导致短暂内流和延迟后除极[ 13,14 ]。
目前右室流出道室早的治疗主要采用基于激动标测和起搏标测的消融技术[ 15 ]。常规电生理标测消融方法使用X线透视进行定位,受二维平面透视的限制,术中需要反复调整透视角度以确定导管的实际位置,在标测时需要反复对照来寻找最佳位置,导管一旦离开靶点后,很难回到原来的位置,需凭借术者经验、X线透视、起搏和激动标测相结合再次寻找靶点,既增加了手术难度,又延长了手术时间、X线曝光时间、增加了曝光量。而X线辐射对人体的危害已得到公认,其对人体的影响可分为确定性效应(如皮肤损伤)和随机性效应(如致癌)。确定性效应与辐射时间和剂量有关,具有剂量-反应阈值[ 16 ]。而随机性效应与辐射剂量的关系尚不明确,但美国科学院的BEIR VⅡ研究支持“线性无阈值(linear-no-threshold)”模型,即认为致癌风险和辐射剂量间存在简单的线性关系[ 17 ]。还有一个重要的发现值得注意,辐射风险在人群中并不是平均分布的,在辐射易损性和长期患病率方面,女性和年轻人具有相对较高的风险[ 18,19 ]。因此,无论是对于术者,还是患者,尤其是青少年和育龄期女性患者,减少辐射剂量具有重要的意义。
三维电解剖标测系统可以辅助提供标测的解剖数据,并能优化标测和消融[ 20,21 ]。CARTO3三维标测系统是利用磁场和电场定位技术,通过标测导管在心腔内的移动,构建心腔三维电解剖模型,并根据激动的时间分析其先后关系,用不同颜色表示,从而提高标测效率。相比常规电生理标测,CARTO3标测指导消融右室流出道室早有以下优势:(1)三维电磁场导航技术不使用X线,显著减少曝光时间。无论是建模、标测还是消融过程,均可不使用X线完成全部手术操作,本组病例中有69.0%(20/29)的患者完全避免了X线。(2)大大减少标测时间。由于其特有的激动标测方法,使用不同颜色表示激动顺序,建模完成后即可一目了然地明确靶点大致位置,再结合单极电图和激动标测,减少了标测时间。(3)具有标测定位记忆功能,可提高成功率,减少复发。能够对比不同靶点的有效性,避免无效靶点的多次放电;靶点区域精确放电及巩固,增加成功率,降低手术复发率及并发症。本组病例中常规组有1例手术不成功、3例出现并发症、3例复发,而三维组全部手术成功且无并发症和复发。三维方法的主要不足在于价格比较昂贵,不利于经济情况较差的地区开展此类手术。此外,要想做到完全无X线,对术者有一定要求,需要非常丰富的解剖知识、导管操作经验和细致轻柔的操作技巧。
笔者在使用三维电解剖标测消融过程中,主要有以下几点体会:(1)要实现完全无X线透视,需根据三维电解剖标测结合大头导管电图,先确定上下腔静脉开口位置和His束位置,构建右房三维模型并确定右房室瓣环位置,在模型指导下将大头导管送至右室流出道,构建右室流出道三维模型,并在模型上标测消融。(2)消融靶点往往是一片区域而不是一个点,室早的起源点往往位于出口上方,这在一些病例中得到证实,即在消融靶点后,室早形态改变,在原靶点上方消融后室早完全消失。(3)大头导管单极电图为QS有意义,起始部分有向下的顿挫尤其有意义,但也会偏离,最多可达11 mm,但起始部分有R波基本可排除靶点可能。(4)在一些自发室早室速少的患者,需要程序刺激诱发,有时要辅助药物如异丙肾上腺素,在一部分患者当中,心律失常可能出现在停药之后。
总之,CARTO3标测方法相对常规标测指导射频消融治疗特发性右室流出道室早具有一定优势,可以明显缩短X线曝光时间,减少X线曝光量,增加成功率,减少复发,但费用较昂贵。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Movsowitz C, Schwartzman D, Callans D J, Preminger M, Zado E, Gottlieb C D, et al. Idiopathic right ventricular outflow tract tachycardia: narrowing the anatomic location for successful ablation[J].Am Heart J, 1996, 131:930-936. |
| [2] | Del Carpio Munoz F, Syed F F, Noheria A, Cha Y M, Friedman P A, Hammill S C, et al. Characteristics of premature ventricular complexes as correlates of reduced left ventricular systolic function: study of the burden, duration, coupling interval, morphology and site of origin of PVCs[J].J Cardiovasc Electrophysiol, 2011, 22:791-798. |
| [3] | 庄晓华, 桂燕萍, 牛晓萍, 张家友, 顾兴建, 赵 亮, 等.射频消融治疗频发室性早搏对左室功能及其结构的影响[J].第二军医大学学报, 2012, 33: 395-398. Zhuang X H, Gui Y P, Niu X P, Zhang J Y, Gu X J, Zhao L, et al. Effect of radiofrequency catheter ablation on function and structure of left ventricle during treatment for frequent premature ventricular beats[J]. Acad J Sec Mil Med Univ, 2012, 33: 395-398. |
| [4] | Haïssaguerre M, Shoda M, Jaïs P, Nogami A, Shah D C, Kautzner J, et al. Mapping and ablation of idiopathic ventricular fibrillation[J]. Circulation, 2002, 106:962-967. |
| [5] | Viskin S, Rosso R, Rogowski O, Belhassen B. The "short-coupled" variant of right ventricular outflow ventricular tachycardia: a not-so-benign form of benign ventricular tachycardia?[J]. J Cardiovasc Electrophysiol, 2005, 16:912-916. |
| [6] | European Heart Rhythm Association; Heart Rhythm Society; Zipes D P, Camm A J, Borggrefe M, Buxton A E, Chaitman B, Fromer M, et al; American College of Cardiology; American Heart Association Task Force; European Society of Cardiology Committee for Practice Guidelines. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death)[J].J Am Coll Cardiol, 2006, 48, e247-e346. |
| [7] | 邓 伟, 谭珍妮, 罗苑苑, 孙少喜, 李 蘅, 许顶立, 等.Carto系统与常规方法指导消融频发右室流出道室性早搏的比较[J].中国心脏起搏与心电生理杂志, 2010, 24:320-324. |
| [8] | Cai C L, Liang X, Shi Y, Chu P H, Pfaff S L, Chen J, et al. Isl1 identifies a cardiac progenitor population that proliferates prior to differentiation and contributes a majority of cells to the heart[J]. Dev Cell, 2003, 5: 877-889. |
| [9] | Parisot P, Mesbah K, Théveniau-Ruissy M, Kelly R G. Tbx1, subpulmonary myocardium and conotruncal congenital heart defects[J]. Birth Defects Res A Clin Mol Teratol, 2011, 91:477-484. |
| [10] | Wilber D J, Baerman J, Olshansky B, Kall J, Kopp D. Adenosine-sensitive ventricular tachycardia: clinical characteristics and response to catheter ablation[J]. Circulation, 1993, 87:126-134. |
| [11] | Lerman B B, Belardinelli L, West G A, Berne R M, DiMarco J P. Adenosine-sensitive ventricular tachycardia: evidence suggesting cyclic AMP-mediated triggered activity[J]. Circulation, 1986, 74: 270-280. |
| [12] | Lerman B B. Response of nonreentrant catecholamine-mediated ventricular tachycardia to endogenous adenosine and acetylcholine. Evidence for myocardial receptor-mediated effects[J]. Circulation, 1993, 87:382-390. |
| [13] | Lermann B B. Mechanism of outflow tract tachycardia[J]. Heart Rhythm, 2007, 4:973-976. |
| [14] | Farzaneh-Far A, Lerman B B. Idiopathic ventricular outflow tract tachycardia[J]. Heart, 2005, 91:136-138. |
| [15] | Bogun F, Taj M, Ting M, Kim H M, Reich S, Good E, et al. Spatial resolution of pace mapping of idiopathic ventricular tachycardia/ectopy originating in the right ventricular outflow tract[J]. Heart Rhythm, 2008, 5:339-344. |
| [16] | 1990 Recommendations of the International Commission on Radiological Protection[J]. Ann ICRP, 1991, 21 (1-3):1-201. |
| [17] | Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation BoRER. Division on Earth and Life Studies, ed. Health Risks from Exposure to Low Levels of Ionizing Radiation[M]. Washington DC: National Research Council of the National Academies, 2006: 313-324. |
| [18] | Fazel R, Krumholz H M, Wang Y, Ross J S, Chen J, Ting H H, et al.Exposure to low-dose ionizing radiation from medical imaging procedures[J]. N Engl J Med, 2009, 361:849-857. |
| [19] | Brenner D J, Hall E J. Computed tomography——an increasing source of radiation exposure[J]. N Engl J Med, 2007, 357:2277-2284. |
| [20] | Greil G F, Gass M, Kuehlkamp V, Botnar R M, Wolf I, Miller S, et al. Radiofrequency ablation of right ventricular outflow tract tachycardia using a magnetic resonance 3D model for interactive catheter guidance[J]. Clin Res Cardiol, 2006, 95:610-613. |
| [21] | Saleem M A, Burkett S, Passman R, Dibs S, Engelstein E D, Kadish A H, et al. New simplified technique for 3D mapping and ablation of right ventricular outflow tract tachycardia[J]. Pacing Clin Electrophysiol, 2005, 28:397-403. |
 2014, Vol. 35
2014, Vol. 35


