2. 广州医科大学第二附属医院检验科, 广州 510260;
3. 广东药学院基础学院物理与电子学教研室, 广州 510006
2. Department of Clinical Laboratory, the Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260, Guangdong, China;
3. Department of Physics and Electronics, College of Basic Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, Guangdong, China
乳腺肿块是乳腺疾病中最常见的一种体征,良恶性肿块的鉴别诊断是决定治疗方案的关键。乳腺浸润性导管癌和乳腺纤维腺瘤均可触及无痛性的乳房肿块,乳腺纤维腺瘤是发生于乳腺小叶内纤维组织和腺上皮的混合性瘤,是乳腺疾病中最常见的良性肿瘤,少数可发生恶变;而乳腺浸润性导管癌是指癌细胞已穿破乳腺导管的基底膜并侵入间质的恶性肿瘤,为乳腺癌中最常见的一类,约占70%~80%[ 1,2 ]。近年来,随着超声诊断设备以及技术的不断发展,结合临床、影像学以及病理学表现,乳腺纤维腺瘤与乳腺浸润性导管癌的检出率大大增加[ 3,4,5 ]。但是,仍有一些患者因为病理特征不典型而不能区分良恶性,另外在肿瘤早期无明显肿块出现的时候更难检测出肿瘤的良恶性[ 6 ]。
代谢组学方法在肿瘤研究中的应用越来越广泛,如前列腺癌[ 7 ]、卵巢癌[ 8 ]、直肠癌[ 9 ]等。黎莉等[ 10 ]用UPLC/MS技术研究健康人群与乳腺癌患者在血清代谢组学上的差异,结果找出9个潜在的血清代谢标记物,并以此来辅助诊断乳腺癌。本研究采用高分辨的核磁共振1H谱(nuclear magnetic resonance 1H,1HNMR)来检测乳腺纤维腺瘤及浸润性导管癌患者的血清代谢特征,试图从代谢组水平上找出两者之间的差异,为术前准确区分良恶性肿瘤提供参考。 1 材料和方法 1.1 标本收集
于广州医科大学第二附属医院检验科收集乳腺肿瘤患者血清24例,所有患者均为初诊患者尚未接受各种治疗,且临床检查均未合并其他并发症。其中经手术病理确诊的有16例,包括乳腺纤维腺瘤8例,浸润性导管癌8例。两组患者在年龄和病史上均无差异。所有血清均于-80℃冰箱贮存待测。本研究得到广东医科大学第二附属医院医学伦理委员会批准,并经患者知情同意。 1.2 标本处理
在1HNMR谱采样前,将血清取出于室温解冻,4℃,2 432×g离心10 min。取300 μL上清加到5 mm核磁管中,再加入0.2 mol/L 磷酸缓冲溶液(0.2 mol/L Na2HPO4/NaH2PO4,pH 7.4)150 μL和重水100 μL,振荡混匀。 1.3 NMR实验
采用Bruker AVANCE Ⅲ 500 MHz 超导核磁共振波谱仪(Bruker,Inc.),实验温度设为298 K,采用Carr-Purcell-Meiboom-Gill[CPMG,recycle delay-90-(τ-180-τ)n -acquisition]脉冲序列,总的回波时间2 nτ=100 ms,延迟时间设为3 s,谱宽10 kHz,采样点数为32 k,采集次数为128。傅立叶变化前加0.3 Hz 指数窗函数处理,并采用Topspin 2.1 软件进行手动调相位和基线校正,化学位移以乳酸甲基双峰1.33进行定标。 1.4 1HNMR谱的数据预处理
采用软件Topspin 2.1 对所有的1HCPMG谱进行自动积分,积分区间为δ0.5~9.0,积分间隔为0.004。为了消除剩余水峰引起的影响,将积分区间4.7~5.2的积分值设为零。此外,在进行主成分分析(principle component analysis,PCA)前,为了消除样本间因浓度不同带来的分析误差,对各积分值进行归一化处理。归一化后的数值将作为原始数据导入Simca-P 12.0(Umetrics,Sweden)中进行模式识别PCA分析。 1.5 模式识别分析
采用PCA和正交偏最小二乘判别法 (orthogonal signal correction partial least squares discrimination analysis,OPLS-DA)相结合的方法分析乳腺纤维腺瘤患者和浸润性导管癌患者的代谢差异。PCA分析中,我们以归一化积分面积作为X变量,采用的分析模式为ctr,分析结果用得分图和负载图表示;OPLS-DA分析以归一化积分面积作为X变量,以血清样本分组作为Y变量,采用的分析模式为par,分析结果以得分图和相关系数-载荷图表示。其中相关系数-载荷图是将OPLS-DA中载荷图和相关系数值直接导入本实验室编写的MATLAB(the MathWorks,Inc.,USA)脚本进行处理得到。颜色编码的相关系数值表示代谢物变化的显著性,暖色(如红色)表示贡献率大,即代谢产物在样本组间的差异显著,冷色(如蓝色)表示贡献率小。 1.6 统计学处理
采用SPSS 19.0软件对乳腺纤维腺瘤患者与浸润性导管癌患者血清中几种代谢物的归一化积分值进行两独立样本t检验。检验水准(α)为0.05。
2 结 果 2.1 乳腺纤维腺瘤患者和浸润性导管癌患者血清的1HNMR谱比较
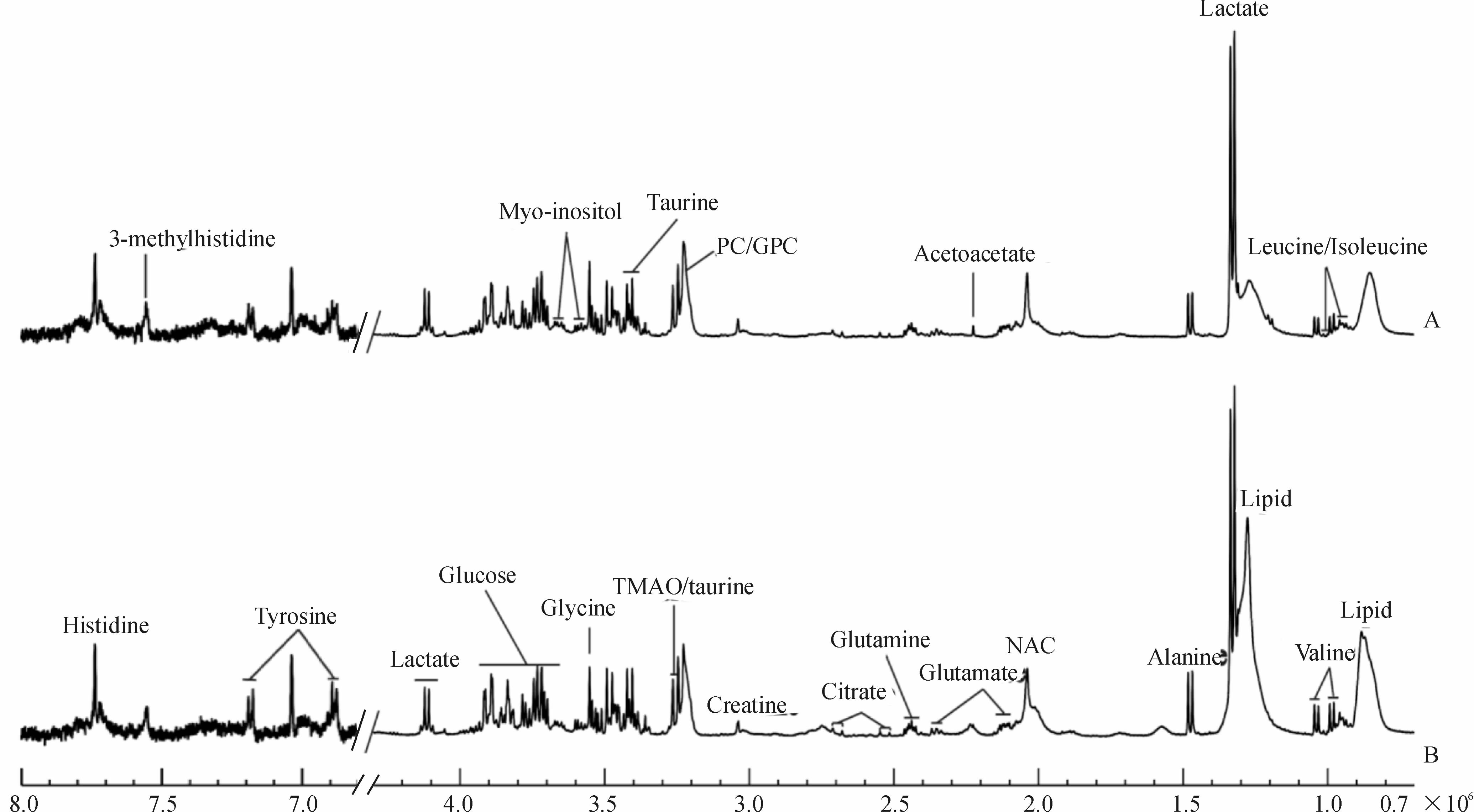
应用T2滤波的CPMG序列,可明显观察到脂类(lipid,δ0.89,1.27)、亮氨酸/异亮氨酸(leucine/Isoleucine,δ0.93,1.00)、缬氨酸(valine,δ0.97,1.04)、乳酸盐(lactate,δ1.33,4.12)、丙氨酸(alanine,δ1.48)、N-乙酰糖蛋白(NAC,n-acetylglycoproteins,δ2.04)、乙酰乙酸盐(acetoacetate,δ2.22)、谷氨酸盐(glutamate,δ2.14,2.37)、谷氨酰胺(glutamine,δ2.41)、柠檬酸盐(citrate,δ2.52,2.69)、肌酸(creatine,δ3.02)、 磷脂酰胆碱/甘油磷脂酰胆碱(PC/GPC,phosphocholine/glycerolphosphocholine,δ3.22)、氧化三甲胺/牛磺酸(TMAO/taurine,δ3.27)、牛磺酸(taurine,δ3.43)、甘氨酸(glycine,δ3.54)、肌醇(myo-inositol,δ3.56,3.66)、葡萄糖(glucose,δ3.70~3.93)、酪氨酸(tyrosine,δ6.87,7.17)、组氨酸(histidine,δ7.73)、3-甲基组氨酸(3-methylhistidine,δ7.56),且谱峰重叠度低,减小了由于谱峰重叠带来的分析误差(图 1)。比较乳腺纤维腺瘤患者(图 1A)与乳腺浸润性导管癌患者(图 1B)的1HCPMG谱,两者间未见有明显差异的代谢物。
|
图 1 乳腺纤维腺瘤(A)和乳腺浸润性导管癌(B)患者血清1HCPMG谱 Fig 1 Representative 1HCPMG spectra of sera of breast fibroadenoma patients (A) and breast invasive ductal carcinoma patients (B) PC/GPC: Phosphocholine/glycerolphosphocholine; NAC: N-acetylglycoproteins; TMAO: Trimethylamine oxide |
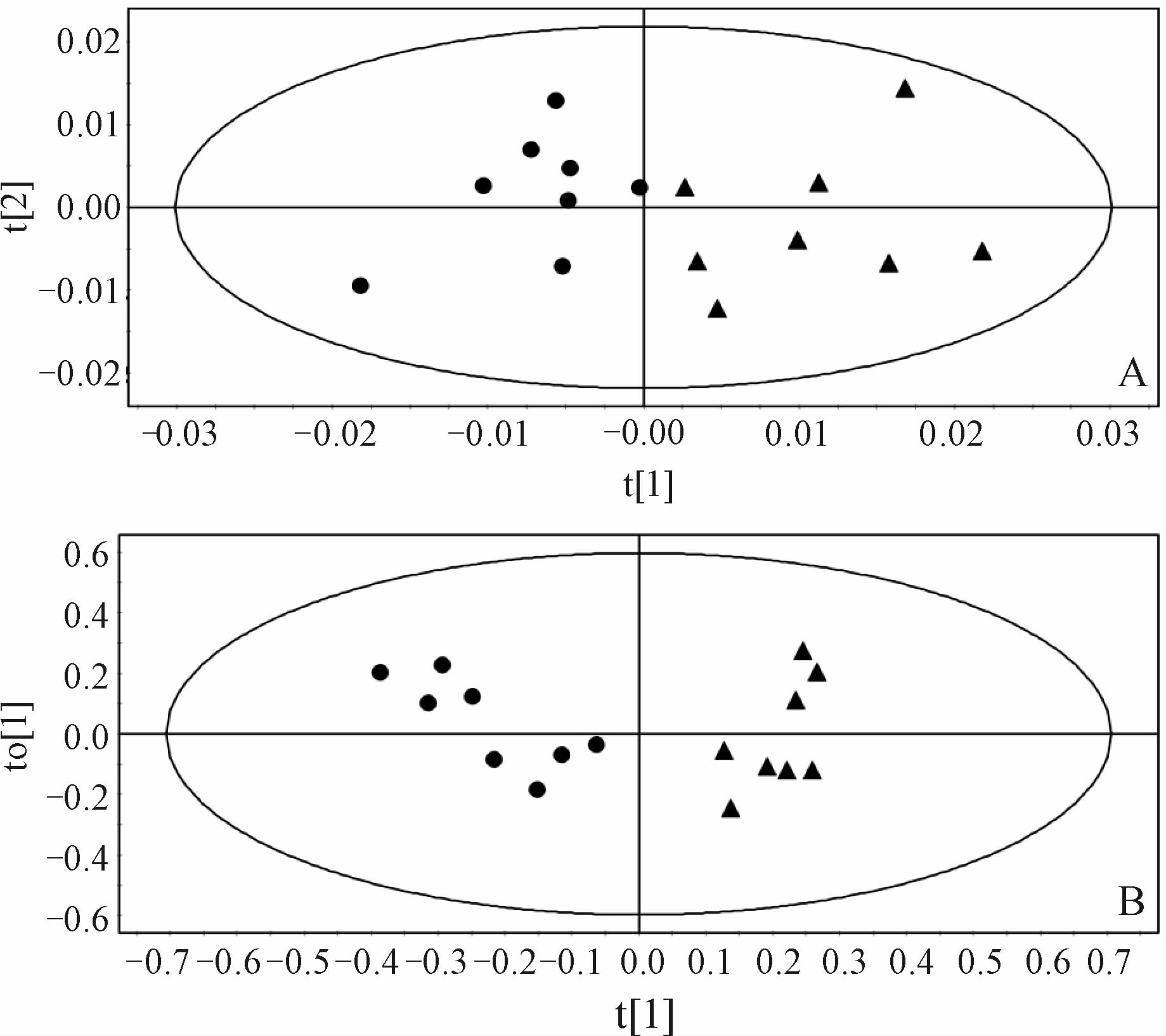
乳腺纤维腺瘤患者和浸润性导管癌患者血清1HCPMG 谱的PCA得分图(t[ 1 ] vs t[ 2 ],R2=97.2%,Q2=76.9%)见图 2A,OPLS-DA得分图(R2X=47.7%,R2Y = 78.0%,Q2=50.6%)见图 2B。由图 2可见,乳腺纤维腺瘤患者和浸润性导管癌患者血清样本在t[ 1 ]维可以完全区分开,且对每组样本的t[ 1 ]值进行统计分析显示这两组样本在t[ 1 ]维差异有统计学意义(P<0.01)。
|
图 2 乳腺纤维腺瘤患者(●)和浸润性导管癌患者(▲)血清的PCA (A) 和OPLS-DA (B)模式分析 Fig 2 PCA (A) and OPLS-DA analysis (B) of sera of breast fibroadenoma patients (●) and breast invasive ductal carcinoma patients (▲) |
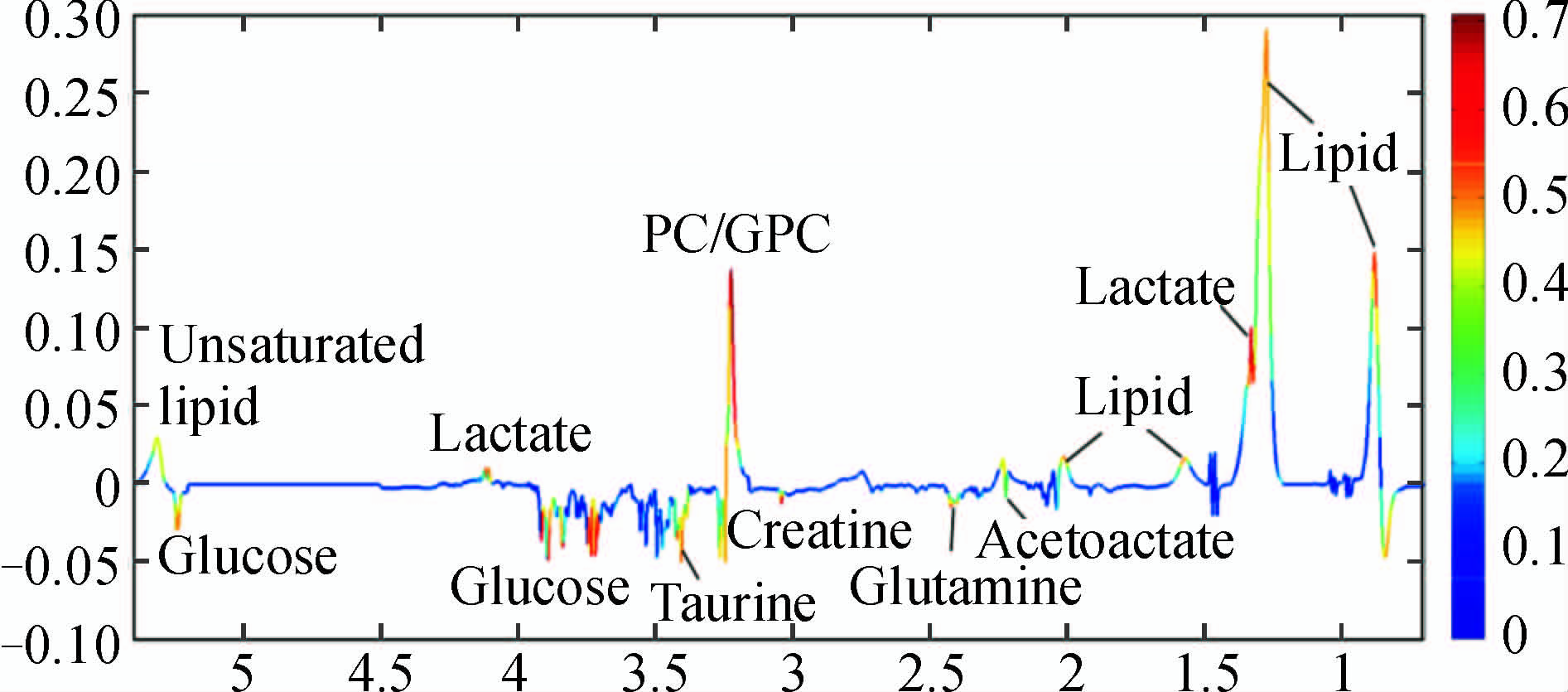
从PCA和OPLS-DA结果可以看出乳腺纤维腺瘤与乳腺浸润性导管癌在血清代谢组学上有明显差异,通过OPLS-DA中相关系数编码的负载图结果可以得出对此区分有特别贡献的代谢物。从图 3 可以看出,与乳腺纤维腺瘤患者相比,浸润性导管癌患者血清中脂质、乳酸盐、磷脂酰胆碱/甘油磷脂酰胆碱和不饱和脂肪酸的含量升高,而谷氨酰胺、乙酰乙酸、肌酸、牛磺酸和葡萄糖的含量降低。
|
图 3 乳腺纤维腺瘤和乳腺浸润性导管癌患者血清1HCPMG的OPLS-DA负载图 Fig 3 Coefficient-coded loading line plots of OPLS-DA on serum 1HCPMG spectra of sera of breast fibroadenoma and breast invasive ductal carcinoma patients PC/GPC: Phosphocholine/glycerolphosphocholine |
通过SPSS 19.0软件对OPLS-DA分析中筛选出的代谢物进行统计学t检验,其中有统计学差异的包括脂质、乳酸盐、葡萄糖、磷脂酰胆碱/甘油磷脂酰胆碱、谷氨酰胺、牛磺酸和肌酸(图 4)。

|
图 4 乳腺纤维腺瘤患者与乳腺浸润性导管癌患者血清中几种代谢物相对浓度比较
Fig 4 Serum levels of several metabolies in breast fibroadenoma patients and breast invasive ductal carcinoma patients
PC/GPC: Phosphocholine/glycerolphosphocholine. *P<0.05,**P<0.01 vs breast fibroadenoma patients. n=8, ±s ±s
|
3 讨 论
1HNMR的代谢组学能够提供丰富的代谢信息,且能在分子水平上实现肿瘤良恶性的区分。本研究通过对乳腺纤维腺瘤患者与乳腺浸润性导管癌患者血清的代谢组学研究发现,对比乳腺纤维腺瘤患者血清代谢组,乳腺浸润性导管癌患者血清中葡萄糖、肌酸、牛磺酸和谷氨酰胺的含量明显降低,而脂类物质、乳酸盐和磷脂酰胆碱/甘油磷脂酰胆碱则明显升高,所以两种疾病在血清代谢组上具有明显的代谢差异。
脂类物质的含量变化在很多肿瘤相关疾病的代谢组学研究中均有报道[ 11,12,13 ],说明脂代谢在肿瘤的发生发展过程中发挥重要作用。在大多数肿瘤中,脂类物质的含量都是升高的,如肺癌组织[ 14 ]、肾小细胞癌[ 15 ]等,而在少数肿瘤如骨肉瘤[ 16 ]中脂质的含量则是减少的。脂类物质作为一种贮能载体,在乳腺浸润性导管癌中其含量的增加可能说明在恶性肿瘤体内需要更多的能量供应以适应机体的需求,同时也可能是其他代谢途径向脂代谢途径转化加快。本研究还发现磷脂酰胆碱/胆碱含量升高,这与食管癌中的研究结果一致[ 17 ]。磷脂酰胆碱和胆碱存在于细胞膜上的磷脂,常被认为是细胞增殖的指标。乳腺浸润性导管癌患者血清中磷脂酰胆碱/甘油磷脂酰胆碱的升高可能意味着其细胞增殖更多,肿瘤恶化程度更高。
此外,我们发现在乳腺浸润性导管癌患者血清中葡萄糖的含量降低,而乳酸的含量升高。糖代谢是最常见的代谢特征之一。研究表明,即使在氧气充足的情况下,癌细胞也是更倾向于通过糖酵解途径产生ATP,而不是通过氧化磷酸化途径,这就是Warburg effect[ 18 ]。而在无氧条件下,糖酵解则更可能发挥其供能优势。所以,我们检测到的葡萄糖是降低的,而乳酸含量升高。同时,可能是由于在糖酵解过程中产生的能量远少于需要消耗的能量,为了保证糖酵解途径继续进行,肌酸作为机体内另一种能量储备也开始启动供能,因此在血清中我们检测到的肌酸含量是降低的。
本研究还发现牛磺酸的含量在浸润性导管癌患者血清中有一定程度的降低。有研究报道牛磺酸是在乳腺癌疾病研究中发现的一个新的代谢标记物[ 19 ]。牛磺酸是抗氧化剂,作为一种保护因子,它的含量降低可能也说明机体正受肿瘤侵袭,而且肿瘤恶性程度越高,其含量也越低。还有研究指出牛磺酸参与体内渗透压的调节[ 17 ],其含量降低也可能提示渗透压调节出现异常。此外,在浸润性导管癌患者血清中,谷氨酰胺的含量也是降低的,它是肿瘤生长所必需的氨基酸,是其重要氮源和能源物质,并优先为肿瘤细胞所摄取[ 20 ],谷氨酰胺含量的降低也可能说明肿瘤恶性化程度增高。
基于NMR和模式识别的代谢组学方法能够给出乳腺纤维腺瘤和乳腺浸润性导管癌患者血清的代谢差异以及可能涉及到的代谢通路改变。这些有显著变化的代谢物将可能作为潜在代谢标记物,从分子水平更好地区分良恶性肿瘤,这为乳腺肿瘤的区分诊断提供了一种无创性的分子依据。后期我们将继续扩大样本量,进一步验证潜在代谢标记物的诊断和预测意义。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Yiangou C, Shousha S, Sinnett H D.Primary tumor characteristics and axillary lymph node status in breast cancer[J].Bri J Cancer, 1999, 80:1974-1978. |
| [2] | 高道利, 王文婉, 郁领娣, 胡永伟, 陆重志, Thomas D B, 等.1544 例乳腺浸润性导管癌临床特点和生存率的多因素分析[J].肿瘤, 2005, 25:144-147. |
| [3] | 周明华.乳腺浸润性导管癌与乳腺纤维腺瘤的超声鉴别诊断分析[J].中国卫生产业, 2012, 8:128. |
| [4] | 高 勃.乳腺浸润性导管癌和纤维腺瘤的超声诊断[J].中国现代医生, 2013, 51:61-62. |
| [5] | 赵 林, 赵 杨, 张 斌, 徐惠绵.乳腺癌钼靶X线检查钙化表现的组织病理学特征[J].中国肿瘤, 2008, 17:157-158. |
| [6] | 龚良庚, 程流泉.乳腺非肿块性浸润性导管癌的MRI诊断[J].中国医学影像学杂志, 2011, 19:601-604. |
| [7] | Arteaga de Castro C S, van den Bergen B, Luijten P R, van der Heide U A, van Vulpen M, Klomp D W.Improving SNR and B1 transmit field for an endorectal coil in 7 T MRI and MRS of prostate cancer[J].Magn Reson Med, 2012, 68:311-318. |
| [8] | Canese R, Pisanu M E, Mezzanzanica D, Ricci A, Paris L, Bagnoli M, et al.Characterisation of in vivo ovarian cancer models by quantitative 1H magnetic resonance spectroscopy and diffusion-weighted imaging[J].NMR Biomed, 2012, 25:632-642. |
| [9] | Kim M J, Lee S J, Lee J H, Kim S H, Chun H K, Kim S H, et al.Detection of rectal cancer and response to concurrent chemoradiotherapy by proton magnetic resonance spectroscopy[J].Magn Reson Imaging, 2012, 30:848-853. |
| [10] | 黎 莉, 罗国安, 卢传坚, 尹芝南, 韩 凌, 李莎莎.基于UPLC/MS 技术的乳腺癌血清代谢组学研究[J].现代肿瘤医学, 2011, 19:2361-2365. |
| [11] | Tate A R, Crabb S, Griffiths J R, Howells S L, Mazucco R A, Rodrigues L M, et al.Lipid metabolite peaks in pattern recognition analysis of tumour in vivo MR spectra[J].Anticancer Res, 1996, 16:1575-1579. |
| [12] | Mountford C E, Wright L C.Organization of lipids in the plasma membranes of malignant and stimulated cells:a new model[J].Trends Biochem Sci, 1988, 13:172-177. |
| [13] | Callies R, Sri-Pathmanathan R M, Ferguson D Y, Brindle K M.The appearance of neutral lipid signals in the 1H NMR spectra of a myeloma cell line correlates with the induced formation of cytoplasmic lipid droplets[J].Magn Reson Med, 1993, 29:546-550. |
| [14] | Chen W, Zu Y, Huang Q, Chen F, Wang G, Lan W, et al.Study on metabonomic characteristics of human lung cancer using high resolution magic-angle spinning 1H NMR spectroscopy and multivariate data analysis[J].Magn Reson Med, 2011, 66:1531-1540. |
| [15] | Gebhard R L, Clayman R V, Prigge W F, Figenshau R, Staley N A, Reesey C, et al.Abnormal cholesterol metabolism in renal clear cell carcinoma[J].J Lipid Res, 1987, 28:1177-1184. |
| [16] | Zhang Z, Qiu Y, Hua Y, Wang Y, Chen T, Zhao A, et al.Serum and urinary metabonomic study of human osteosarcoma[J].J Proteome Res, 2010, 9:4861-4688. |
| [17] | Yang Y, Wang L, Wang S, Liang S, Chen A, Tang H, et al.Study of metabonomic profiles of human esophageal carcinoma by use of high-resolution magic-angle spinning 1H NMR spectroscopy and multivariate data analysis[J].Anal Bioanal Chem, 2013, 405:3381-3389. |
| [18] | Warburg O.On the origin of cancer cells[J].Science, 1956, 123:309-314. |
| [19] | El Agouza I M, Eissa S S, El Houseini M M, El-Nashar D E, Abd El Hameed O M.Taurine:a novel tumor marker for enhanced detection of breast cancer among female patients[J].Angiogenesis, 2011, 14:321-330. |
| [20] | 毕 胜, 刘宏鸣.谷氨酰胺在肿瘤细胞中的代谢及意义[J].海南医学院学报, 2009, 15:1340-1342. |
 2014, Vol. 35
2014, Vol. 35


