肾上腺脑白质营养不良(adrenoleukodystrophy,ALD)是一种最常见的过氧化物酶体病,呈X连锁遗传。该疾病基因——ABCD1基因定位于Xq28,编码的蛋白质称为肾上腺脑白质营养不良蛋白(adrenoleukodystrophy protein,ALDP)。ABCD1基因突变引起ALDP结构改变或功能缺陷,使患者体内极长链饱和脂肪酸(very long chain fatty acids,VLCFAs)不能进入过氧化物酶体进行β-氧化,从而在不同组织和体液中蓄积,引起神经系统脱髓鞘和肾上腺皮质功能减退等病理改变[ 1,2 ]。本研究通过构建野生型及突变型ABCD1基因的重组慢病毒,并检测ALDP在慢病毒感染宿主细胞中的表达及亚细胞定位,为探讨ABCD1基因突变对ALDP结构和功能的影响以及寻求基因治疗策略奠定基础。 1 材料和方法 1.1 材料
慢病毒载体质粒pLEX-MCS、包装质粒pMD2.G、psPAX2由福州总医院泌尿外科实验室王水良博士赠送;大肠杆菌DH5α、XL1-Blue和293A及293T细胞为本实验室保存;限制性核酸内切酶(NotⅠ、MluⅠ、DpnⅠ)购自NEB公司;聚乙烯亚胺(PEI)购自上海源叶生物科技有限公司;质粒抽提试剂盒购自Omega公司;DNA凝胶回收试剂盒购自北京康为世纪生物科技有限公司;小鼠抗人ALDP单克隆抗体购自Chemicon公司;兔抗人过氧化氢酶多克隆抗体购自Santa Cruz公司;FITC标记山羊抗小鼠IgG、TRITC标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司。引物合成、测序均由上海生工生物工程技术有限公司完成。
1.2 突变序列的生物信息学分析
采用ClustalW2进行ALDP物种间同源基因多序列比对;采用PhD-SNP[ 3 ]、PolyPhen[ 4 ]、SIFT[ 5 ]等不同算法预测ALDP氨基酸改变与疾病的关系;采用Eris[ 6 ]、I-Mutant[ 7 ]、PoPMuSiC[ 8 ]等不同算法预测ALDP氨基酸改变对蛋白质结构稳定性的影响。 1.3 PCR获取目的基因片段
使用正常人ABCD1 cDNA为模板,设计一对引物,其引物序列为:上游(P201):5′-ATT T GC GGC CGC ATG CCG GTG CTC TCC AGG CCC CGG-3′,划线处为NotⅠ(GC↓GGCCGC)酶切识别位点;下游(P202):5′-CG A CGC GT T CAG GTG GAG GCA CCC TGG AGG CCA CC-3′,划线处为MluⅠ(A↓CGCGT)酶切识别位点。PCR条件:95℃预变性2 min;98℃20 s,72℃2 min 30 s,共30个循环;72℃延伸5 min。琼脂糖凝胶电泳检测PCR结果。 1.4 野生型重组质粒pLEX-ABCD1的构建
NotⅠ、MluⅠ双酶切载体质粒pLEX-MCS及目的基因PCR产物,琼脂糖凝胶电泳回收纯化目的片段。T4 DNA连接酶作用下将双酶切后的ABCD1基因片段与载体质粒16℃连接过夜。CaCl2法转化感受态DH5α菌,涂布含氨苄青霉素的LB选择平板,37℃孵箱过夜。次日随机挑取阳性菌落继续扩增,小量抽提质粒。抽提的质粒一部分经NotⅠ、MluⅠ双酶切,琼脂糖凝胶电泳检测;一部分送上海生工生物工程技术有限公司进行测序鉴定。 1.5 突变型重组质粒的构建
合成定点诱变引物,序列: H283R上游5′-AAG GGG GAG TAC ATG C G C TCG CGT GTG GTG GCC-3′,下游5′-GGC CAC CAC ACG CGA G C G CAT GTA CTC CCC CTT-3′;P534R上游5′-GGT GTG CTC TAC AAG C G C CCA CCC CAG CGC ATG-3′,下游5′-CAT GCG CTG GGG TGG G C G CTT GTA GAG CAC ACC-3′,划线处为诱变的碱基。以已经测序证实ABCD1基因编码区序列完全正确的重组质粒为模板,加入诱变引物,PCR条件:95℃预变性2 min;98℃20 s,70℃20 s,72℃11 min,共20个循环;72℃延伸7 min。扩增重组质粒全长,分别命名为pLEX-ABCD1-H283R和pLEX-ABCD1-P534R。用DnpⅠ内切酶除去野生型的重组质粒模板。重组突变载体转化使用XL1-Blue感受态细胞,突变型重组质粒的鉴定方法同野生型重组质粒。 1.6 重组慢病毒包装及病毒液收集
将pLEX-ABCD1、pLEX-ABCD1-H283R、PLEX-ABCD1-P534R和pLEX-MCS质粒分别与pMD2.G、psPAX2质粒混合,PEI法转染293T细胞。转染48、72和96 h后分别收获含病毒的上清:将培养液移至无菌离心管中,1 500 r/min离心5 min,沉淀细胞碎片,再用孔径为0.45 μm的一次性细胞滤器过滤去除所有的细胞及碎片,收集慢病毒上清液。 1.7 病毒感染宿主细胞及RT-PCR检测
ABCD1 mRNA表达病毒感染293A细胞48 h,实验共分5组:pLEX-ABCD1野生型组、pLEX-ABCD1-H283R突变型组、pLEX-ABCD1-P534R突变型组、pLEX-MCS空载体组及空白未感染组。将病毒液加入DMEM高糖培养液中,制备的混合液直接加入含293A细胞的培养板中。用TRIzol法提取未感染和慢病毒感染细胞的总RNA,反转录成cDNA。ABCD1 RT-PCR引物序列:上游5′-ACT GGC CCT GTC GTT CCG-3′;下游:5′-GTT GCG GGC AAT AGT GAA G-3′;内参照GAPDH引物序列:上游5′-GAG TCA ACG GAT TTG GTC GT -3′,下游5′-TTG ATT TTG GAG GGA TCT CG-3′。按照TaKaRa公司试剂盒说明进行实时荧光定量PCR,采用2-ΔΔCt方法计算基因相对表达。 1.8 免疫荧光及蛋白质免疫印迹检测目的蛋白表达
免疫荧光观察ALDP亚细胞定位:病毒感染48 h的细胞通过洗涤、固定、通透、封闭后,加入兔抗人过氧化氢酶多克隆抗体(1∶200)和小鼠抗人ALDP单克隆抗体(1∶2 000),室温反应3 h,洗涤后再加入羊抗兔IgG-TRITC(1∶500)和羊抗鼠IgG-FITC(1∶100)二抗,37℃避光孵育1 h,激光共聚焦显微镜观察目的蛋白表达。
蛋白质免疫印迹检测ALDP的表达:用含1% PMFS的蛋白裂解液提取5组病毒感染细胞的总蛋白,BCA蛋白定量试剂盒(碧云天p0012)测定蛋白浓度。从不同样品中取出等量蛋白与5×SDS蛋白上样缓冲液混合,并于100℃变性30 min后,各取20 μL进行10% SDS-PAGE。将蛋白转移至PVDF膜上,封闭后加入抗β-actin抗体(1∶1 000)、小鼠抗ALDP单克隆抗体(1∶2 000)与相应的膜共同孵育,洗膜。加入二抗,显色、曝光、显影定影。 1.9 统计学处理
应用SPSS 15 统计软件进行分析,计量资料以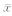 ±s表示,多样本均数比较采用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
2 结 果
2.1 突变序列的生物信息学分析
±s表示,多样本均数比较采用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
2 结 果
2.1 突变序列的生物信息学分析
选择单细胞生物到多细胞生物、低等脊椎动物,再到高等哺乳动物中的几种进化代表性生物,包括酵母、蠕虫、果蝇、斑马鱼、狗、牛、褐鼠、小鼠、人,将ALDP序列进行不同物种间蛋白序列比对,结果发现第283位及第534位(图 1)氨基酸残基在进化上绝对保守。通过PhD-SNP、PolyPhen、SIFT国际认可的3种不同算法预测ALDP氨基酸改变与疾病的关系,结果均提示H283R、P534R为致病性突变(表 1)。采用Eris、I-Mutant和PoPMuSiC国际认可的3种不同算法预测ALDP氨基酸残基改变对蛋白质结构稳定性的影响,Eris和I-Mutant两种算法结果提示H283R突变导致蛋白质结构稳定性降低;I-Mutant和PoPMuSiC两种算法结果提示P534R突变导致蛋白质结构稳定性降低(表 2)。综合以上结果,根据“陪审团”原则,认为突变H283R和P534R会降低ALDP结构的稳定性。
|
|
表 1 ALDP突变序列致病性预测 Tab 1 Pathogenicity prediction of adrenoleukodystrophy protein (ALDP) mutants |
|
|
表 2 ALDP突变体结构稳定性预测 Tab 2 Stability prediction of adrenoleukodystrophy protein (ALDP) mutants |

|
图 1 不同物种间ALDP序列比对 Fig 1 Ortholog alignment of adrenoleukodystrophy protein (ALDP) in different species |
ABCD1基因PCR产物经1%琼脂糖凝胶电泳,在2 000~2 500 bp之间出现一条特异性区带,与预期大小(2 258 bp)相符(图 2)。重组质粒经NotⅠ和MluⅠ双酶切后,产生两条带,一条位于10 000~15 000 bp之间,与空载体酶切后片段大小(10 657 bp)相符,另一条位于2 500 bp附近,与目的片段大小(2 258 bp)相符,提示重组质粒含有目的基因ABCD1基因编码区全长,空质粒则未见此条带(图 3)。登录GenBank下载人ABCD1基因cDNA(Z21876)序列,与pLEX-ABCD1测序结果进行比对,可知插入片段读框和方向正确,且酶切位点正确,提示野生型重组载体构建成功。

|
图 2 ABCD1 cDNA的PCR产物电泳图 Fig 2 PCR identification result of ABCD1 cDNA M:DNA marker;1:PCR product of ABCD1 gene |
|
图 3 野生型重组质粒的NotⅠ/MluⅠ酶切鉴定 Fig 3 Restrictive digestion of pLEX-ABCD1 with NotⅠ and MluⅠ M:DNA marker;1,2:pLEX-MCS before and after digestion,resepectively;3,4:pLEX-ABCD1 before and after digestion,resepectively;5:PCR product of ABCD1 |
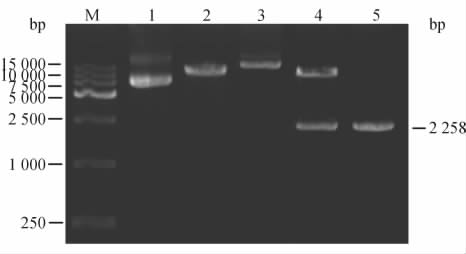
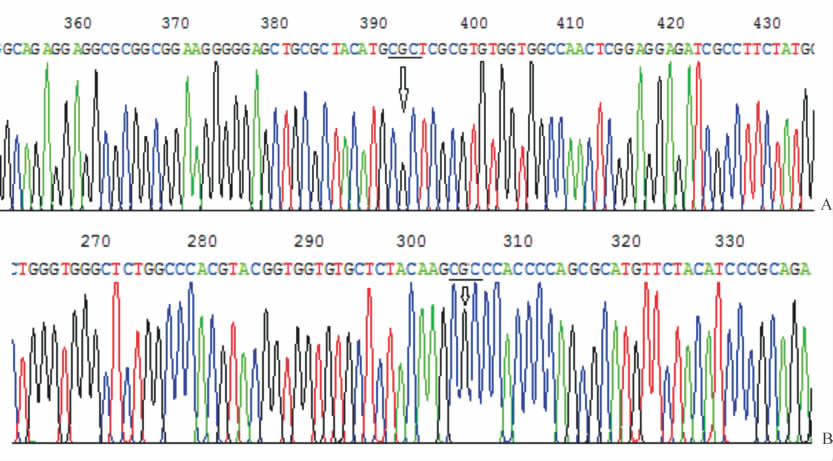
人工诱变的两个PCR产物电泳后,各出现一条特异性区带,位于10 000~15 000 bp之间,与预期的目的片段大小(12 909 bp)相符(图 4)。突变型质粒分别命名为pLEX-ABCD1-H283R和pLEX-ABCD1-P534R。测序结果与人ABCD1基因cDNA序列经DNAMEN软件比对,可知插入片段方向和读框正确,H283R(CAC>CGC)和P534R(CCC>CGC)诱变成功,且从ABCD1基因起始密码子到终止密码子之间未见其他突变(图 5)。
|
图 4 人工诱导突变体的PCR产物电泳图 Fig 4 PCR identification result of induced mutants M:DNA marker;1:pLEX-ABCD1-H283R;2:pLEX-ABCD1-P534R |
|
图 5 突变型重组质粒部分测序结果 Fig 5 Sequencing result of the mutated recombinant plasmids A:pLEX-ABCD1-H283R(CAC>CGC); B:pLEX-ABCD1-P534R(CCC>CGC).The position of mutated codon is underlined and the arrows indicate the mutated bases |
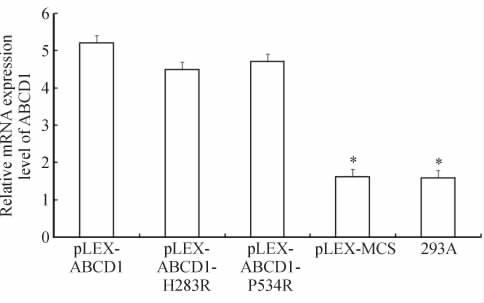
慢病毒感染293A细胞48 h后提取总RNA,经反转录成cDNA后,RT-PCR检测ABCD1 mRNA表达。如图 6所示,野生型(pLEX-ABCD1)及突变型(pLEX-ABCD1-H283R、pLEX-ABCD1-P534R)重组慢病毒感染组的ABCD1 mRNA表达水平高于空载体感染组(pLEX-MCS)和未感染组,表明转录水平野生型及突变型ABCD1过表达成功。
|
图 6 RT-PCR检测慢病毒感染293A细胞ABCD1 mRNA表达
Fig 6 RT-PCR analysis of ABCD1 mRNA expression in lentivirus infected 293A cells
*P<0.05 vs other 3 groups. n=3, ±s ±s
|
激光共聚焦显微镜观察病毒感染后293A细胞中ALDP表达情况及其在细胞中的定位,其中ALDP为绿色荧光标记,过氧化氢酶为红色荧光标记。结果发现,ABCD1野生型重组慢病毒感染的细胞中绿色荧光最强(图 7A),提示野生型ALDP过表达;两组突变型重组慢病毒感染的细胞中绿色荧光明显减弱(图 7B、7C);空载体组与未感染组亦有细胞内源性ALDP表达(图 7D、7E)。定位观察发现,各组细胞中的ALDP绿色荧 光均呈点状分布在胞质中,与过氧化氢酶红色荧光位置基本重合,可重叠呈黄色荧光(图 8)。

|
图 7 免疫荧光法检测ALDP在慢病毒感染293A细胞中的表达 Fig 7 Immunofluorescent analysis of ALDP expression in lentivirus infected 293A cells ALDP: Adrenoleukodystrophy protein. A:pLEX-ABCD1;B:pLEX-ABCD1-H283R;C:pLEX-ABCD1-P534R;D:pLEX-MCS;E:293A. Original magnification: ×200 |

|
图 8 蛋白质免疫荧光法检测ALDP在慢病毒感染293A细胞中的表达与亚细胞定位 Fig 8 Immunofluorescent analysis of expression and subcellular localization of ALDP in lentivirus infected 293A cells ALDP: Adrenoleukodystrophy protein. Original magnification: ×400 |
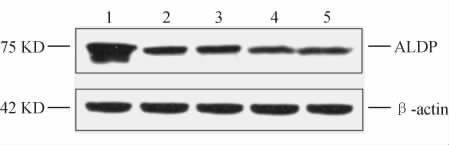
如图 9所示,野生型或突变型重组慢病毒感染293A细胞后进行蛋白质免疫印迹分析,结果可见:野生型ABCD1过表达慢病毒组的印迹条带最明显,说明构建的野生型ABCD1慢病毒载体可高效表达ALDP,而突变型(pLEX-ABCD1-H283R、pLEX-ABCD1-P534R)重组慢病毒感染组ALDP表达量明显低于野生型组;空载体感染组(pLEX-MCS)及未感染组亦有细胞内源性ALDP表达,且条带亮度与突变型组无明显差异。
|
图 9 蛋白质免疫印迹法分析ALDP在慢病毒感染293A细胞中的表达 Fig 9 Western blotting analysis of ALDP expression in lentivirus infected 293A cells ALDP: Adrenoleukodystrohy protein. 1:pLEX-ABCD1;2:pLEX-ABCD1-H283R;3:pLEX-ABCD1-P534R;4:pLEX-MCS;5:Non-infected |
人ALDP属于ATP结合盒(ABC)转运蛋白D亚类1号成员(ATP-binding cassette sub-family D member 1,ABCD1),是一种过氧化物酶体膜蛋白。ALDP具备两个核心结构域:1个位于N端的跨膜结构域(transmembrane domain,TMD),包含配体结合位点;1个位于C端的核苷酸结合结构域(nucleotide binding domain,NBD),通过结合和水解ATP为转运VLCFAs提供能量。ALDP首先在游离的多聚核糖体上合成后运送到过氧化物酶体,然后在过氧化物酶体膜上组装成二聚体,负责将胞质中VLCFAs或其衍生物转运到过氧化物酶体内,并在其中进行β-氧化。TMD参与ALDP的定位[ 9 ],还对稳定ALDP同源二聚体具有重要的作用[ 10 ],并含有底物结合位点[ 11 ],该区域的突变可能会影响ALDP定位、二聚体的稳定性或底物的结合与转运;NBD的ATP结合区在VLCFAs的转运过程中起着重要作用,该结构域具有ATP酶活性,通过结合和水解ATP为转运提供能量,NBD保守氨基酸的突变可能引起ATP酶活性的降低或丧失[ 12,13 ]。
根据数据库(www.x-ald.nl)及文献报道,ABCD1基因突变对ALDP的影响主要表现为:70% 以上的ABCD1基因突变导致患者细胞内的ALDP被蛋白酶体降解而无法检测到;另有部分突变尽管不影响ALDP表达量,但ALDP突变体却无法结合或水解ATP[ 13 ]; 部分ALDP突变体无法正确定位至过氧化物酶体膜上[ 9 ];还有部分ALDP突变体可以到达过氧化物酶体膜上,但不能与配体结合,或无法实现二聚体化[ 14,15 ],从而无法发挥其正常的转运功能。
本研究选择课题组发现的国际首报新突变H283R与P534R,H283R位于TMD跨膜α螺旋4和5连结区,P534R位于NBD保守基序Walker A和Walker B的连接区。通过对ALDP物种间的同源基因序列进行多重序列比对,发现预测的两个突变氨基酸均呈高度保守,由此推测突变影响ALDP结构及功能的可能性大。根据PhD-SNP、PolyPhen、SIFT等突变致病性预测的计算结果,推测H283R和P534R为ALD致病性突变。由Eris、I-Mutant和PoPMuSiC等不同算法的结果可知,突变H283R和P534R可能会降低ALDP结构的稳定性,导致蛋白质的正常结构被破坏、蛋白质功能活性降低。
本研究利用分子克隆技术,将野生型ABCD1基因的编码区全长插入到载体pLEX-MCS上,成功构建了ALDP的真核重组载体:pLEX-ABCD1,并选择分别位于ALDP的TMD和NBD的突变:H283R和P534R,通过人工诱导突变获得了这2个突变的真核重组载体:pLEX-ABCD1-H283R和pLEX-ABCD1-P534R。将构建好的质粒连同包装系统的两个质粒共转染293T细胞以包装病毒,病毒液再感染宿主细胞,RT-PCR检测ABCD1 mRNA表达:野生型及突变型感染组ABCD1 mRNA表达均明显高于空载体组及未感染组,提示在转录水平,野生型及突变型慢病毒载体ABCD1过表达成功。免疫荧光及蛋白质免疫印迹结果均显示,野生型ABCD1慢病毒载体可高效过表达ALDP,而两突变型组ALDP的表达量明显低于野生型组,与空载体组及未感染组细胞中内源性ALDP的表达量无明显差异。由此可见,突变型慢病毒载体在ABCD1基因的转录水平和翻译水平的结果不同,即在转录水平ABCD1基因过表达,但在翻译水平并未发现ALDP过表达,其表达量仅相当于细胞内源性ALDP水平。我们初步推测,H283R和P534R突变对ABCD1基因转录影响较小,但可能影响转录后的蛋白质合成,主要表现为相应的ALDP突变体不稳定,易被蛋白酶体水解,从而难以甚至无法检测到,因此突变组检测到的ALDP可能主要是细胞内源性ALDP。进一步的ALDP亚细胞定位结果发现,将过氧化氢酶作为定位标志,野生型及两突变型细胞中的ALDP与过氧化氢酶荧光表达位置重合,提示共定位于过氧化物酶体,由此可以推测这两个突变并未导致ALDP定位改变。
ALDP突变体的功能学研究是探讨X-ALD发病机制的重要部分,本研究为进一步研究ABCD1基因突变对ALDP的影响奠定了实验基础,也将为利用慢病毒载体进行基因治疗提供实验依据。本课题组仍在不断优化实验步骤,希望得到更高滴度的病毒,同时也将继续补充与完善相关实验,如增加ABCD1基因突变研究的数量及类型(本课题组已发现10个国际首报错义突变),并进一步拓展ALDP功能学研究,如测定ALDP突变体的ATP酶活性、找到蛋白酶体水解ALDP突变体的直接证据等。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Kemp S, Berger J, Aubourg P.X-linked adrenoleu kodystrophy: clinical, metabolic, genetic and pathophysiological aspects[J].Biochim Biophys Acta, 2012, 1822:1465-1474. |
| [2] | Moser H W, Mahmood A, Raymond G V.X-linked adrenoleukodystrophy[J].Nat Clin Pract Neurol, 2007, 3:140-151. |
| [3] | Capriotti E, Calabrese R, Casadio R.Predicting the insurgence of human genetic diseases associated to single point protein mutations with support vector machines and evolutionary information[J].Bioinformatics, 2006, 22:2729-2734. |
| [4] | Ramensky V, Bork P, Sunyaev S.Human non-synonymous SNPs:server and survey[J].Nucleic Acids Res, 2002, 30:3894-3900. |
| [5] | Ng P C, Henikoff S.SIFT:predicting amino acid changes that affect protein function[J].Nucleic Acids Res, 2003, 31:3812-3814. |
| [6] | Yin S, Ding F, Dokholyan N V.Eris:an automated estimator of protein stability[J].Nat Methods, 2007, 4:466-467. |
| [7] | Capriotti E, Fariselli P, Casadio R.I-Mutant2.0:predicting stability changes upon mutation from the protein sequence or structure[J].Nucleic Acids Res, 2005, 33(Web Server Issue):W306-W310. |
| [8] | Dehouck Y, Grosfils A, Folch B, Gilis D, Bogaerts P, Rooman M.Fast and accurate predictions of protein stability changes upon mutations using statistical potentials and neural networks:PoPMuSiC-2.0[J].Bioinformatics, 2009, 25:2537-2543. |
| [9] | Takahashi N, Morita M, Maeda T, Harayama Y, Shimozawa N, Suzuki Y, et al.Adrenoleukodystrophy:subcellular localization and degradation of adrenoleukodystrophy protein (ALDP/ABCD1) with naturally occurring missense mutations[J].J Neurochem, 2007, 101:1632-1643. |
| [10] | Hillebrand M, Verrier S E, Ohlenbusch A, Schäfer A, Söling H D, Wouters F S, et al.Live cell FRET microscopy:homo-and heterodimerization of two human peroxisomal ABC transporters, the adrenoleukodystrophy protein (ALDP, ABCD1) and PMP70 (ABCD3)[J].J Biol Chem, 2007, 282:26997-27005. |
| [11] | Loo T W, Clarke D M.Recent progress in understanding the mechanism of P-glycoprotein-mediated drug efflux[J].J Membr Biol, 2005, 206:173-185. |
| [12] | Roerig P, Mayerhofer P, Holzinger A, Görtner J.Characterization and functional analysis of the nucleotide binding fold in human peroxisomal ATP binding cassette transporters[J].FEBS Lett, 2001, 492(1-2):66-72. |
| [13] | Grtner J, Dehmel T, Klusmann A, Roerig P.Functional characterization of the adrenoleukodystrophy protein (ALDP) and disease pathogenesis[J].Endocr Res, 2002, 28:741-748. |
| [14] | Liu L X, Janvier K, Berteaux-Lecellier V, Cartier N, Benarous R, Aubourg P.Homo-and heterodimerization of peroxisomal ATP-binding cassette half-transporters[J].J Biol Chem, 1999, 274:32738-32743. |
| [15] | van Roermund C W, Visser W F, Ijlst L, van Cruchten A, Boek M, Kulik W, et al.The human peroxisomal ABC half transporter ALDP functions as a homodimer and accepts acyl-CoA esters[J].FASEB J, 2008, 22:4201-4208. |
 2014, Vol. 35
2014, Vol. 35


