2. 第四军医大学西京医院麻醉科, 西安 710032
2. Department of Anesthesiology, Xijing Hospital, Fourth Military Medical University, Xi'an 710032, Shaanxi, China
胍丁胺(agmatine)是咪唑啉受体(imidazoline receptor,IR)的内源性配体,在中枢神经系统内广泛存在,可作用于咪唑啉受体和α-肾上腺素受体,并且可能与阿片、N-甲基-D-天冬氨酸(NMDA)受体相互作用,因此被认为是一种新的神经递质和(或)神经调质[1]。研究表明,胍丁胺本身具有弱镇痛作用,虽然不延长吗啡的作用时间,但可增强吗啡的镇痛效应;同时其还可抑制吗啡所致小鼠耐受和依赖的形成,减轻吗啡依赖小鼠由纳洛酮所诱发的某些戒断表现,抑制戒断综合征的发生[2,3,4],对预防和治疗阿片类药物(如吗啡)所致的耐受与身体依赖具有明显的作用。但目前关于椎管内应用胍丁胺加强镇痛,减轻吗啡的耐受和依赖尚缺乏系统的研究。本研究通过大鼠在体实验,探讨胍丁胺作为椎管内阿片类药物辅助药的可行性。
1 材料和方法 1.1 动物及药品清洁级雄性SD大鼠,体质量(200±20) g,由第四军医大学实验动物中心提供[实验动物生产许可证号:SCXK(军)2008-016)]。盐酸吗啡(批号:910907)购自青海制药厂有限公司;胍丁胺(批号:57H1361)、蜜蜂毒(bee venom,BV)均购自美国Sigma公司。 1.2 大鼠BV模型的制备及处理 取SD大鼠24只,分为4组,每组6只:鞘内注射生理盐水(15 μL)对照组;鞘内注射吗啡(15 μg/15 μL)组;鞘内给予胍丁胺(12.5 μg/15 μL)组;鞘内同时给予吗啡(15 μg/5 μL)+胍丁胺(12.5 μg/10 μL)组。所有大鼠均于鞘内给药后5 min于跖部皮下注射50 μL (0.2 mg) BV 致痛,观察并记录1 h内大鼠的自发缩足反射次数。 1.3 大鼠鞘内吗啡耐受模型的制备及处理
取SD大鼠24只,分为3组,每组8只:鞘内生理盐水(15 μL)对照组;鞘内吗啡耐受组,每天2次(上午6:00和下午6:00)鞘内注射吗啡(15 μg/5 μL)+0.9%氯化钠注射液10 μL,连续4 d;鞘内吗啡耐受+胍丁胺组,每天2次鞘内注射吗啡(15 μg/5 μL)+0.9%氯化钠注射液10 μL,连续3 d后,于第4天开始鞘内注射吗啡(15 μg/5 μL)+胍丁胺(12.5 μg/10 μL)。每次给药10 min后测大鼠热刺激潜伏期和机械刺激阈值。3 d后大鼠热刺激潜伏期显著缩短、机械刺激阈值显著降低,即可认为大鼠对吗啡产生耐药。
1.4 大鼠鞘内吗啡耐受BV致痛模型的制备及处理取SD大鼠24只,分为3组,每组8只:鞘内生理盐水对照组;鞘内吗啡耐受组;鞘内吗啡耐受+胍丁胺组。前4 d处理同上述1.3项下方法;第4天各组大鼠于鞘内给药后10 min足底皮下注射50 μL (0.2 mg) BV致痛,观察并记录1 h内大鼠的自发缩足反射次数。
1.5 鞘内置管术按Yaksh等[5]首先报道的鞘内置管方法进行改良。大鼠经2%戊巴比妥钠(40~50 mg/kg)麻醉后,剪去背侧毛发,用碘伏消毒后,从背侧颈7水平沿中线向尾侧切开皮肤、皮下组织、肌肉,暴露并去除胸4局部椎板(约1 mm×1 mm),剪开硬脊膜,经鞘内向尾侧置入聚乙烯PE10导管(日本Natume公司),根据动物大小确定置入导管至腰膨大处的距离(3~5 cm),实验后解剖动物确定鞘内导管的位置。经导管外口注入0.1 mL生理盐水,破口处有气泡及脑脊液溢出,证明导管已在蛛网膜腔,封外口。外露部分固定于肌肉、皮肤,并缝合伤口,局部使用庆大霉素抗感染。术后3~4 d,观察动物状态良好、无活动障碍,进行实验。
1.6 大鼠自发痛反应测量将一透明有机玻璃箱(30 cm×30 cm×30 cm)放置于高于实验台30 cm的架子上,以便观察动物后足的活动。实验前动物均在实验箱中适应30 min以上,使之逐渐安静,实验者一人固定大鼠,另一人将微量注射器连接鞘内导管外口,以0.5 μL/s的速度推注吗啡或胍丁胺,然后用10 μL生理盐水冲洗导管,封闭管口防止液体外漏,5 min后重新固定大鼠,尽快将50 μL (0.2 mg) BV注入大鼠一侧后肢足底中心皮下,然后将大鼠放回实验箱,开始计时,观察并记录1 h内大鼠的自发缩足反射次数。
1.7 大鼠机械痛阈值和热刺激潜伏期的测定 1.7.1 大鼠机械痛阈的测定将一透明有机玻璃箱(30 cm×30 cm×30 cm)放置于顶部为铁丝网的30 cm高的架子上,待测大鼠置于箱中,待大鼠适应并安静后,实验者手持Von Frey纤维(加拿大North Coast Medical公司)穿过铁丝网格垂直刺激大鼠后肢足底正中足掌部,使之稍成S形,持续4~6 s。大鼠在刺激时间内或在移开Von Frey纤维时立即出现快速的抬足反应,记为阳性反应,而身体活动所引起的抬足反应则不纳入阳性范畴。每隔10 s测一次,连续10次,诱发≥5次抬足的Von Frey纤维对应的压力值作为50%的机械抬足阈值,即机械痛阈。最大折力为20 g,大于此值时记为20 g。
1.7.2 热刺激反应潜伏期的测定将大鼠分别置于顶端敞开,底部为5 mm厚玻璃板的透明有机玻璃箱(30 cm×30 cm×30 cm)中,放置于高于实验台30 cm的架子上以便观察。大鼠在盒内的一定范围可以自由活动,待大鼠适应环境并安静后,调节RTY-1型自动热刺激仪(西安峰岚仪器厂)的辐射灯源,使之以一定距离从玻璃板底面垂直对准大鼠一侧后肢跖部中后1/3处,且落在足底的照射光圈直径为5 mm。记录从开始照射至出现缩足逃避反射时间,即为热刺激反应潜伏期(单位:s)。重复测量3次,同一部位间隔10 min,不同部位间隔5 min,取平均值作为热刺激反应潜伏期并作为定量指标。如>30 s无反应则停止照射,以免导致足底组织过度热损伤,将其热刺激反应潜伏期计为30 s。
每只大鼠在用药前1 d先测定热痛阈潜伏期作为基础热痛阈值(单位:s),大鼠用药前后各测定热刺激潜伏期3次,取均值,即为用药前后热痛阈值。测量结果用最大镇痛效应百分比(percentage of maximal possible effect,MPE%)表示,MPE%=[(用药后痛阈潜伏期-用药前痛阈潜伏期)/(光照截止时间30 s-用药前痛阈潜伏期)]×100%。
1.8 统计学处理采用SPSS13.0软件进行统计学分析。所有数据均用 x±s表示,组内比较采用t检验,组间比较采用单因素方差分析。应用方差分析(ANOVA Fisher’s PLSD)做统计学处理。检验水准(α)为0.05。
2 结 果 2.1 胍丁胺对鞘内吗啡镇痛的协同作用
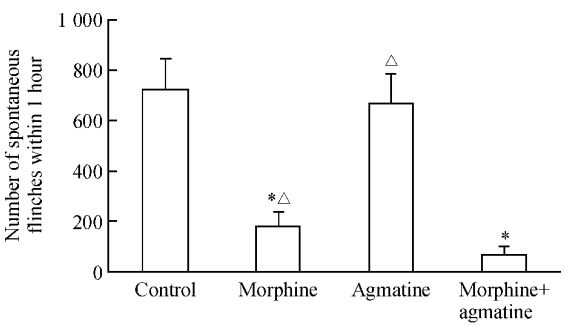
足底注射BV可诱致大鼠产生自发缩足反射,持续近1 h。结果(图 1)显示,与生理盐水对照组比较,鞘内注射吗啡组大鼠1 h内自发缩足反射次数减少(P<0.05),证实鞘内注射吗啡对BV诱致的自发痛具有抑制作用。鞘内给予胍丁胺组大鼠1 h内自发缩足反射次数少于生理盐水对照组,但差异无统计学意义(P>0.05)。鞘内同时给予吗啡+胍丁胺大鼠1 h内自发缩足反射次数进一步减少,与鞘内注射吗啡组和鞘内给予胍丁胺组比较差异均有统计学意义(P<0.05)。结果提示鞘内胍丁胺和吗啡联合用药具有协同效应,可增强吗啡对BV诱致自发痛的抑制作用。
|
图 1 每组大鼠足底注射蜜蜂毒(BV)后1 h内产生自发缩足反射次数 Fig 1 Numbers of spontaneous flinches within 1 hour after injection of bee venom (BV) in the plantar in each group *P<0.05 vs control group; △P<0.05 vs morphine+agmatine group. n=6,x±s |
2.2 胍丁胺对鞘内吗啡基础痛阈耐受的翻转效应
首次鞘内注射吗啡后鞘内吗啡耐受组和鞘内吗啡耐受+胍丁胺组热刺激潜伏期较生理盐水对照组延长,机械刺激阈值也较生理盐水对照组提高 (P<0.05);而给药3 d后,吗啡提高痛阈效应消失,热刺激潜伏期和机械刺激阈值分别降至正常水平,与生理盐水对照组比较差异无统计学意义 (P>0.05),提示吗啡痛阈耐受形成。见表 1、表 2。
|
|
表 1 各组大鼠给药前后热刺激潜伏期及MPE% Tab 1 Change of the thermal paw withdrawal latency and MPE% before and after treatments |
|
|
表 2 各组大鼠每天给药后机械性痛阈值变化 Tab 2 Changes of mechanical pain threshold before and after treatments |
鞘内吗啡耐受+胍丁胺组第4天鞘内注射胍丁胺12 h后,再次给予相同剂量的吗啡,大鼠的热刺激潜伏期和机械性痛阈可再次提高,与第3天相比差异有统计学意义 (P<0.05);MPE%达(80.07±18.39)%,与鞘内吗啡耐受组相比较差异有统计学意义(P<0.05)。提示鞘内胍丁胺给药可显著翻转吗啡的耐受作用。见表 1、表 2。
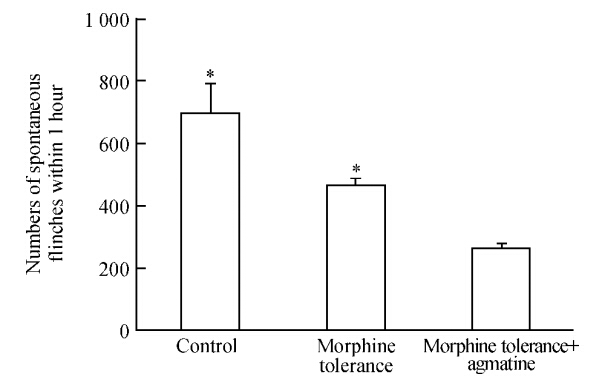
2.3 胍丁胺对鞘内吗啡炎性痛耐受的翻转效应结果(图 2)显示,与生理盐水对照组比较,鞘内吗啡耐受组大鼠连续鞘内注射吗啡4 d后,给大鼠足底注射BV致痛,大鼠1 h内的自发缩足反射次数减少,但差异无统计学意义(P>0 05),提示鞘内吗啡耐受组大鼠鞘内注射吗啡对BV诱发的炎性痛无明显抑制作用。鞘内吗啡耐受+胍丁胺组大鼠足底注射BV后1 h内大鼠的自发缩足反射次数明显减少,与生理盐水对照组和鞘内吗啡耐受组比较差异均有统计学意义 (均P<0 05),提示鞘内给予胍丁胺可翻转吗啡对BV诱致炎性自发痛的耐受。
|
图 2 每组大鼠建立吗啡耐受模型后注射蜜蜂毒(BV) 1 h内自发缩足反射次数 Fig 2 Numbers of spontaneous flinches within 1 hour after injection of bee venom (BV) in morphine tolerance model *P<0.05 vs morphine tolerance+agmatine group. n=8,x±s |
3 讨 论
阿片类药物是目前临床治疗中、重度疼痛最有效的药物,具有一定的不可替代性。但是其不良反应较多,长期使用易导致药物依赖、耐受甚至成瘾。鞘内或硬膜外注射阿片类药物业已成为术后镇痛,缓解恶性、非恶性慢性疼痛的常用方法。鞘内给予阿片类药物具有用量小、不良反应发生率低、镇痛作用持久的优点,但仍有30%~100%的患者因大量和(或)长期使用而发生不同程度的不良反应,易引发阿片耐受,甚至会出现痛觉过敏[6]。要解决此问题,一是研发出理想的强效新型镇痛剂;二是最大限度地降低不良反应的发生及程度。
研究证实胍丁胺可剂量依赖性地增强吗啡的镇痛作用,无论是对炎性疼痛或慢性神经源性疼痛都可产生一定的镇痛效应[7,8]。秦晓辉等[7]采用甲醛致痛模型研究发现,胍丁胺能显著抑制大鼠足底注射甲醛诱致的自发缩足反射次数,并明显增强吗啡的镇痛效果。本研究通过化学物质BV致炎的持续病理性痛模型,观察了吗啡和吗啡联合胍丁胺鞘内注射对BV足底注射诱致自发缩足反射的作用,证实蛛网膜下腔给予胍丁胺能增强脊髓水平吗啡对BV诱致自发痛反应的抑制,与以往研究结果[7]一致。
王秀丽等[8]在神经病理性痛大鼠模型研究中,同样证实胍丁胺具有镇痛作用,而且增强吗啡的镇痛作用,抑制吗啡耐受的形成。另有研究利用神经病理性痛模型发现,胍丁胺能剂量依赖性地增加神经病理性疼痛模型大鼠痛阈,其受体机制可能与NMDA受体有关[4]。也有研究表明,在吗啡慢性耐受模型中,胍丁胺翻转吗啡耐受机制与脊髓和海马组织中 Zn2+含量的减少相关[9]。本研究成功复制吗啡依赖模型,即大鼠每天2次鞘内注射吗啡15 μg/10μ L,连续3 d后吗啡提高热和机械痛阈的效应消失,对大鼠自发缩足反射的抑制不明显。第4天联合应用胍丁胺后发现,吗啡耐受大鼠已降低的热和机械刺激阈值又明显升高,MPE%恢复至(80.07±18.39)%,对BV诱致自发痛的抑制作用也强于吗啡耐受大鼠,提示胍丁胺对大鼠基础痛阈和炎性痛反应的吗啡耐受都具有明显的翻转效应。
我们以往的研究证实:胍丁胺对正常生理情况下离体培养脊神经元的生长不仅无毒副作用,还能抑制谷氨酸诱导的损伤,起到保护神经元的作用[10]。此外,文献证实胍丁胺尚有降低血糖和利尿等多种生物学效应,可能拮抗疼痛所引起的不良应激反应,如高血压、高血糖等[11]。如果胍丁胺作为椎管内阿片类药物辅助药应用于临床,可以协同吗啡的镇痛作用、翻转吗啡耐受,从而减少吗啡的用量、降低长期和(或)大量使用发生的不良反应,同时抑制机体过度应激反应。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Li G, Regunathan S, Barrow C J, Eshraghi J, Cooper R, Reis D J.Agmatine: an endogenous clonidine-displacing substance in the brain[J].Science, 1994, 263:966-969. |
| [2] | Li J, Li X, Pei G, Qin B Y. Effects of agmatine on tolerance to and substance dependence on morphine in mice[J]. Acta Pharm Sin, 1999, 20:232-238. |
| [3] | Regunathan S. Agmatine: biological role and therapeutic potentials in morphine analgesia and dependence[J]. AAPS J, 2006, 8:E479-E484. |
| [4] | Arieioglu F, Korcegez E, Bozkurt A, Ozyalcin S. Effect of agmatine on acute and mononeuropathic pain[J]. Ann N Y Acad Sci, 2003, 1009:106-115. |
| [5] | Yaksh T L, Rudy T A, Chronic catheterization of the spinal subarachnoid space[J].Physiol Behav, 1976, 17:1031-1036. |
| [6] | Pittler M H, Ernst E. Complementary therapies for neuropathic and neuralgic pain: systematic review[J]. Clin J Pain, 2008, 24: 731-733. |
| [7] | 秦晓辉, 苏瑞斌, 吴 宁, 魏晓莉, 张 宏, 李 锦.胍丁胺对炎性疼痛的镇痛作用及对吗啡镇痛作用的影响[J].中国药理学通报, 2006, 22:1070-1074. |
| [8] | 王秀丽, 苏瑞斌, 杨红菊, 吴 宁, 米卫东, 李 锦. 胍丁胺对神经病理性痛大鼠吗啡镇痛作用及耐受的影响[J].中华麻醉学杂志, 2005, 25:584-588. |
| [9] | 叶裕良, 肖亮灿, 莫利求, 赵春梅, 郭瑞鲜, 陈培熹, 等.胍丁胺对吗啡镇痛耐受大鼠脊髓和海马锌含量变化的影响[J]. 解剖学研究, 2011, 33:241-243. |
| [10] | 兰忠平, 杨 浩, 顾 楠, 熊利泽, 孙炎芫.胍丁胺对体外培养脊髓神经元的影响及在谷氨酸诱导损伤条件下的作用[J].生命科学研究, 2008, 12:351-358. |
| [11] | Roerig S C. Spinal and supraspinal agmatine activate different receptors to enhance spinal morphine antinociception[J]. Ann N Y Acad Sci, 2003, 1009: 116-126. |
 2014, Vol. 35
2014, Vol. 35


