2. 三峡大学第二临床医学院妇产科, 宜昌 443001;
3. 三峡大学第一临床医学院妇产科, 宜昌 443003
2. Department of Obstetrics and Gynecology, The Second Clinical Medicine College, China Three Gorges University, Yichang 443001, Hubei, China;
3. Department of Obstetrics and Gynecology, The First Clinical Medical College, China Three Gorges University, Yichang 443003, Hubei, China
世界范围大样本研究表明,几乎所有的宫颈癌及大多数宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)都存在人乳头瘤状病毒(human papillomavirus,HPV)感染[ 1,2 ]。但是从HPV感染到癌变形成需经历一个漫长的过程,大约需要10~20年,且感染多呈潜伏状态,这就为肿瘤的预防提供了充足时机。如果能做到HPV感染的早期检测和HPV预防性疫苗的及时应用,将大大减少宫颈癌的发生率和病死率。
目前,有关宫颈癌及其癌前病变的筛查方法主要是分子生物学检测法,如二代杂交捕获(hybrid captureⅡ,HCⅡ)技术、PCR或基因芯片技术等[ 3,4 ],但这些方法烦琐且价格较高,检测通量不高,同时,因引物扩增型别有限,不能完全识别所有病毒型别。因此,寻求一种高通量、低成本、覆盖型别全面的检测方法很有必要。本课题组前期找到了一段可用于诱导识别所有HPV主要外壳蛋白(major capsid protein,L1)的抗体诱导物,是一段长30个氨基酸残基的多肽,位于HPV L1 C-末端一段高度保守的序列内[ 5,6 ]。以该序列多肽免疫动物,可以诱导动物血清产生高滴度的抗体[ 5,6 ]。本研究旨在进一步验证该序列多肽抗体对临床宫颈标本HPV感染的检测能力,探索研发临床筛查用HPV广谱ELISA试剂盒的可行性。 1 材料和方法 1.1 HPV L1 C-末端共同序列多肽抗体的制备及灵敏度的测定
本课题组委托杭州中肽生化有限公司按HPV16 L1 aa448~477的序列EVNLKEKFSADLDQFPLGRKFLLQAGLKAK合成多肽,相对分子质量3 400,进行钥孔戚血蓝蛋白(keyhole limpet hemocyanin,KLH)偶联。委托杭州华安生物技术有限公司以KLH偶联多肽分别免疫BALB/c小鼠及新西兰大白兔,兔免疫3次、小鼠免疫5次后,分别取抗血清,测定效价。兔多肽抗血清用亲和层析法进行抗体纯化,纯化后的抗体用ELISA法测定其效价,然后分装、冻干备用。小鼠多肽抗血清直接保存备用。
采用生物素-亲和素ELISA法[ 7 ]对HPV L1 C-末端共同序列多肽抗体的灵敏度进行检测。首先将多肽稀释浓度为1 mg/mL,再稀释为5个不同滴度:1∶100、1∶500、1∶1 000、1∶2 000和1∶5 000,分别包被;分析结果,确定阴性和阳性结果分界的两个滴度。再将这两个滴度据实际情况稀释成5个滴度,再次进行包被。依此类推,最终找到应用ELISA方法时,该多肽抗体能够被检测到的最少的多肽的量。 1.2 标本采集
标本均来自三峡大学第二临床医学院病理科。收集2010年3月至5月进行宫颈薄层液基细胞学检查的剩余宫颈脱落细胞标本,均达到满意标本量。所有标本均来自妇科门诊首诊患者,均于4℃保存,并一式两份,一份用于巢式-PCR(Nest-PCT)检测,一份用于夹心法ELISA检测,细胞学阳性者分别标记。于1周内分别提取总DNA和总蛋白,-20℃保存。阳性对照使用CaSki细胞[ 8 ](人宫颈鳞状上皮细胞癌细胞系,含HPV16病毒整合及游离基因组),阴性对照使用HaCaT细胞(人永生化角质形成细胞系,HPV阴性)。对照物细胞均购自武汉大学中国典型培养物保藏中心。 1.3 宫颈脱落细胞标本Nest-PCR检测
收集标本中宫颈脱落细胞,提取总DNA。根据文献[ 9,10,11 ]设计引物。MY09/11:上游引物序列5′-CGT CCM ARR GGA WAC TGA TC-3′、下游引物序列5′-GCM CAG GGW CAT AAY AAT GG-3′,扩增产物长度450 bp;GP5+/6+:上游引物序列5′-TTT GTT ACT GTG GTA GAT ACY(T/C) AC-3′、下游引物序列5′-GAA AAA TAA ACT GTA AAT CAT ATT C-3′,扩增产物长度150 bp。混合碱基:M=A+C,R=A+G,W=A+T,Y=C+T。参考文献[ 12 ] 选择感染HPV的人类宿主细胞中β-globin基因作为内参照。β-globin: 上游引物序列5′-ACA CAA CTG TGT TCA CTA GC-3′、下游引物序列5′-CAA CTT CAT CCA CGT TCA CC-3′,扩增产物长度126 bp。按常规程序扩增,扩增后的产物进行琼脂糖凝胶电泳,在KODAK凝胶成像仪上扫描结果。 1.4 宫颈脱落细胞标本夹心法ELISA检测
提取细胞总蛋白,-20℃保存。夹心法ELISA实验步骤[ 7 ]如下:将小鼠多肽抗血清用0.05 mol/L碳酸盐缓冲液1∶100稀释,4℃包被过夜;用PBS洗板;5%牛血清白蛋白室温封闭;加入提取的细胞总蛋白,37℃温育1 h,同时设置对照组,每组3个复孔;加1∶10 000稀释的兔多肽抗体;加1∶400 000稀释的生物素化羊抗兔二抗;加1∶2 000稀释的亲和素标记HRP;四甲基联苯胺(TMB)显色后用2 mol/L H2SO4终止反应;450 nm处检测各孔光密度(D)值。以重组HPV16 L1作为阳性对照[ 13 ]。 1.5 宫颈脱落细胞标本免疫细胞化学检测
宫颈脱落细胞阳性标本采用全自动薄膜制片机制成单细胞薄膜玻片,直径约20 mm。用4%多聚甲醛固定,3% H2O2处理,5%牛血清白蛋白室温封闭,1∶100稀释的兔纯化多肽抗体4℃过夜,PBS冲洗,加HRP标记二抗,DAB显色,苏木精复染细胞核,最后洗涤、脱水、树胶封片,显微镜观察。 1.6 统计学处理
应用SPSS13.0统计学软件进行数据处理,计数资料以率(百分比)表示,组间比较采用χ2检验和Kappa一致性检验。检验水准(α)为0.05。 2 结 果 2.1 HPV L1 C-末端共同序列多肽抗体的制备及灵敏度确定结果
ELISA法测定结果显示,兔多肽抗血清效价为1∶240 000(D值1.297),鼠多肽抗血清效价为1∶200(D值0.852)。将免疫后的兔多肽抗血清经交联有多肽的层析柱进行亲和纯化,得到抗多肽IgG抗体,IgG浓度为0.764 mg/mL,用ELISA法测得多肽抗体的效价不低于1∶60 000(D值为1.038)。
采用夹心法ELISA对多肽抗体进行检测,1 mg/mL浓度下的多肽当稀释滴度达到1∶4 000时,仍可被多肽抗体检测到。此滴度下的多肽质量为2.50×10-10 g (250 pg),物质的量为7.345×10-14 mol,相当于含有4.424×1010个多肽分子。其检测灵敏度为2.5 ng/mL。 2.2 宫颈薄层液基细胞学检查结果
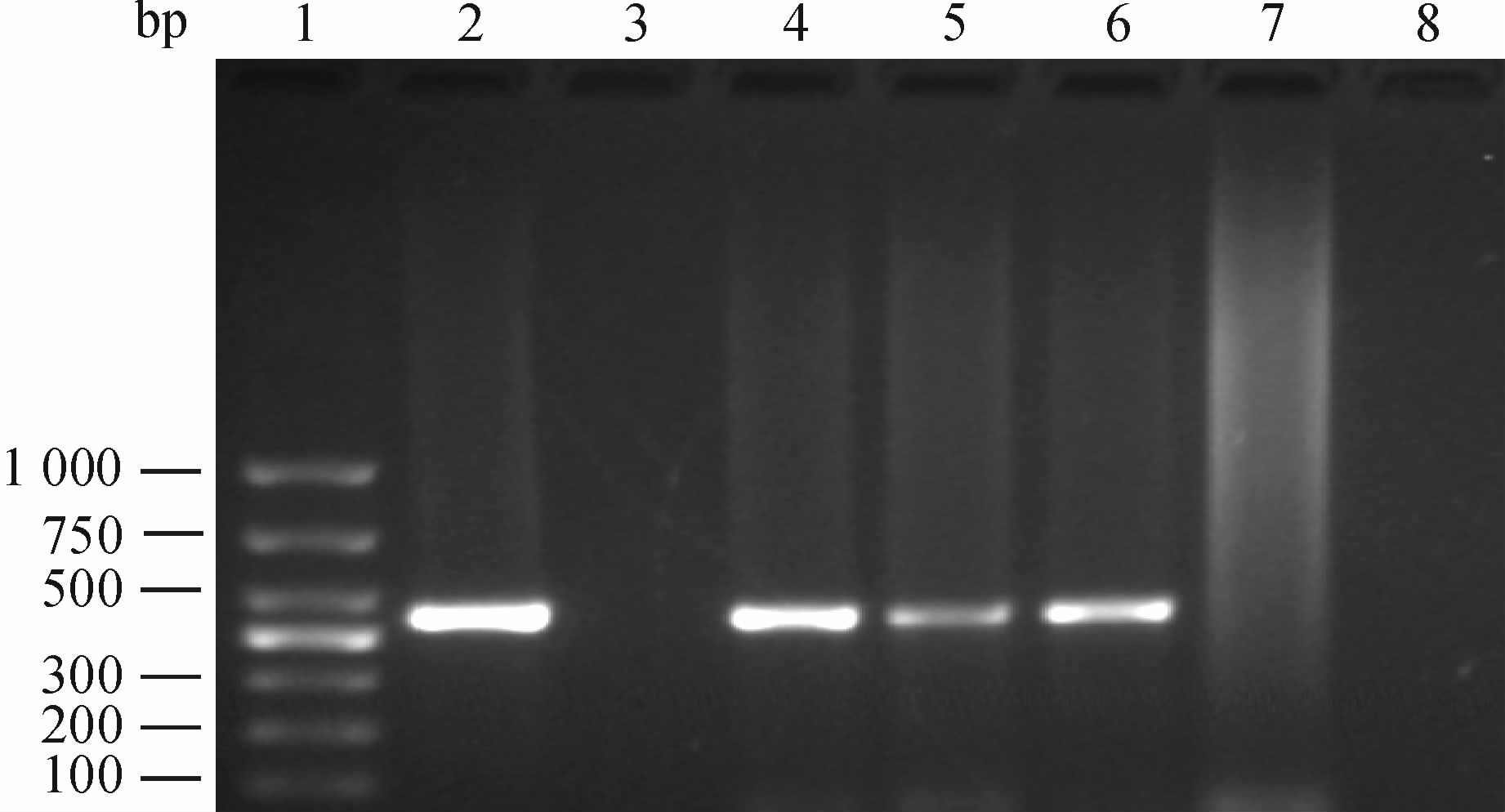
共收集标本269例,年龄20~70岁,集中于25~40岁者201例,占74.6%。宫颈病变者12例,检出率为4.46%。 2.3 宫颈脱落细胞标本Nest-PCR检测结果 采用通用型MY09/11引物扩增,结果显示在约450 bp处可看到明显条带即为HPV DNA阳性(图 1)。最终得到30例HPV阳性标本,HPV阳性检出率为11.15%(30/269)。
|
图 1 宫颈脱落细胞标本进行MY09/11引物扩增琼脂糖凝胶电泳结果 Fig 1 Agar electropherogram of cervical exfoliated cell specimens amplified by primer MY09/11 1: DNA marker;2: CaSki cell,as a positive control;3: HaCat cell,as a negative control;4-8: Cervical exfoliated cell specimens |
对MY09/11检测阴性的239例标本再进行GP5+/6+引物扩增,在约150 bp处看到明显条带即为HPV DNA阳性(图 2)。检出阳性标本51例,HPV阳性检出率为21.34%(51/239)。

|
图 2 宫颈脱落细胞标本进行GP5+/6+引物扩增琼脂糖凝胶电泳结果 Fig 2 Agar electropherogram of cervical exfoliated cell specimens amplified by primer GP5+/6+ 1: DNA marker; 2: CaSki cell,as a positive control;3: HaCat cell,as a negative control; 4-8: Cervical exfoliated cell specimens |
对所有宫颈脱落细胞标本提取总DNA,同时进行内参照β-globin基因扩增,结果显示均可于约126 bp处看到一致的明显条带(图 3)。

|
图 3 CaSki、HaCat细胞以及宫颈脱落细胞标本β-globin基因引物扩增琼脂糖凝胶电泳结果 Fig 3 Agar electropherograms of product amplified by β-globin gene primer in CaSki cells,HaCat cells and cervical exfoliated cell specimens 1: DNA marker;2: CaSki cell;3: HaCat cell; 4-6: Cervical exfoliated cell specimens |
汇合MY09/11和GP5+/6+两对引物扩增结果,共检测出81例HPV DNA阳性标本,HPV总检出率为30.11%(81/269)。12例细胞学阳性的标本均检测到HPV DNA。两对引物分别扩增得到的HPV检出率差异有统计学意义(P<0.05)。 2.4 宫颈脱落细胞标本的ELISA检测结果
263例宫颈脱落细胞标本中有91例显示HPV阳性,阳性检出率为34.60%(6例标本量较少,未做ELISA检测)。12例细胞学阳性标本经ELISA检测也均为HPV阳性。 2.5 宫颈脱落细胞标本的Nest-PCR检测和ELISA检测结果比较
经χ2检验显示,Nest-PCR和ELISA两种方法对宫颈脱落细胞标本内HPV检测结果差异无统计学意义(P>0.05)。对两种方法检测结果的一致性进行比对,结果符合率达到94.3%,Kappa值达到0.88。见表 1。
|
|
表 1 Nest-PCR和ELISA法对宫颈脱落细胞标本内HPV检测结果的一致性比较 Tab 1 Comparison of Nest-PCR and ELISA results for detection of HPV in cervical exfoliated cell samples |
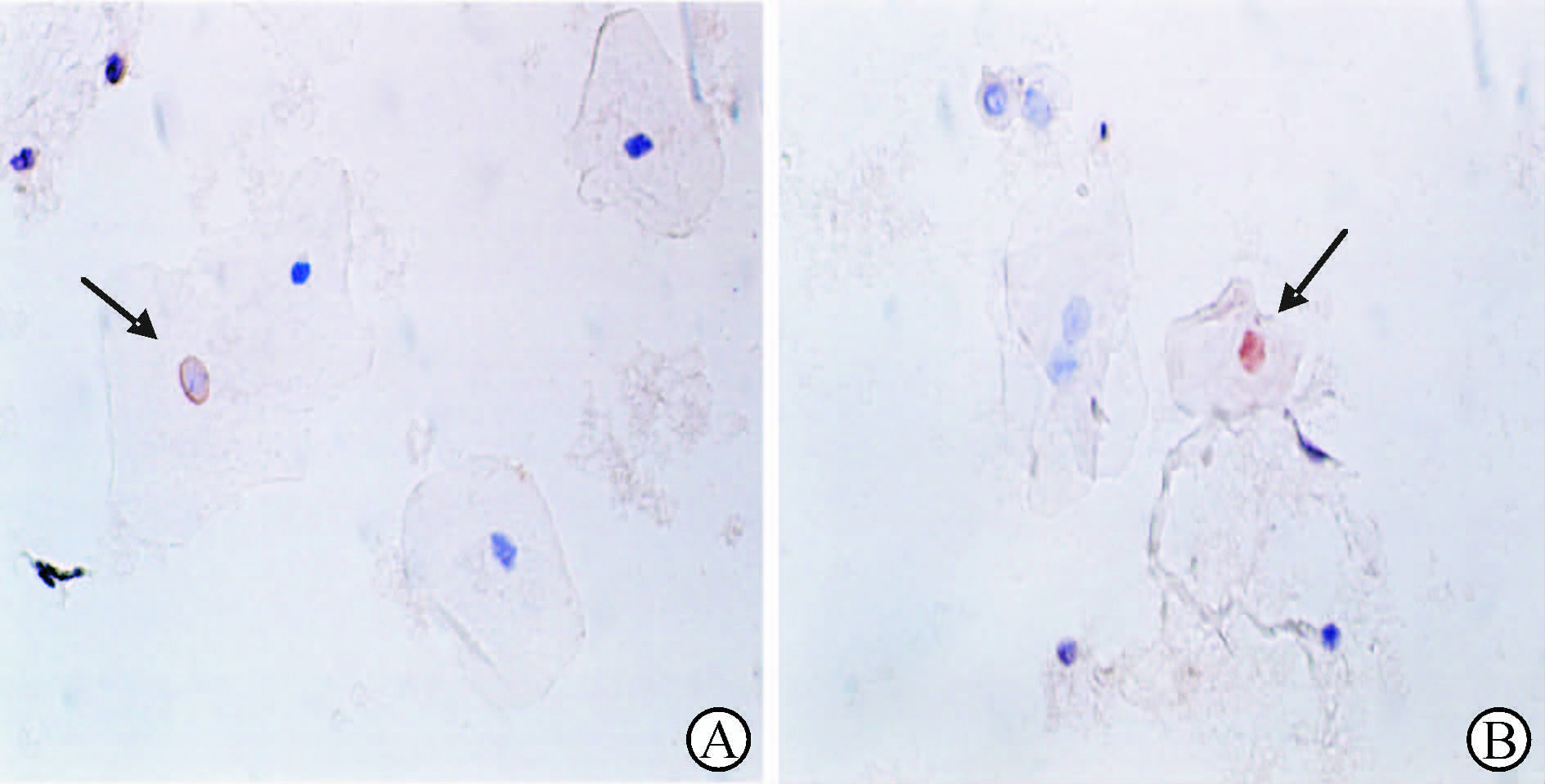
有HPV感染的阳性细胞表现为细胞核着色,呈黄色。无HPV感染的细胞为阴性反应(图 4)。
|
图 4 宫颈脱落细胞标本的免疫细胞化学检测 Fig 4 Immunocytochemical staining of cervical exfoliated cell samples A: Equivocal atypical squamous cells of undetermined significance. Arrow shows a human papillomavirus(HPV) positive cell,with yellow and enlarged nuclear; B: Low-grade squamous intraepithelial lesion. Arrow shows a HPV positive cell with nuclear and cytoplasm both being yellow,and the nuclear color is deeper,but the nuclear has no marked change in size. Original magnification: ×400 |
HPV感染导致宫颈癌及其癌前病变已被广泛认识,据估计超过80%的妇女在50岁时都可能遭受生殖器的HPV感染[ 14 ]。如果在病毒的潜伏期能做到宫颈病变的早期诊断,并发现HPV的存在,给予及时干预,将大大降低宫颈癌的发生率和病死率。例如美国1950年以前浸润性宫颈癌是导致妇女癌症死亡的主要原因,之后5年间宫颈癌筛查计划逐步推行,到1992年时宫颈癌的死亡人数减少了74%,近年来病死率还在不断下降[ 15 ]。
目前HPV DNA检测被广泛提倡,应用最多的是PCR技术,采用通用型引物MY09/11对临床标本进行检测是常用的方法之一,有研究者以此方法测得HPV检出率为20.5%[ 16 ]。Sotlar等[ 9 ]采用MY09/11和GP5+/6+套嵌的Nest-PCR方法,增加了扩增型别,使HPV的检出率达到了34.70%。本实验也采用了Nest-PCR方法,选用MY09/11和GP5+/6+,通过套嵌应用,MY09/11第1次扩增,检出30例HPV DNA阳性标本(阳性检出率11.15%);对于其阴性标本应用GP5+/6+再次扩增,检出51例HPV DNA阳性标本(阳性检出率21.34%);Nest-PCR方法共检测出81例HPV DNA阳性标本,HPV总检出率为30.11%,与Sotlar等[ 9 ]的结果相近。
MY09/11能够鉴别出25种HPV型别,GP5+/6+能够鉴别19种HPV型别(HPV6,11,16,18,31,33,34,40,42,43,44,35,39,45,51,52,54,56和58)[ 11 ]。但因引物扩增型别有限,总不能完全涵盖所有病毒型别,而且病毒在不同机体、不同地域、不同种族内可能发生变异,产生新的型别或亚型,可见目前的广谱HPV基因检测有很大的局限性。同时,由于PCR检测技术要求高,检测费用高,同时不能实现完全自动化,因而不适合在发展中国家作为大规模人群的筛查方法。
本课题组制备的用于诱导识别所有HPV L1的抗体诱导物是一段长30个氨基酸残基的多肽,前期研究已证明由此多肽诱导产生的抗体对该序列的反应是多位点的,即多克隆抗体,对待测标本中的HPV有较强的检测能力和适应能力[ 5,6 ]。本实验采用HPV L1鼠多肽抗血清做包被抗体,与HPV L1多肽兔纯化抗体应用ELISA夹心法,检测标本中是否存在HPV L1蛋白。为了检测到微量的L1蛋白,我们采用了高敏感性的生物素-亲和素系统,这是目前灵敏效价最高的ELISA检测方法。据有关研究报道,生物素-亲和素ELISA方法可以检出的抗原量能够达到0.05~5 ng/mL[ 7 ]。本课题的多肽抗体灵敏度的生物素-亲和素ELISA测试也证明了这一点,其对多肽的检测灵敏度为2.5 ng/mL。夹心法ELISA检测结果显示263例宫颈脱落细胞标本共检出HPV阳性标本91例,阳性检出率为34.60%,略微高于Nest-PCR方法(30.11%),虽未显示更好的灵敏性,但两种检测方法的一致性较高,Kappa值达到0.88。
为确定本研究所用的多肽抗体对宫颈细胞学标本内HPV的检测能力,同时也为确定多肽抗体对HPV感染宫颈细胞学标本的反应是特异性的,我们对前面检测均是阳性的标本进行了免疫细胞化学检测。以本课题组的兔纯化多肽抗体作为第1抗体进行免疫细胞化学检测,结果显示,标本内某些细胞的胞质和胞核出现阳性反应,被染成黄色,与邻近未着色的正常细胞相比差异非常明显,说明反应是特异性的,这些细胞中含有HPV L1蛋白。
综上所述,本研究制备的抗多肽抗体对宫颈脱细胞内HPV感染显示了良好的检出能力和良好的HPV广谱性反应能力,对该抗体的进一步研究、对研发妇女HPV感染筛查用ELISA检测试剂盒、对研究HPV靶向治疗等方面具有很好的价值。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Sánchez-Lander J, Cortiñas P, Loureiro C L, Pujol F H, Medina F, Capote-Negrín L, et al. Human papillomavirus in invasive cervical cancer and cervical intraepithelial neoplasia 2 and 3 in Venezuela: a cross-sectional study[J]. Cancer Epidemiol, 2012, 36: e284-e287. |
| [2] | de Sanjose S, Quint W G, Alemany L, Geraets D T, Klaustermeier J E, Lloveras B, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J]. Lancet Oncol, 2010, 11:1048-1056. |
| [3] | Inoue M, Okamura M, Hashimoto S, Tango M, Ukita T. Adoption of HPV testing as an adjunct to conventional cytology in cervical cancer screening in Japan[J]. Int J Gynecol Obstet, 2010, 111:110-114. |
| [4] | Cañadas M P, Cirigliano V, Darwich L, Sirera G, Coll J, Clotet B, et al. Comparison of the f-HPV typingTM and Hybrid Capture Ⅱ® assays for detection of high-risk HPV genotypes in cervical samples[J]. J Virol Methods, 2012, 183:14-18. |
| [5] | 姜波玲, 肖长义, 叶 红. HPV L1共同保守序列多肽对多价性HPV阳性临床标本的检测[J]. 肿瘤, 2008, 28: 864-868. |
| [6] | 姜波玲, 肖长义, 袁太宁, 叶 红, 王雅琴, 黎家华, 等. HPV L1 C-末端保守序列短肽体液免疫学特性[J]. 免疫学杂志, 2009, 25: 239-242, 246. |
| [7] | 黎 明, 阴津华, 张 葵, 吴从愿. 高灵敏酶联免疫分析法测定人脂肪细胞瘦素分泌[J].中华医学杂志, 2008, 88: 3293-3297. |
| [8] | Baker C C, Phelps W C, Lindgren V, Braun M J, Gonda M A, Howley P M. Structural and transcriptional analysis of human papillomavirus type 16 sequences in cervical carcinoma cell lines[J]. J Virol, 1987, 61: 962-971. |
| [9] | Sotlar K, Diemer D, Dethleffs A, Hack Y, Stubner A, Vollmer N, et al. Detection and typing of human papillomavirus by E6 nested multiplex PCR[J]. J Clin Microbiol, 2004, 42: 3176-3184. |
| [10] | Coutlée F, Gravitt P, Kornegay J, Hankins C, Richardson H, Lapointe N, et al. Use of PGMY primers in L1 consensus PCR improves detection of human papillomavirus DNA in genital samples[J]. J Clin Microbiol, 2002, 40: 902-907. |
| [11] | Cho H B, Kim Y J, Kim K T. Comparison between L and E gene amplification analytical methods for human papillomavirus typing[J]. J Gynecol Oncol, 2008, 19: 251-255. |
| [12] | Pérez L O, Barbisan G, Ottino A, Pianzola H, Golijow C D. Human papillomavirus DNA and oncogene alterations in colorectal tumors[J]. Pathol Oncol Res, 2010, 16: 461-468. |
| [13] | Zhang T, Xu Y, Qiao L, Wang Y, Wu X, Fan D, et al. Trivalent Human Papillomavirus (HPV) VLP vaccine covering HPV type 58 can elicit high level of humoral immunity but also induce interference among component types[J]. Vaccine, 2010, 28: 3479-3487. |
| [14] | 蒋雪梅, 肖长义. 人乳头瘤病毒多型别感染在一般妇女人群中检出的研究进展[J]. 中华临床医师杂志(电子版), 2012, 6: 8279-8281. |
| [15] | Pickle L W, Hao Y, Jemal A, Zou Z, Tiwari R C, Ward E, et al. A new method of estimating United States and state-level cancer incidence counts for the current calendar year[J]. CA Cancer J Clin, 2007, 57: 30-42. |
| [16] | 郭 洁, 朱中元, 王海波, 王 莉. 通用引物PCR法在人乳头瘤病毒基因检测中的应用[J].中国热带医学, 2007, 7: 693-694, 706. |
 2014, Vol. 35
2014, Vol. 35


