2. 解放军411医院, 上海 200081
2. No. 411 Hospital of PLA, Shanghai 200081, China
选取第二军医大学长征医院拟于全麻下行颅脑肿瘤切除术的患者60例,美国麻醉医师协会(ASA) Ⅰ~Ⅱ级,年龄18~60岁,中位年龄47.6岁,心、肺功能未见异常,无低血压病史及家族史,无精神病史,无长期服用镇静类药物史。本研究通过第二军医大学长征医院医学伦理委员会批准,所有患者知情同意并签署知情同意书。采用随机数字法将患者分为对照组和硫酸镁组,每组30例。
1.2 麻醉方法患者术前常规禁食水,术前30 min予苯巴比妥100 mg肌内注射镇静。入室后行桡动脉穿刺,检测有创血压、血氧饱和度及心电图。诱导依次予静注咪达唑仑0.03 mg/kg,2%异丙酚靶控输注,浓度为3 μg/mL,瑞芬太尼靶控输注,设置效应室浓度为5 ng/mL。患者意识消失后予0.3 mg/kg顺式阿曲库铵快速气管内插管,插入高容量低压力的 Fuji加强钢丝气管导管,诱导成功后,硫酸镁组予50 mg/kg硫酸镁,对照组予0.2 mL/kg等体积生理盐水。
麻醉以靶控输注瑞芬太尼和异丙酚全凭静脉麻醉维持,根据手术刺激、血压、心率和脑电双频指数(bispectral index,BIS)监控麻醉深度,利用全凭静脉靶控输注(target controlled infusion,TCI)给药,调节异丙酚效应室浓度为2.5~4.0 μg/mL,瑞芬太尼效应室浓度为2.5~5.0 ng/mL,将血压和心率控制在基础值±(10%~20%),呼吸末二氧化碳分压(EtCO2)维持在35~45 mmHg(1 mmHg=0.133 kPa),BIS维持在40~60。手术即将结束缝皮时,停用静脉药。记录所有用药量。手术结束时避免持续指令性睁眼和其他任何刺激。用4个成串刺激(train of four,TOF)监测肌松恢复情况,当受试者轻唤睁眼、呼吸平稳、握手有力,咳嗽、吞咽反射恢复,能够完成指令性动作时拔出气管内导管。然后面罩吸纯氧观察5 min后送至麻醉后监护室(post-anaesthesia care unit,PACU)。本研究采用双盲法,在麻醉诱导后由不清楚本研究目的且不参加后续观察的护士按分组给药。
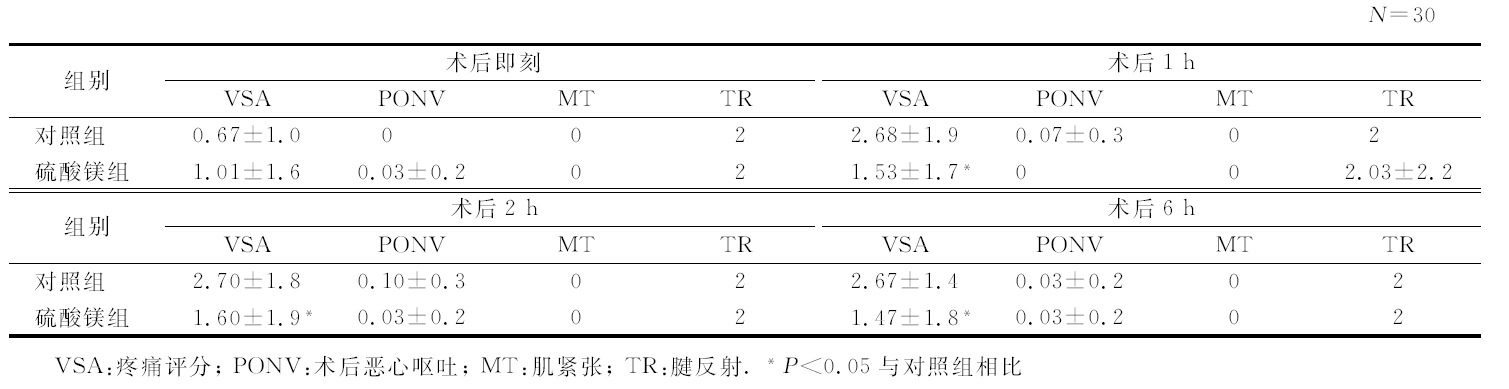
1.3 观测指标以患者拔管送至复苏室开始计时,在术后0、1、2、6 h由对本实验目的不知情的技师分别记录患者疼痛、恶心、呕吐(postoperative nausea and vomiting,PONV)、肌张力及腱反射等术后反应。其中疼痛由疼痛尺度(visual analog scale,VAS)评分,分为0~10分:0分为最轻,10分为最重。肌腱反射分为:0分为消失;1分为反射减弱;2分为正常;3分为反射增强,无阵挛;4分为反射增强,有阵挛。肌张力依照Ashworth分级标准:0 级为正常肌张力;1 级为肌张力略微增加,受累部分被动屈伸时,在关节活动范围之末时呈现最小的阻力,或出现突然卡住和突然释放;1级+为肌张力轻度增加,在关节活动后50%范围内出现突然卡住,然后在关节活动范围后50%均呈现最小阻力;2 级为肌张力较明显地增加,通过关节活动范围的大部分时,肌张力均较明显地增加,但受累部分仍能较容易地被移动;3 级为肌张力严重增加,被动活动困难;4 级为僵直,受累部分被动屈伸时呈现僵直状态,不能活动。
1.4 统计学处理采用SPSS 18.0统计软件进行分析,计量资料以 ±s表示,组间采用独立样本t检验,计数资料比较采用χ2检验,检验水准(α)为0.05。
2 结 果 2.1 两组患者基线资料对比两组患者年龄[(47.1± 9.8) vs (48.0±11.5)岁]、性别(男/女: 15/15 vs 14/16)、身高[(166.4±8.5) vs (162.9±7.4) cm]、体质量[(65.2±12.1) vs (64.9±11.5) kg]及手术时间[(254.1±56.6) vs (241.0±58.4) min]比较差异无统计学意义。
2.2 两组患者术中异丙酚及芬太尼用量比较与对照组相比,硫酸镁组异丙酚及芬太尼用量均降低[(0.11±0.5) vs (0.18±0.5),(0.13±0.4) vs (0.19±0.8);P<0.05]。
2.3 两组患者术后不良事件发生情况分析与对照组相比,硫酸镁组VAS在术后1、2、6 h明显减低,差异有统计学意义 (P<0.05),在术后即刻差异无统计学意义。PONV、肌张力及腱反射在各时间点差异均无统计学意义(表 1)。
|
|
表 1 两组患者术后不良反应对比 |
与对照组[术前(1.1±0.2) mmol/L,术后 (1.1±0.1) mmol/L]相比,硫酸镁组血镁浓度无明显增加[术前(1.1 ±0.1) mmol/L,术后(1.1±0.1) mmol/L],且术后硫酸镁组血镁浓度在正常范围内。
3 讨 论目前硫酸镁在麻醉中的应用大多为辅助全麻、硬膜外麻醉和术后镇痛,以减少全麻、镇痛药、肌松药用量[8]。由于Mg2+可直接使血管扩张,并间接减少交感神经阻滞和儿茶酚胺的分泌量,从而诱发低血压的发生,故本研究排除低血压、心功能较差的患者,以保证患者术中安全。另神经-肌肉接头处肌质网Ca2+通道对Ca2+的释放与肌质Mg2+的浓度明显相关,意味着Mg2+浓度低于生理浓度越多,其麻醉镇痛效应越差。本研究检测术前、术后Mg2+浓度,以监测并保持Mg2+的生理浓度[9]。既往研究证实,小剂量硫酸镁(50 mg/kg)用于临床麻醉安全可靠[10],且对心律失常患者有利[11],本研究也选择这一剂量,并监测血镁浓度,确保参与患者的安全。
本研究结果证实诱导后予静脉注射50 mg/kg硫酸镁可有效降低术中异丙酚及瑞芬太尼的用量,并有效减轻术后疼痛,同时不加重术后恶心、呕吐、肌张力及腱反射等不良反应。其机制与硫酸镁的生理特性相关:镁作为辅助因子参与人体多种反应[3],如调控肌苷酸激酶系统、神经活性、肌肉收缩、神经递质的释放等。更重要的是镁可以通过突触前受体,抑制兴奋性甘氨酸类神经递质的释放;拮抗NMDA谷氨酸受体,降低中枢敏感性,产生镇痛、抗惊厥及镇静等作用[2, 3, 4, 5, 6, 12]。上述机制的共同作用使术中应用硫酸镁可有效减少术中异丙酚及瑞芬太尼的用量,并减轻术后疼痛。
血压、脉搏等是监测麻醉深度的传统指标。许多外界因素可影响血压、脉搏,进而影响对麻醉深度的正确判定,硫酸镁就是其一。它可以引起血管扩张[6, 7],进而降低血压。故单靠传统检测血压、脉搏、意识状态判断麻醉深度的方法,对判读硫酸镁的影响不够准确。BIS是反映镇静深度的客观指标[13],所以本研究使用BIS监护仪,直接监测麻醉药和镇静剂对大脑皮质作用的效果,不仅可实时了解患者麻醉深度及药物对大脑皮质的影响,还排除了硫酸镁对血压的影响,使得到的结果更真实、客观。而作为监测麻醉深度的指标更能真实反映实验效率,实验结果更具有可信性。预测95%患者处于非清醒状态时的BIS为52[14]。 因此,本研究麻醉过程中BIS维持在40~60,以确保患者处于适合的麻醉深度。
以往研究多只考虑芬太尼,而未考虑镇静药(吸入麻醉药)等的影响,而本研究采用全凭静脉靶控给药,根据不同药物麻醉学的药代动力学和药效学,结合患者个性化的性别、年龄和体质量等自身条件,通过调节相应的目标血药浓度以控制麻醉深度,使得麻醉药计量更精确,有效降低实验误差。本研究检测了术前及术后患者血镁浓度,术前、术后两组患者血镁浓度差异无统计学意义,且都在正常值范围内。这一结果也证明小剂量硫酸镁(50 mg/kg)用于临床麻醉对血镁本身无明显影响。
值得一提的是,本实验显示硫酸镁组VAS与对照组相比在术后1、2、6 h明显减低,且差异有统计学意义(P<0.05),而在术后即刻差异无统计学意义。术后即刻是拔管入监护室的时间点,此时手术刚结束,患者疼痛感和术中异丙酚及瑞芬太尼密切相关。硫酸镁组术后疼痛较轻可能与异丙酚及瑞芬太尼术中使用剂量较少相关。硫酸镁在神经-肌肉接头处阻滞乙酰胆碱的释放,从而松弛神经肌肉,但它并不影响琥珀酰胆碱复苏时间[14]。这使镁具备既可松弛肌肉,又不影响术后肌肉功能恢复的特性。这一特性使术中应用硫酸镁对术后PONV、肌肉紧张及腱反射等不良反应无明显影响。
综上,硫酸镁可减少术中异丙酚及瑞芬太尼用量并减弱术后疼痛,且由于其不影响琥珀酰胆碱复苏时间,从而对术后PONV、肌肉紧张及腱反射等不良反应无明显影响。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Telci L,Esen F,Akcora D,Erden T,Canbolat A T,Akpir K.Evaluation of effects of magnesium sulphate in reducing intraoperative anaesthetic requirements[J].Br J Anaesth,2002,89:594-598. |
| [2] | Bahar M,Chanimov M,Grinspun E,Koifman I,Cohen M L.Spinal anaesthesia induced by intrathecal magnesium sulphate[J].Anaesthesia,1996,51:627-633. |
| [3] | Schulz-Stübner S,Wettmann G,Reyle-Hahn S M,Rossaint R.Magnesium as part of balanced general anaesthesia with propofol,remifentanil and mivacurium: a double-blind,randomized prospective study in 50 patients[J].Eur J Anaesthesiol,2001,18:723-729. |
| [4] | Alday Muüoz E,Uña Orejón R,Redondo Calvo F J, Criado Jiménez A.Magnesium in anesthesia and postoperative recovery care[J].Rev Esp Anestesiol Reanim,2005,52:222-234. |
| [5] | Kara H,Sahin N,Ulusan V,Aydogdu T.Magnesium infusion reduces perioperative pain[J].Eur J Anaesthesiol,2002,19:52-56. |
| [6] | Elsharnouby N M,Elsharnouby M M.Magnesium sulphate as a technique of hypotensive anaesthesia[J].Br J Anaesth,2006,96:727-731. |
| [7] | Barbosa F T,Barbosa L T,Jucá M J,Cunha R M.Applications of magnesium sulfate in obstetrics and anesthesia[J].Rev Bras Anestesiol,2010,60:104-110. |
| [8] | 张嘉新,黄绍农,王显春,张云,陈志聪,高申山.硫酸镁对丙泊酚、瑞芬太尼全凭静脉麻醉的影响研究[J].国际医药卫生导报,2010,16:1941-1942. |
| [9] | 张会东,于松杨,孙学军,周承孝.硫酸镁在麻醉镇痛中的应用现状[J].国际麻醉学与复苏杂志,2010,31:142-144. |
| [10] | Ryu J H,Kang M H,Park K S,Do S H.Effects of magnesium sulphate on intraoperative anaesthetic requirements and postoperative analgesia in gynaecology patients receiving total intravenous anaesthesia[J].Br J Anaesth,2008,100:397-403. |
| [11] | 薛庆华,王伟鹏,于钦军,刘明政,陈雷,程卫平.镁和钙在低剂量芬太尼麻醉中对心脏瓣膜置换术患者心房颤动转复的影响[J].中华心律失常杂志,2011,15:294-299. |
| [12] | McKee J A,Brewer R P,Macy G E,Phillips-Bute B,Campbell K A,Borel C O,et al.Analysis of the brain bioavailability of peripherally administered magnesium sulfate: a study in humans with acute brain injury undergoing prolonged induced hypermagnesemia[J].Crit Care Med,2005,33:661-666. |
| [13] | Kearse L A Jr,Rosow C,Zaslavsky A,Connors P,Dershwitz M,Denman W.Bispectral analysis of the electroencephalogram predicts conscious processing of information during propofol sedation and hypnosis[J].Anesthesiology,1998,88:25-34. |
| [14] | Stacey M R,Barclay K,Asai T,Vaughan R S.Effects of magnesium sulphate on suxamethonium-induced complications during rapid-sequence induction of anaesthesia[J].Anaesthesia,1995,50:933-936. |
 2014, Vol. 35
2014, Vol. 35