总姜黄素是从中药姜黄中分离出来的重要活性成分,具有广泛的药理活性,如抗癌、抗菌、抗病毒、防氧化等[1,2]。总姜黄素碱性条件下易降解,对光、热、强酸、强碱均不稳定,口服后大部分以原形 (约89%)排出体外,大剂量时胃肠道不良反应严重[3],并且由于总姜黄素极低的水溶性和生物利用度,其药理活性也受到限制[4]。
总姜黄素有3种单体,分别为姜黄素(curcumin,CC)、去甲氧基姜黄素(deme-thoxycurcumin)和双去甲氧基姜黄素(bisdeme-thoxycurcumin)。CC是总姜黄素的主要成分,占总姜黄素含量的60%以上[5]。有文献报道,CC在总姜黄素发挥药理作用中起着重要作用[6]。本课题将从总姜黄素中分离出的CC作为考察对象,制备成姜黄素磷脂复合物 (curcumin phospholipid complex,CCPC),建立高效液相色谱法(HPLC)研究CCPC口服给药在大鼠体内的药代动力学特征,为临床研究和新药设计提供理论基础和方法。
1 材 料 1.1 仪器
FA1004A电子天平(上海精天电子仪器有限公司);DZF-6020型真空干燥箱(上海博迅实业有限公司医疗设备厂);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);TGL-16B高速台式离心机(上海安亭科学仪器厂);QL-901涡旋仪(海门市其林贝尔仪器制造有限公司);KQ-2200B型超声波清洗器(民山市超声仪器有限公司);BCD-649WE冰箱(青岛海尔股份有限公司);LC-2010AHT高效液相色谱仪(日本岛津公司)。 1.2 药品和试剂
CC(纯度>99 %,自制);Lipoid S 75 (PC,德国Lucas Meyer 公司);尼群地平(NT,纯度99.8%,郑州栋启广利生物科技有限公司);乙腈和甲醇(色谱纯,上海国药集团化学试剂有限公司);冰醋酸(分析纯 AR,成都市科龙化工试剂厂);超纯水。 1.3 实验动物
清洁级SD大鼠12只,雄性,体质量(250±20) g,由重庆医科大学实验动物中心提供。实验前未使用过任何药物。
2 方法和结果 2.1 CCPC的制备
称取适量CC和PC(质量比为1∶2),取适量无水乙醇溶解,50℃水浴中磁力搅拌1 h。将反应液转入圆底烧瓶,减压旋转蒸发除去反应溶剂,真空干燥2 h得CCPC[7],备用。 2.1.1 CCPC、CC在水中溶解度的测定
称取过量CCPC、CC,分别加入超纯水形成过饱和溶液,室温25℃搅拌24 h。分别取1 mL各样品,6 375×g离心10 min,上清液用色谱级甲醇稀释适当倍数,待测。
测定发现CC的溶解度由0.057 g/L增加到0.150 g/L,表明将CC制备CCPC后其溶解度增加了2.63倍。 2.1.2 CCPC的体外溶出
采用《中华人民共和国药典》2010年版二部附录ⅩC第二法规定的药物体外溶出度法进行测定,溶出介质为经超声脱气的pH 6.8 PBS,用量为900 mL,温度为37℃,搅拌速度为100 转/min。CC及CCPC(各3批)投药量相同(均含CC 5.0 mg)。分别于15、30、45、60、90、120、240、360、480、600、720 min时取样2 mL,各杯中分别补充溶出介质2 mL。各取样液经0.22 μm微孔滤膜过滤,取滤液稀释数倍后12 750×g离心10 min,上清液用甲醇稀释后测定。
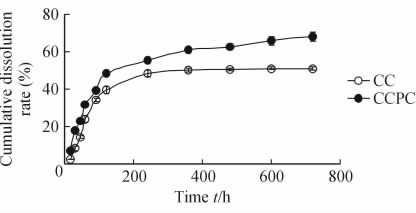
体外溶出实验结果表明,CCPC体外累计溶出率为68.04%,较CC(50.68%)有所提高。由图 1可以看出CCPC改善了CC在pH 6.8 PBS液中的溶出行为,且这种改善得益于磷脂复合物这种制剂形式,提示通过制备CCPC能增加CC在肠道中的溶出,提高口服生物利用度。
|
图 1 姜黄素磷脂复合物和姜黄素的累计体外溶出度
Fig 1 Cumulative dissolution of curcumin from
curcumin phospholipid complex (CCPC)
and curcumin (CC) in PBS (pH 6.8) n=3, ±s ±s
|
取适量的CCPC、CC,分别加入超纯水,超声得浓度约为3.13 mg/mL的CCPC及CC混悬液,备用。 2.2.2 动物分组及处理
12只SD大鼠随机分成2组,禁食不禁水12 h,第一组和第二组分别每只大鼠口服给药CC和CCPC混悬液4 mL。在灌胃给药后5、10、15、30、45 min,1、1.5、2、3、4、6、8、10、12 h,1、2、3 d等时间点 于眼底静脉丛取血0.5 mL,6 375×g 离心10 min,吸取上清液,4℃冰箱冷藏保存备用。 2.2.3 CCPC血浆样品处理方法
(1)空白血浆的制备: 大鼠眼底静脉丛取血,将所得空白血液置于涂有肝素的离心管中,6 375×g离心10 min,吸取上清液备用。(2)血浆样品的制备:吸取待测血浆样品0.2 mL于离心管,加入含5 μg/mL NT的内标工作液100 μL,再加入乙酸乙酯1.0 mL,旋涡2 min后,12 750×g离心10 min,转移上层有机相于另一离心管中,用氮气吹干仪吹干。最后用100 μL 流动相复溶,取20 μL 进样测定。 2.2.4 HPLC方法的建立
色谱条件:伊利特 C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30℃;流动相为乙腈∶55%冰醋酸溶液 =45∶55(V/V),流速为1 mL/min;紫外检测波长为426 nm,以NT为内标,进样量为20 μL。分别精密称量CC 10.0 mg和内标NT 5.0 mg溶于甲醇溶液,配制成0.5 μg/mL的CC工作液和5 μg/mL的NT内标工作溶液,于4℃冰箱中保存,备用。
取空白血浆0.2 mL于2 mL离心管中,分别加入适量的0.5 μg/mL的CC对照溶液,再加入100 μL NT内标工作溶液,配制成浓度为 15、70、105、140、210、245 ng/mL系列浓度的CC对照品溶液。按照2.2.3项下血浆样品的处理方法处理后,在上述色谱条件下进样测定峰面积,以CC和内标峰面积比(Y)对CC 浓度(X)进行线性回归,得回归方程Y=0.021 1X+0.004 4(r=0.999 6),CC浓度在15~245 ng/mL浓度范围内与CC及内标的峰面积比呈良好线性关系。 2.2.5 方法学验证
(1)精密度试验:分别取高、中、低浓度(210、140、70 ng/mL)加有CC的血浆样品,按2.2.3项下操作方法处理后,进样分析,每个浓度测3次,连续测5 d。所测得的日内精密度RSD分别为1.56 %、0.99 %、1.21 %(n=3);日间精密度的RSD分别为0.91%、1.45%、2.01%、1.73%、1.06%(n=5),均符合生物样品分析方法的测定要求。(2)回收率试验:分别取浓度为210、140、70 ng/mL加有CC的血浆样品,按2.2.3项下操作方法处理后,进样分析。每个浓度测定3次,按标准曲线法计算血浆药物浓度,以所得浓度与实际浓度的比求得平均回收率为99.31%。结果表明本测定方法回收率符合含量测定要求。(3)样品稳定性试验:配制高、中、低浓度 (210、140、70 ng/mL) 的CC血浆标准溶液各3份,分别 3次冰冻、解冻,按2.2.3项处理并进样检测,考察其稳定性。高、中、低3个浓度的RSD分别为2.67%、1.61%、2.07%。结果显示冻融条件对血浆样品的检测结果没有明显的影响。
|
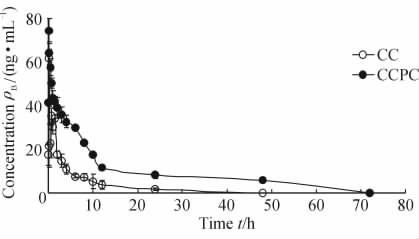
图 2 姜黄素磷脂复合物和姜黄素血药浓度-时间曲线
Fig 2 Mean concentration-time curve of curcumin phospholipid complex(CCPC) and curcumin(CC) after oral administration n=6, ±s ±s
|
实验数据用DAS-211药代动力学软件进行分析,经拟合后各剂量组符合一室模型,Tmax采用实测值。图 2为大鼠经50 mg/mL剂量口服给药后CC及CCPC的血药浓度-时间曲线。药代动力学实验数据以SPSS 17.0统计软件进行处理,CC及CCPC主要药代动力学参数见表 1,可以看出,将CC制备成CCPC后,其AUC0-t从(172.41±31.66) μg·h·L-1增加到(637.38±30.04) μg·h·L-1,提高了3.70倍(P<0.01)。最大血药浓度从(61.64±4.29) μg/L增加到(74.34±5.57) μg/L,提高了1.21倍。
|
|
表 1 姜黄素磷脂复合物和姜黄素主要药代动力学参数
Tab 1 Pharmacokinetic parameters of curcumin phospholipid complex (CCPC) and curcumin (CC) n=6, ±s ±s
|
口服剂型的关键因素是其在消化道内的吸收程度与速度[8],且胃肠道给药的药物吸收很大程度受药物溶解度的影响。对难溶性药物而言,溶出是药物吸收的限速过程。在这种情况下,药物在胃肠道内的溶出速度直接影响药物的起效时间、药效强度和作用持续时间[9]。总姜黄素极难溶于水,CC具有口服血药浓度低、生物利用度低等特点,其药理活性的发挥受到限制。
磷脂是生物膜的主要成分,有助于提高难溶性药物的治疗效果[4]。以磷脂为主要材料的药物载体包括脂质体、磷脂复合物等[10]。研究发现,中药活性成分与磷脂形成复合物后可有效提高中药活性成分的体内吸收,改善其生物利用度[10],提高溶解度、增强吸收,延长作用时间,降低不良反应。将CC制备成CCPC,其口服吸收明显提高[12]。
本课题将总姜黄素中的主要单体CC作为考察对象,制备了CCPC。测定发现CC的溶解度仅有0.057 g/L,而制备成CCPC后溶解度提高了2.63倍。体外溶出度实验表明,CCPC较CC在pH 6.8 PBS液中有更好的溶出行为,表明CCPC能增加CC在肠道中的溶出,提高口服生物利用度。
由药代动力学参数可知,本实验制备的CCPC的AUC0-∞为(857.80±223.69) μg·h·L-1,相对唐勤等[13]CCPC药代动力学研究结果AUC0-∞为(442.53±91.89) ng·h·L-1而言,生物利用度有很大的提高。且本实验Cmax为(74.34±5.57) μg/L,也较唐勤等 [13]得到的Cmax (142.61 ±15.34) ng/L更高。这表明本实验中的CCPC较唐勤课题组[13]的CC有更高的血药浓度及曲线下面积,具有更好的生物利用度和临床应用前景。
CCPC提高了CC的生物利用度,延长了CC作用时间,有利于药物在体内的吸收。本实验建立了用HPLC法测定CCPC及CC血药浓度的方法,血样处理方法的萃取回收率较高,且杂质干扰较少。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 葛跃伟,高慧敏,王智民.姜黄属药用植物研究进展[J].中国中药杂志,2007,32:2461-2467. |
| [2] | Tan Q,Wu J,Li Y,Mei H,Zhao C,Zhang J.A supermolecular curcumin for enhanced antiproliferative and proapoptotic activities: molecular characteristics,computer modeling and in vivo pharmacokinetics[J].Nanotechnology,2013,24:035102. |
| [3] | 张继芬,唐勤,莫婷,谢小芳,徐晓玉.姜黄素磷脂载体的表征及肠吸收研究[J].中国药学杂志,2012,47:1736-1740. |
| [4] | Maiti K,Mukherjee K,Gantait A,Saha B P,Mukherjee P K.Curcumin-phospholipid complex: Preparation,therapeutic evaluation and pharmacokinetic study in rats[J].Int J Pharm,2007,330:155-163. |
| [5] | 齐莉莉,王进波.单体姜黄素稳定性的研究[J].食品工业科技,2007,28:181-182. |
| [6] | 汪海慧,成扬.姜黄素药理作用的研究进展[J].上海中医药大学学报,2007,21:73-76. |
| [7] | 刘安昌,赵丽霞,翟光喜,娄红祥.姜黄素磷脂复合物的制备及其形成机制研究[J].中国中药杂志,2008,33:2112-2117. |
| [8] | 曾晓会,陈玉兴,赵自明,黄雪君,杜铁良.姜黄素微囊在大鼠体内的药代动力学研究[J].中国实验方剂学杂志,2010,16:107-110. |
| [9] | 刘建平,李高,刘中秋,孙进,何仲贵,张娜.生物药剂学与药物动力学[M].4版.北京:人民卫生出版社,2011:29-30. |
| [10] | Yue G G,Cheng S W,Yu H,Xu Z S,Lee J K,Hon P M,et al.The role of turmerones on curcumin transportation and P-glycoprotein activities in intestinal Caco-2 cells[J].J Med Food,2012,15:242-252. |
| [11] | 吴慧仪,龙晓英,陈莉,李志亨,潘素静.磷脂复合物及其对中药活性成分透过生物膜的影响[J].中草药,2012,43:393-398. |
| [12] | Mazzolani F.Pilot study of oral administration of a curcumin-phospholipid formulation for treatment of central serous chorioretinopathy[J].Clin Ophthalmol,2012,6:801-806. |
| [13] | 唐勤,顾勇,李纳,郭倩,徐晓玉,张继芬.姜黄素磷脂复合物壳聚糖微球在大鼠体内药动学研究[J].中草药,2013,44:1939-1943. |
 2014, Vol. 35
2014, Vol. 35


