2. 第二军医大学长征医院麻醉科, 上海 200003;
3. 第二军医大学基础部生理学教研室, 上海 200433
2. Department of Anesthesiology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China;
3. Department of Physiology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
近年来脊髓损伤(spinal cord injury,SCI)尤其是高位SCI发生率逐年提高,据统计目前我国大陆地区年新发患者数约为25~35人次/10万[1]。高位SCI是T6以上脊髓遭受外力打击造成的损伤,由于损伤平面较高,导致大部分神经传导通路被中断,出现严重的心血管系统紊乱现象[2,3,4],主要表现为急性期(损伤后1~4周)明显的低血压以及恢复期(4周以后)出现的血压、心率(heart rate,HR)异常和各种恶性心律失常[5,6]。有研究表明,SCI后心血管系统会出现适应性变化及再调节现象来维持心血管系统的相对稳定[7],但其确切机制并不清楚,这种机制的明确将对进一步研究SCI后心血管功能异常期的防治策略具有重要的意义。NTS是接受外周血压、化学信息等传入整合的第一级中继站,并通过纤维投射影响调控交感和迷走中枢,因此NTS在维持血压水平等心血管功能调节中具有重要的作用[8]。本研究拟选取心血管中枢NTS区作为研究对象,比较观察兴奋性神经递质谷氨酸(glutamate)受体N-甲基-D-天冬氨酸受体1(N-methyl-D-aspartate receptor 1,NMDA-R1)、抑制性神经递质γ-氨基丁酸A受体α1(gamma-aminobutyric acid receptor A α1,GABAA-α1)在SCI后的变化趋势,为SCI患者心血管功能紊乱的救治提供新的思路。 1 材料和方法 1.1 试剂及仪器
小动物麻醉机(美国Euthanex公司),蛋白质印迹分析垂直电泳及转膜系统(美国Bio-Rad公司),Power Lab生物信号采集系统(澳大利亚AD Instrument公司),NMDA-R1抗体(英国Epitomics公司),GABAA-α1抗体(英国Abcam公司)。 1.2 动物分组及处理
健康雄性SD大鼠100只,体质量200~250 g[购自中国科学院上海实验动物中心,动物使用许可证:SYXK(沪)-2002-0041,生产许可证SCXK(沪)-2004-0003],随机分为SCI T4脊髓横断组(SCI组)和假手术组(Control组)。T4脊髓横断模型制备参考文献[9]方法,麻醉采用3%异氟烷气体麻醉。手术依次切开皮肤及肌肉,暴露T4椎板。咬除椎板后暴露脊髓,用刀片横断T4脊髓,Control组只暴露脊髓不进行横切。术后肌注青霉素40万U/d、腹腔注射5%葡萄糖溶液2 mL/100 g,连续3 d。仔细护理大鼠,如发现感染迹象及时行抗菌治疗。不同时间点选取一定数目大鼠入组实验,实验之前对大鼠体质量及运动功能评分(the Basso,Beattie,and Bresnahan scale,BBB评分)进行测定,明确SCI创伤打击对大鼠基本情况的影响,并对SCI组大鼠进行筛选。正常健康大鼠BBB评分为21分,SCI组入组条件为大鼠BBB评分小于10分(基本没有后肢负重行走,没有前后肢协同运动)[10]。 1.3 大鼠血压及HR检测
选取两组SCI前及1、2、3、4、6周大鼠各5只,3%戊巴比妥钠0.2 mL/100 g腹腔麻醉。气管插管后仰卧位四肢固定,右侧股动静脉插管。动脉导管接至换能器后与Power Lab生物信号采集系统连接,记录平均动脉压(mean arterial pressure,MAP)及HR,静脉导管补充林格液1~2 mL/h。 1.4 蛋白质印迹法检测受体蛋白的表达
分别取两组SCI前及1、2、3、4、6周大鼠各5只,断头取脑,放置于-80℃保存。标本收集齐全后,统一提取NTS组织,NTS的定位通过标准图谱[11]来确定,以NTS结合部(comNTS)为中心进行样本提取。用BCA法测定蛋白浓度后在垂直电泳仪上用等量蛋白质样品经8% SDS-PAGE分离蛋白,将目标蛋白转移于PVDF膜上,5%脱脂奶粉封闭2 h。分别进行NMDA-R1一抗(1∶5 000)、GABAA-α1一抗(1∶5 000)及内参α-Tubulin(1∶1 000)4℃孵育过夜,TBST洗膜5 min×3次;室温孵育二抗2 h,TBST洗膜5 min×3次。在PVDF膜上均匀滴加混合好的显影液,用化学发光方法扫描曝光,Gel-Pro analyzer软件分析条带灰度,并进行统计分析。 1.5 统计学处理
采用SPSS 16.0 软件进行统计学分析,数据以  ±s 表示,组间比较采用单因素方差分析,组内SCI前后比较采用SNK-q检验。检验水准(α)为0.05。
2 结 果
2.1 大鼠术后基本情况
±s 表示,组间比较采用单因素方差分析,组内SCI前后比较采用SNK-q检验。检验水准(α)为0.05。
2 结 果
2.1 大鼠术后基本情况
40只大鼠在模型制作过程中因大出血及术后感染死亡,剩余60只纳入实验。在不同时间点选取Control及SCI组大鼠分别进行体质量及BBB评分的测量(表 1)。比较两组大鼠SCI前后体质量发现,损伤前两组大鼠体质量差异无统计学意义;损伤后Control组体质量稳步增加,而SCI组在损伤1周时体质量明显下降,后逐渐恢复,但两组间差异仍有统计学意义(P<0.05)。比较两组大鼠SCI前后BBB评分发现,损伤前两组都处于完全健康状态(最高分21分);而损伤后1周SCI组大鼠BBB评分明显降低达到最低值[(0.8±0.5)分],随着恢复时间的延长,BBB评分逐渐上升但仍低于10分水平,说明T4脊髓横断的大鼠模型制作成功;损伤后各个时间点两组BBB评分差异均有统计学意义(P<0.05)。
|
|
表 1 两组大鼠体质量及BBB评分的变化
Tab 1 Body mass (BM) and the BBB scales of rats in the two groups n=5, ±s ±s
|
2.2 SCI后大鼠MAP及HR的变化
比较SCI前后SCI组大鼠不同时间点MAP及HR水平(图 1)。损伤后1周,MAP即出现下降(P<0.05);损伤后2周,下降更加明显(P<0.05)并达到最低值;损伤后3周逐渐恢复,但仍低于损伤前水平(P<0.05);4周以后恢复至损伤前水平。HR在损伤后1周即上升并达到最高值(P<0.05);损伤后2~4周逐渐恢复,但仍高于损伤前(P<0.05);6周时恢复至损伤前水平。Control组大鼠在不同时间点的MAP及HR水平较损伤前差异均无统计学意义(数据未列出)。
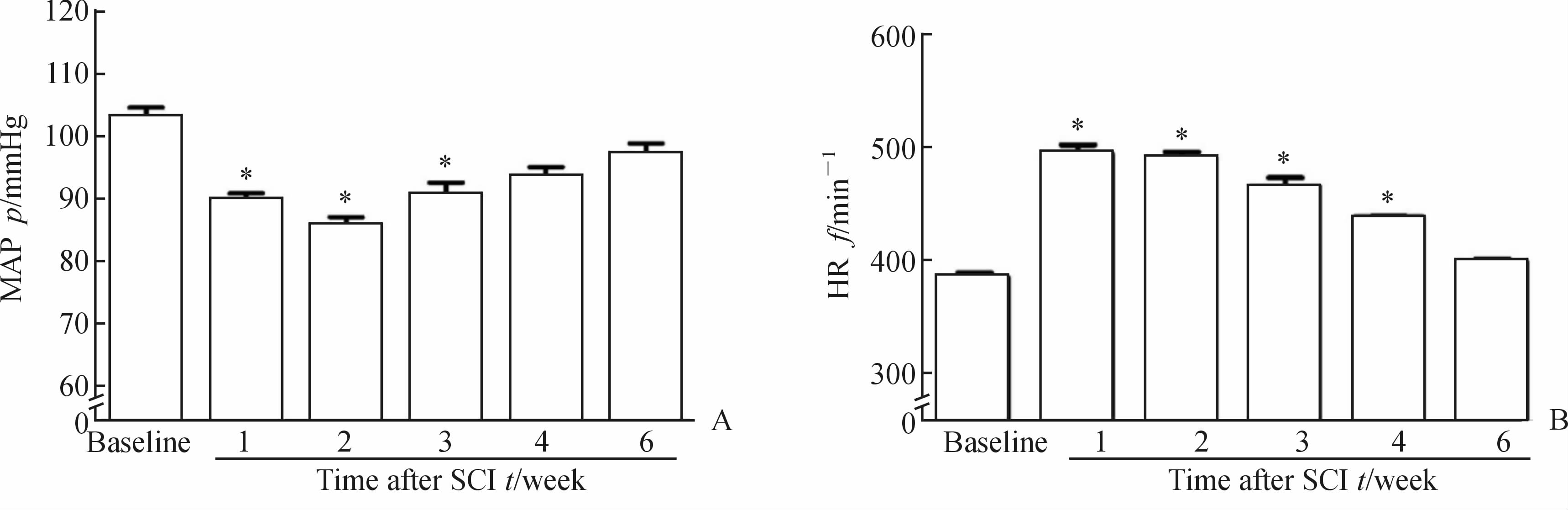
|
图 1 SCI组大鼠 MAP (A)及HR (B)的变化趋势
Fig 1 Time course changes of MAP (A) and HR (B) of rats in SCI group
SCI: Spinal cord injury;MAP: Mean arterial pressure; HR: Heart rate. 1 mmHg=0.133 kPa. *P<0.05 vs baseline; n=5, ±s ±s
|
SCI组大鼠NTS区NMDA-R1蛋白在SCI 后1、2、3、4周较损伤前明显升高(P<0.05),6周时恢复到SCI前水平。GABAA-α1蛋白在SCI后2周较损伤前明显升高(P<0.05),而4、6周时明显降低(P<0.05,图 2A~2C)。比较NMDA-R1与GABAA-α1蛋白表达的相对比值(图 3)发现,SCI后两种受体表达的稳态被打破,NMDA-R1/GABAA-α1明显升高,1周时升高至(3.6±0.4)倍(P<0.05),并于4周时达到峰值(14.7±4.4)倍(P<0.05)。而Control组大鼠不同时间点以上两种蛋白表达差异均无统计学意义(图 2D)。

|
图 2 SCI对NTS区NMDA-R1和GABAA-α1表达的影响
Fig 2 Effect of SCI on NMDA-R1 and GABAA-α1expression in the NTS area
SCI: Spinal cord injury;NTS: Solitary tract nucleus; NMDA-R1: N-methyl-D-aspartate receptor 1; GABAA-α1: Gamma-aminobutyric acid receptor A α1. A-C: SCI group; D: Control group. *P<0.05 vs baseline; n=5, ±s ±s
|
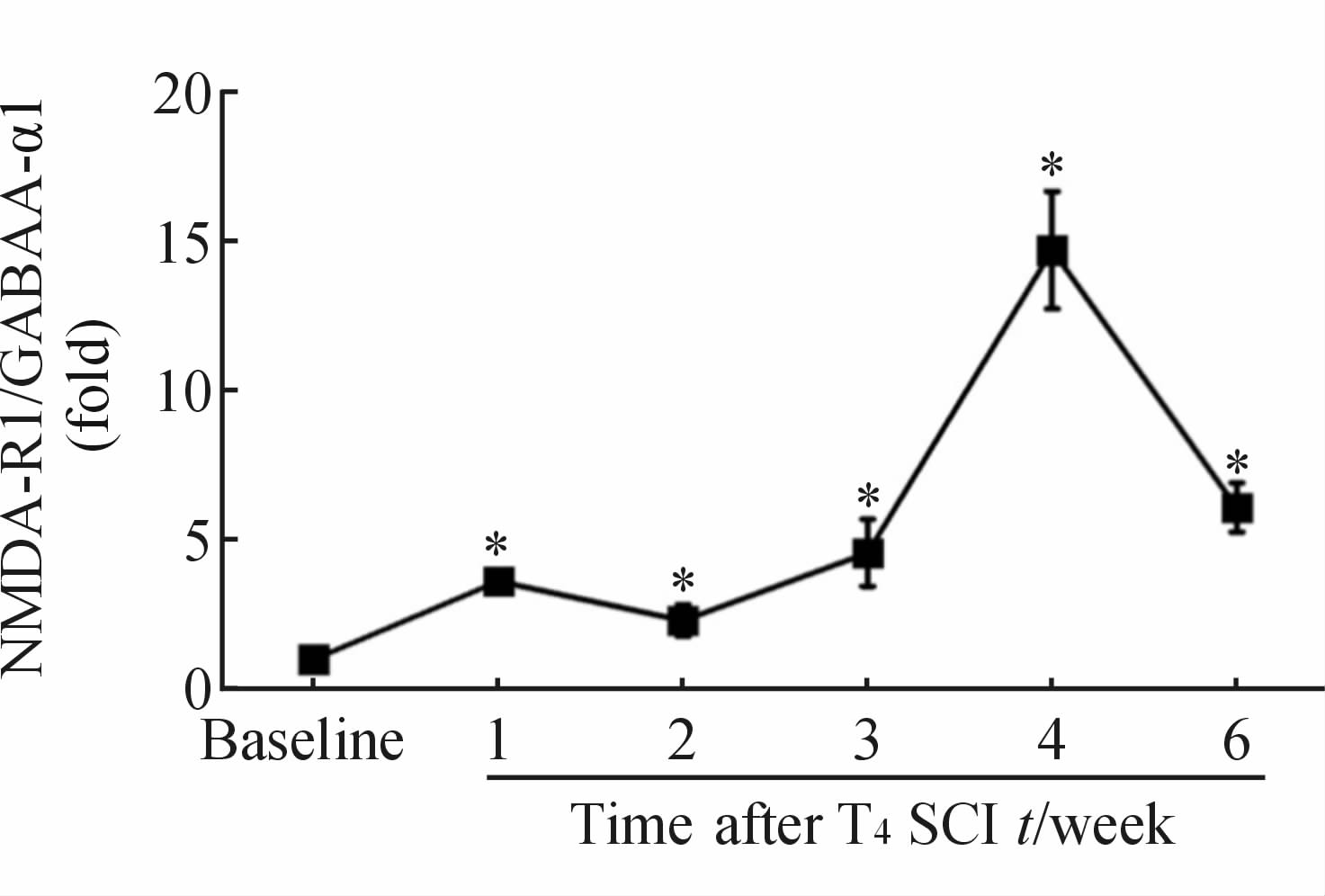
|
图 3 SCI后NMDA-R1/GABAA-α1比值的变化
Fig 3 Ratio of NMDA-R1 to GABAA-α1 protein in the NTS of rats after SCI
SCI: Spinal cord injury;NTS: Solitary tract nucleus; NMDA-R1: N-methyl-D-aspartate receptor 1; GABAA-α1: Gamma-aminobutyric acid receptor A α1. *P<0.05 vs baseline; n=5, ±s ±s
|
本实验研究了SCI后MAP、HR以及NTS区主要受体蛋白的变化趋势。实验结果发现,SCI后由于损伤平面以下神经失去中枢的支配,会出现脊髓休克的症状,表现为损伤后1周出现明显的MAP下降。伴随着MAP的下降,各脏器生理功能出现变化,进而引起心肺、内脏及压力感受器传入兴奋改变,是NTS区出现可塑性变化的前提。兴奋性氨基酸受体NMDA-R1被激活上调,comNTS可通过直接的兴奋性投射调控交感心血管中枢头端延髓腹外侧区(RVLM)传递冲动,使RVLM区交感传出兴奋增加,引起心脏做功增加、HR增快达到提升血压的作用[12]。但是本实验中由于兴奋性氨基酸glutamate受体仍未明显上调,因此其通路激发的升压作用有限。SCI后2周、3周NMDA-R1蛋白表达进一步上调,继续向RVLM区传递兴奋并使之保持高强度的交感张力,从而实现MAP的缓慢回升。抑制性氨基酸受体GABAA-α1蛋白表达在2周时有一个明显上升,起到部分抑制NMDA-R1过分激活的作用,然而我们计算NMDA-R1/GABAA-α1比值时发现,兴奋性氨基酸受体的激活远高于抑制性氨基酸受体,比值也较损伤前明显升高(P<0.05)。这表明SCI后心血管中枢主要通过兴奋性受体的上调来实现血压上升。SCI后4周时,MAP已逐渐恢复至损伤前水平,NMDA-R1蛋白表达有所回落,而此时抑制性GABAA-α1下调出现去抑制作用,继续维持交感输出的增加,NMDA-R1/GABAA-α1比值也达到了峰值。在维持MAP稳定的状态下,NTS区兴奋性及抑制性氨基酸受体又进行了再平衡,SCI后6周时NMDA-R1表达进一步下降并恢复至损伤前水平,GABAA-α1继续保持去抑制状态,NMDA-R1/GABAA-α1比值降低,一方面保证心血管系统再调节形成的新的稳态,另一方面减少长期交感高张力状态对各个脏器的损害。
已有研究表明,NTS区可以通过神经递质及受体的可塑性变化实现对病理生理状态下血压异常的再调节,从而实现心血管系统的稳定[13,14,15]。通过以上实验结果,我们认为SCI后脊髓休克等引起的血压下降或血流动力学改变兴奋心肺感受器、内脏感觉感受器、压力感受器等,使迷走神经、窦弓神经等向NTS区传递信号改变。长时间、大量传入冲动的改变可以刺激NTS区出现神经递质或受体的可塑性变化,从而保证血压的稳定。大鼠的NTS区域由于体积小,无法用常规的微透析技术来收集和检测细胞外液中谷氨酸及γ-氨基丁酸神经递质的含量。因此,我们无法判断SCI后NTS内这些重要神经递质是否也发生相应的改变,这也是本课题研究的一个不足。
综上所述,本研究结果表明SCI后大鼠心血管系统会出现严重的血压下降,心血管中枢NTS区NMDA-R1及GABAA-α1可以通过其可塑性变化参与心血管系统的再调节。这种作用或许对减少SCI后血压下降的严重程度、实现心血管系统的相对稳定起到一定的作用。本研究结果也为未来研究治疗SCI后心血管功能紊乱提供了一个新的思路。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Myers J,Lee M,Kiratli J. Cardiovascular disease in spinal cord injury: an overview of prevalence,risk,evaluation,and management[J].Am J Phys Med Rehabil,2007,86:142-152. |
| [2] | Grigorean V T,Sandu A M,Popescu M,Iacobini M A,Stoian R,Neascu C,et al.Cardiac dysfunctions following spinal cord injury[J].J Med Life,2009,2:133-145. |
| [3] | Hagen E M,Rekand T,Gronning M,Faerestrand S. Cardiovascular complications of spinal cord injury[J].Tidsskr Nor Laegeforen,2012,132:1115-1120. |
| [4] | Gunduz H,Binak D F.Autonomic dysreflexia:an important cardiovascular complication in spinal cord injury patients[J].Cardiol J,2012,19:215-219. |
| [5] | Popa C,Popa F,Grigorean V T,Onose G,Sandu A M,Popescu M,et al.Vascular dysfunctions following spinal cord injury[J].J Med Life,2010,3:275-285. |
| [6] | Grossman R G,Frankowski R F,Burau K D,Toups E G,Crommett J W,Johnson M M,et al.Incidence and severity of acute complications after spinal cord injury[J].J Neurosurg Spine,2012,17(1 Suppl):119-128. |
| [7] | Krassioukov A V,Fehlings M G.Effect of graded spinal cord compression on cardiovascular neurons in the rostro-ventro-lateral medulla[J].Neuroscience,1999,88:959-973. |
| [8] | Hermes S M,Colbert J F,Aicher S A.Differential content of vesicular glutamate transporters in subsets of vagal afferents projecting to the nucleus tractus solitarii in the rat[J].J Comp Neurol,2014,522:642-653. |
| [9] | Jacob J E,Pniak A,Weaver L C,Brown A.Autonomic dysreflexia in a mouse model of spinal cord injury[J].Neuroscience,2001,108:687-693. |
| [10] | Basso D M,Beattie M S,Bresnahan J C.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J].Exp Neurol,1996,139:244-256. |
| [11] | Paxinos G,Watson C R,Emson P C. AChE-stained horizontal sections of the rat brain in stereotaxic coordinates[J].J Neurosci Methods,1980,3:129-149. |
| [12] | Pamenter M E,Carr J A,Go A,Fu Z,Reid S G,Powell F L.Glutamate receptors in the nucleus tractus solitarius contribute to ventilatory acclimatization to hypoxia in rat[J].J Physiol,2014,592(Pt 8):1839-1856. |
| [13] | Lawrence A J,Jarrott B.Neurochemical modulation of cardiovascular control in the nucleus tractus solitarius[J].Prog Neurobiol,1996,48:21-53. |
| [14] | Totola L T,Alves T B,Takakura A C,Ferreira-Neto H C,Antunes V R,Menani J V,et al.Commissural nucleus of the solitary tract regulates the antihypertensive effects elicited by moxonidine[J].Neuroscience,2013,250:80-91. |
| [15] | Abegaz B,Davern P J,Jackson K L,Nguyen-Huu T P,Bassi J K,Connelly A,et al.Cardiovascular role of angiotensin type1A receptors in the nucleus of the solitary tract of mice[J].Cardiovasc Res,2013,100:181-191. |
 2014, Vol. 35
2014, Vol. 35


