*Corresponding author.
膀胱癌是临床上最常见的泌尿系统恶性肿瘤之一,以男性多发[1,2],其中70%~80%为浅表肿瘤[3]。浅表膀胱癌目前首选的治疗方法是经尿道肿瘤电切或膀胱肿瘤局部切除和膀胱内灌注药物化疗,常见的浅表性膀胱癌手术切除能取得良好的近期疗效,但复发率高达50%~70%[4]。而化疗药物如吡柔比星(pirarubicin)膀胱内灌注治疗或预防膀胱癌的复发在临床上已经取得肯定效果,并被广泛应用[5]。吡柔比星为蒽环类抗肿瘤抗生素,能快速进入癌细胞,分布于细胞核,阻抑核酸合成,使肿瘤细胞停止增殖直至死亡[6]。但吡柔比星抑制膀胱癌细胞增殖的分子机制还有待进一步阐明。
磷脂酶Cε(phospholipase C ε,PLCε)具有促进肿瘤生长、增殖的作用,其在多种肿瘤组织中表达水平显著升高,沉默或抑制其表达可显示出显著的肿瘤抑制效应[7,8,9]。本研究拟以PLCε为切入点,探讨吡柔比星能否抑制PLCε在膀胱癌细胞中的表达,进而抑制膀胱肿瘤细胞增殖,为明确吡柔比星治疗膀胱癌的分子机制提供新的思路。
1 材料和方法 1.1 材料
人膀胱癌细胞株BIU-87购自武汉大学细胞库,T24为重庆医科大学传染病研究所惠赠,在37℃、5%CO2、饱和湿度条件下培养于含有10%新生牛血清的RPMI 1640培养液中,RPMI 1640培养液和新生牛血清购于Gibco公司。PLCε干扰腺病毒载体(Ad-shPLCε)为本课题组前期构建[10]并保存于-80℃。 吡柔比星购于深圳万乐药业有限公司;四甲基偶氮唑盐(MTT)试剂和二甲亚砜(DMSO )购自Sigma公司;TRIzol RNA提取试剂盒、RT-PCR试剂盒、qPCR试剂盒为宝生物工程(大连)有限公司产品;PCR引物由Invitrogen公司合成;细胞凋亡检测试剂盒由重庆医科大学生命科学院流式细胞实验室提供;RIPA裂解液购自博迈德生物技术有限公司;羊抗人PLCε单克隆抗体购自美国Santa Cruz公司;兔抗人Bcl-2多克隆抗体购自美国ImmunoWay公司;β-actin、GAPDH单克隆抗体及HRP标记的兔抗羊二抗、羊抗鼠二抗、羊抗兔二抗均购于北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒、ECL显色试剂盒购自碧云天生物技术研究所。
1.2 吡柔比星对T24和BIU-87细胞生长及PLCε、Bcl-2表达的影响 1.2.1 MTT法检测T24和BIU-87细胞增殖取对数期生长的T24和BIU-87细胞,经0.25%胰蛋白酶消化制成细胞悬液,调整细胞密度为1×105个/mL,接种于96孔板中,最后补充培养液至200 μL。分为对照组及0.4、0.8、1.6、3.2 mg/L吡柔比星处理组,每组设6个复孔,同时接种3个96孔板,37℃、5%CO2恒温培养箱中培养。分别给予不同处理后,于培养24、48、72 h后弃上清,每孔加入20 μL的MTT(5g/L)继续培养4h后,小心吸去上清,加入DMSO150 μL,振荡孵育10 min,用全自动酶标仪在492 nm处检测各孔的光密度(D值) 计算各组细胞生长抑制率,公式如下: 抑制率(%)=[1-(D处理-D调零)/ (D对照-D调零)]×100%。
1.2.2 流式细胞术检测T24和BIU-87细胞凋亡收集不同浓度(0.4、0.8、1.6、3.2 mg/L)吡柔比星处理48、72 h的T24和BIU-87细胞,磷酸二氢盐缓冲液(PBS)洗涤,300×g离心10min,RNase A(0.5 g/L)37℃消化30min ,加入50g/L碘化丙啶(PI)染色,室温避光15min ,用FACScan分析细胞凋亡的变化。
1.2.3 qRT-PCR和RT-PCR方法检测PLCε和Bcl-2 mRNA的表达将细胞以1×106个/孔的密度接种于6孔板中,待细胞生长融合度达到80%~90%,用不同浓度(0.4、0.8、1.6、3.2 mg/L)的吡柔比星(PBS配制)分别处理T24和BIU-87细胞,在不同时间点(24、48、72 h)采用TRIzol法抽提总RNA,用反转录试剂盒将所抽提的RNA反转录为cDNA。PLCε上游引物5′-CAT GGA AGG ATA AGC GTT-3′,下游引物5′-CCC AAG TCC CGT GTT AAG A-3′,扩增产物为395bp; Bcl-2上游引物5′-TTG TGG CCT TCT TTG AGT TCG-3′,下游引物5′-CAC CTA CCC AGC CTC CGT TAT -5′,扩增产物为153bp; β-actin上游引物5′-GGG ACC TGA CTG ACT ACC TC-3′,下游引物5′-CGT CAT ACT CCT GCT TGC TG-3′,扩增产物为534bp。采用qRT-PCR方法检测PLCε mRNA的表达,以2-ΔCt计算其表达量;采用RT-PCR检测Bcl-2 mRNA的表达。PCR反应条件: 95℃ 预变性5 min;95℃变性30s,56℃退火30s,72℃延伸40s,共30个循环;72℃继续延伸5min。采用Quantity One软件进行灰度分析,通过目的蛋白与内参的灰度比值计算Bcl-2 mRNA的相对表达量。
1.2.4 蛋白质印迹法检测PLCε、Bcl-2蛋白的表达T24和BIU-87细胞分别用不同浓度(0.4、0.8、1.6、3.2 mg/L)的吡柔比星处理72 h,然后提取各组细胞的总蛋白,BCA法测定蛋白浓度,经SDS-PAGE电泳后,电转移至PVDF膜,用5%脱脂奶粉在室温下封闭2 h;加入一抗,4℃孵育过夜;TBST洗膜,加入5%脱脂奶粉稀释的HRP标记的二抗,37℃孵育1 h;TBST洗膜,ECL暗室化学发光显影。采用凝胶成像系统扫描图像,Quantity One分析软件进行灰度定量分析,并将目的蛋白与内参β-actin、GAPDH的积分光密度的比值作为目的蛋白的相对表达量。
1.3 吡柔比星联合Ad-shPLCε处理对T24和BIU-87细胞生长及Bcl-2表达的影响常规培养细胞,将细胞分为空白对照组、吡柔比星单独处理组、Ad-shPLCε单独处理组及吡柔比星联合Ad-shPLCε处理组。待细胞密度达60%~70%融合度,吡柔比星联合Ad-shPLCε处理组给予Ad-shPLCε处理24 h,然后加入1.6 mg/L吡柔比星继续培养24 h;吡柔比星单独处理组、Ad-shPLCε单独处理组仅给予单一处理,空白对照组不作任何处理。采用MTT法检测细胞增殖,蛋白质印迹法检测Bcl-2蛋白的表达,方法同前。
1.4 统计学处理
采用SPSS 17.0统计软件进行分析,结果以 ±s表示,组间均数的比较采用单因素方差分析(ANOVA),两两比较采用SNK法。检验水准(α)为0.05。
±s表示,组间均数的比较采用单因素方差分析(ANOVA),两两比较采用SNK法。检验水准(α)为0.05。
MTT检测结果显示,吡柔比星能够抑制T24和BIU-87细胞的增殖,并呈现出一定的剂量和时间依赖性(图 1)。流式细胞术检测结果显示,吡柔比星处理T24和BIU-87细胞48、72 h后,明显增加了凋亡细胞数,且处理72 h时的凋亡细胞数明显高于48 h和空白组(P<0.05,图 2)。
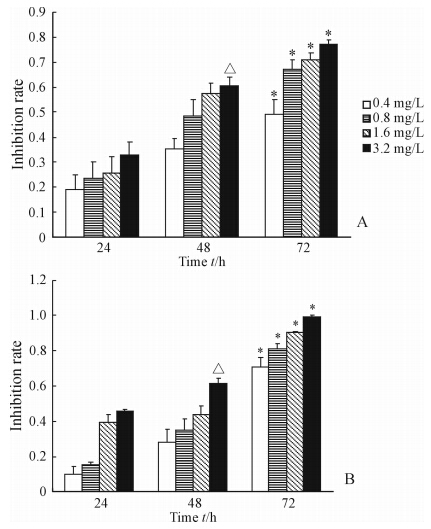 | 图 1 MTT法检测不同浓度吡柔比星对T24(A)和BIU-87(B)细胞增殖的影响Fig. 1 Effect of pirarubicin on proliferation of T24(A) and BIU-87(B) cells as detected by MTT*P<0.05 vs 48 h,△P<0.05 vs 1.6 mg/L; n=3, ±s ±s |
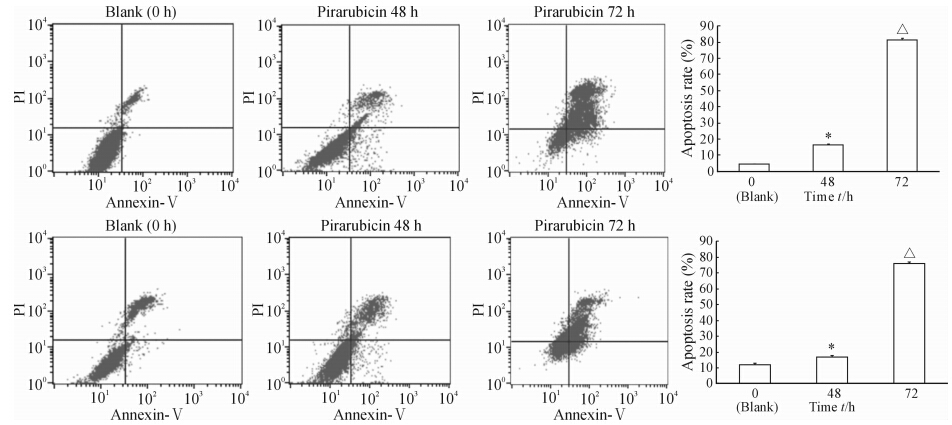 | 图 2 流式细胞术检测吡柔比星对T24 (A)和BIU-87(B)细胞凋亡的影响Fig. 2 Effect of pirarubicin on apoptosis of T24(A) and BIU-87(B) cells as detected by flow cytometry*P<0.05 vs blank,△P<0.05 vs 48 h; n=3, ±s ±s |
qRT-PCR和RT-PCR检测结果显示,T24和BIU-87细胞经吡柔比星处理后,PLCε和Bcl-2 mRNA的表达均明显受到抑制,并呈现出一定的剂量和时间依赖性(图 3、图 4)。蛋白质印迹结果显示,不同浓度吡柔比星处理T24、BIU-87细胞72 h后,PLCε的蛋白表达量明显降低,并呈现一定的剂量依赖性(图 5)。
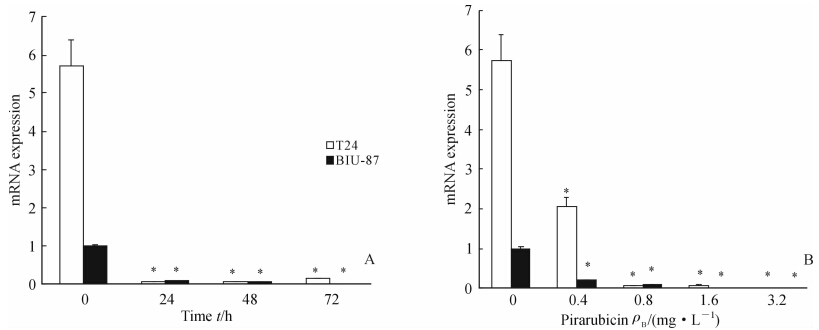 | 图 3 qRT-PCR检测吡柔比星对T24和BIU-87细胞PLCε mRNA表达的影响Fig. 3 Expression of PLC ε mRNA in T24 and BIU-87 cells after pirarubicin treatment as detected by qRT-PCRA: The expression of PLC ε in BIU-87 and T24 cells treated with 1.6 mg/L pirarubicin for 24,48,and 72 h; B: The expression of PLC ε in BIU-87 and T24 cells treated with the increasing dose of pirarubicin for 72 h.*P<0.05 vs blank (0 h) group; n=3, ±s ±s |
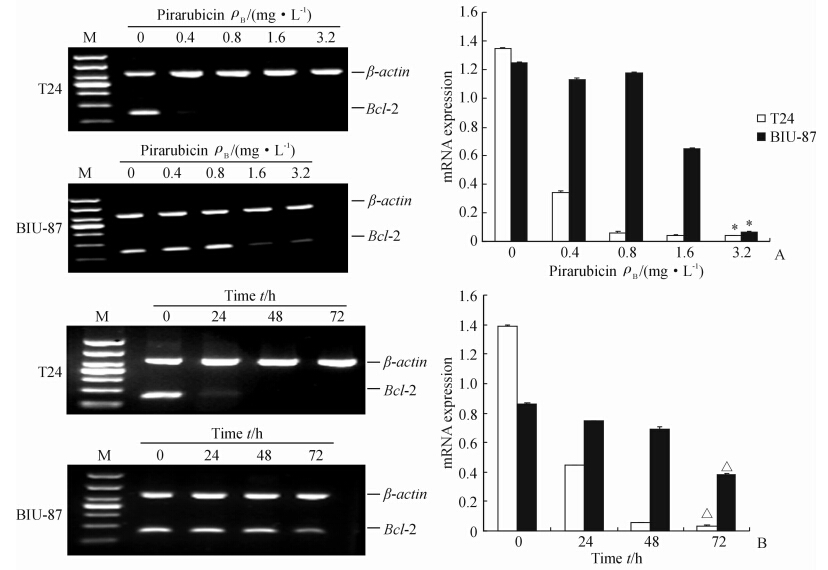 | 图 4 RT-PCR检测吡柔比星对T24和BIU-87细胞Bcl-2 mRNA表达的影响Fig. 4 Expression of Bcl-2 mRNA in T24 and BIU-87 cells after pirarubicin treatment as detected by RT-PCRA:The expression of Bcl-2 in T24 and BIU-87 cells treated with increasing dose of pirarubicin for 72 h;B:The expression of Bcl-2 in T24 and BIU-87 cells treated with 1.6 mg/L pirarubicin for 24,48,and 72 h. *P<0.05 vs 0,0.4,0.8 mg/L; △P<0.05 vs 0,24,48 h. n=3, ±s ±s |
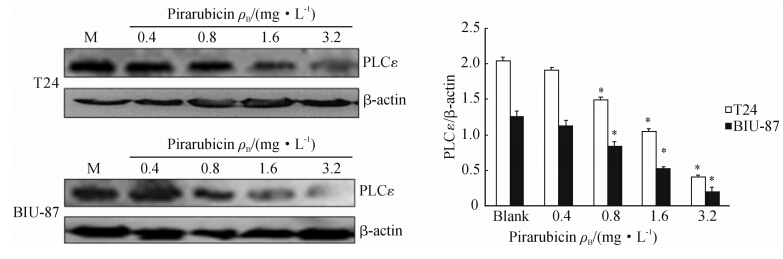 | 图 5 蛋白质印迹法检测吡柔比星对T24和BIU-87细胞PLCε蛋白表达的影响Fig. 5 Protein expression of PLCε in T24 and BIU-87 cells after pirarubicin treatment as detected by Western blotting analysis*P<0.05 vs blank group; n=3, ±s ±s |
MTT结果显示,吡柔比星单独处理、Ad-shPLCε单独处理、Ad-shPLCε联合吡柔比星处理均能抑制细胞增殖,且Ad-shPLCε联合吡柔比星处理组的抑制作用高于吡柔比星处理组,差异具有统计学意义(P<0.05,图 6)。
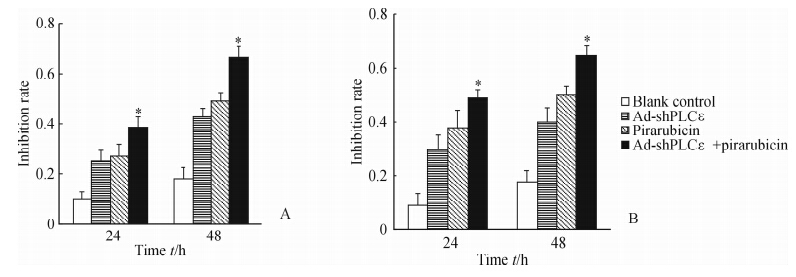 | 图 6 MTT法检测吡柔比星联合Ad-shPLCε处理对T24(A)和BIU-87(B)细胞增殖的影响Fig. 6 Proliferation of T24(A)and BIU-87(B)cells after different treatments as detected by MTT*P<0.05 vs pirarubicin group; n=3, ±s ±s |
2.4 吡柔比星联合Ad-shPLCε处理对Bcl-2蛋白表达的影响
蛋白质印迹结果显示,吡柔比星和Ad-shPLCε联合处理T24 和BIU-87细胞后,Bcl-2蛋白表达下调的程度高于Ad-shPLCε及吡柔比星单独处理组,与吡柔比星单独处理组比较,差异具有统计学意义(P<0.05,图 7)。
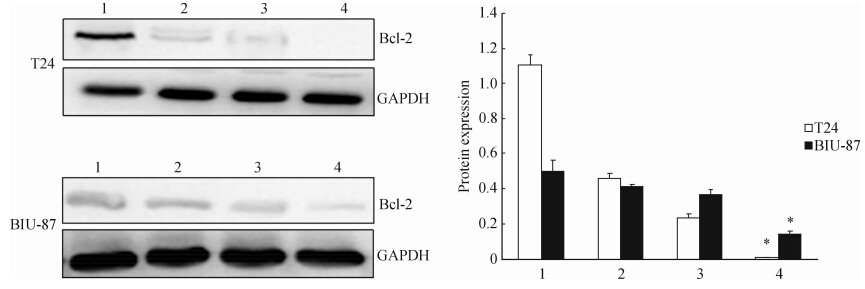 | 图 7 蛋白质印迹法检测吡柔比星联合Ad-shPLCε处理对T24和BIU-87细胞Bcl-2蛋白表达的影响Fig. 7 Protein expression of Bcl-2 in T24 and BIU-87 cells after different treatments as detected by Western blotting analysis1: Blank control; 2:Ad-shPLCε;3:Pirarubicin;4:Ad-shPLCε+pirarubicin.*P<0.05 vs pirarubicin group; n=3, ±s ±s |
3 讨 论
PLCε是2001年由Song 等[7]发现并鉴定的一种新型人源磷脂酰肌醇磷脂酶C,与新杆线虫PLC210有同源性并不同于所有哺乳动物中已知PLC同工酶,其C端有2个RA结构域(RA1和RA2),N端有一个RasGEF结构域,可通过RA2结构域与H-Ras的GTP结合而被激活。近几年的研究证实,PLCε具有致癌基因的特性。研究发现PLCε在化学致癌物诱导形成的皮肤癌及炎症中发挥重要作用[8,11];PLCε参与头颈部鳞状细胞癌的信号转导及骨架蛋白的调节[12];同时,日本学者证实在PLCε敲除小鼠中,皮肤癌的生长受到明显抑制[13]。本课题组的前期研究显示:PLCε在膀胱癌组织的表达明显高于癌旁组织,且与肿瘤分期相关[14];在膀胱癌细胞中,PLCε可通过PLCε-PKCα信号通路促进癌细胞的增殖[15,16];另外,敲除PLCε可抑制膀胱癌细胞的侵袭、转移 [17]。
目前,对作用于PLCε的临床化疗药物研究较少。本研究从体外实验出发,用不同浓度的吡柔比星处理膀胱癌BIU-87和T24 细胞,发现吡柔比星可以抑制体外高度及中度恶性膀胱癌细胞的增殖,并可促使细胞凋亡;探究其机制发现吡柔比星可使致癌基因PLCε的表达降低并抑制凋亡相关调节基因Bcl-2的表达。我们将吡柔比星联合PLCε的干扰腺病毒载体(Ad-shPLCε)处理膀胱癌细胞,结果显示,二者联合能够进一步增强对膀胱癌细胞的增殖及Bcl-2蛋白表达的抑制作用。然而,吡柔比星对膀胱癌细胞的增殖抑制作用是否源于对PLCε基因的表达抑制进而抑制下游Bcl-2基因的表达,又或者是吡柔比星对下游PLCε及Bcl-2的共同抑制作用,即PLCε和Bcl-2处于平行关系而非上、下游关系,这些问题都需要进一步研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Siegel R,Naishadham D,Jemal A.Cancer statistics [J].CA Cancer J Clin,2013,63:11-30. |
| [2] | 吴阶平.吴阶平泌尿外科学[M].济南:山东科学技术出版社,1993:453-457. |
| [3] | Chamie K,Litwin M S,Bassett J C,Daskivich T J,Lai J,Hanley J M,et al.Recurrence of high-risk bladder cancer: a population-based analysis[J].Cancer,2013,119:3219-3227. |
| [4] | 陈忠,李家贵,叶章群,杨为民,张旭,曾晓勇.联合灌注预防浅表性膀胱肿瘤术后复发的临床观察[J].肿瘤防治研究,2005,32:108-110. |
| [5] | 魏辉,梅骅.表浅膀胱癌的膀胱灌注疗法[J].临床泌尿外科杂志,2003,18:565-566. |
| [6] | Kawano H,Komaba S,Yamasaki T,Maeda M,Kimura Y,Maeda A,et al.New potential therapy for orthotopic bladder carcinoma by combining HVJ envelope with doxorubicin [J].Cancer Chemother Pharmacol,2008,61:973-978. |
| [7] | Song C,Hu C D,Masago M,Kariyai K,Yamawaki- Kataoka Y,Shibatohge M,et al.Regulation of a novel human phospholipase C:PLC epsilon through membrane targeting by Ras [J].J Biol Chem,2001,276:2752-2757. |
| [8] | Bai Y,Edamatsu H,Maeda S,Saito H,Suzuki N,Satoh T,et al.Crucial role of phospholipase C epsilon in chemical carcinogen-induced skin tumor development[J].Cancer Res,2004,64: 8808-8810. |
| [9] | Li M,Edamatsu H,Kitazawa R,Kitazawa S,Kataoka T.Phospholipase C epsilon promotes intestinal tumorigenesis of Apc(Min/+) mice through augmentation of inflammation and angiogenesis[J].Carcinogenesis,2009,30: 1424-1432. |
| [10] | 张彦懿,欧俐苹,刘琪,陶佳,吴小侯,罗春丽.PLCε基因shRNA重组腺病毒表达质粒的构建及鉴定[J].中国生物制品学杂志,2013,26:51-55. |
| [11] | Ikuta S,Edamatsu H,Li M,Hu L,Kataoka T.Crucial role of phospholipase C epsilon in skin inflammation induced by tumor-promoting phorbol ester[J].Cancer Res,2008,68:64-72. |
| [12] | Bourguignon L Y,Gilad E,Brightman A,Diedrich F,Singleton P.Hyaluronan-CD44 interaction with leukemia-associated RhoGEF and epidermal growth factor receptor promotes Rho/Ras co-activation,phospholipase C epsilon-Ca2+ signaling,and cytoskeleton modification in head and neck squamous cell carcinoma cells[J].J Biol Chem,2006,281:14026-14040. |
| [13] | Oka M,Edamatsu H,Kunisada M,Hu L,Takenaka N,Dien S,et al.Enhancement of ultraviolet B-induced skin tumor development in phospholipase C ε-knockout mice is associated with decreased cell death[J].Carcinogenesis,2010,31:1897-1902. |
| [14] | 郭永灿,罗春丽,蔡晓钟,吴小候,蒲军.磷脂酶Cε基因在膀胱移行细胞癌中表达及其临床意义[J].临床检验杂志,2008,26:52-54. |
| [15] | Ling Y,Chunli L,Xiaohou W,Qiaoling Z.Involvement of the PLCε/PKCα pathway in human BIU-87 bladder cancer cell proliferation[J].Cell Biol Int,2011,35:1031-1036. |
| [16] | Cheng H,Luo C,Wu X,Zhang Y,He Y,Wu Q,et al.shRNA targeting PLCε inhibits bladder cancer cell growth in vitro and in vivo[J].Urology,2011,78:474. |
| [17] | Ou L,Guo Y,Luo C,Wu X,Zhao Y,Cai X.RNA interference suppressing PLCε1 gene expression decreases invasive power of human bladder cancer T24 cell line[J].Cancer Genet Cytogenet,2010,200:110-119. |
 2014, Vol. 35
2014, Vol. 35


