*通信作者
*Corresponding author.
组蛋白乙酰基转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰基酶(histone deacetylase,HDAC)在调节真核生物基因转录过程中起着重要作用,高乙酰化标志活跃转录而低乙酰化则与转录抑制相关。包括乳腺癌在内的许多恶性肿瘤的发生发展中,其癌基因和抑癌基因的表达失调与组蛋白乙酰化修饰失衡密切相关,一些非组蛋白异常乙酰化修饰在肿瘤发生发展中也具有重要地位[1, 2]。
雌激素是促进雌激素受体(ER)阳性乳腺癌增殖的重要因素,目前研究提示其作用机制与乙酰化异常改变有关[3]。雌激素可能影响癌基因组蛋白或非组蛋白乙酰化水平,由此促进癌基因表达及促进肿瘤细胞转化、增殖增强和凋亡抑制。细胞周期素D1(cyclin D1)是雌激素可能影响的重要细胞周期调控蛋白之一,其表达是促进肿瘤细胞增殖的重要基础。雌激素亦能激活抗凋亡蛋白Bcl-2、Bcl-xL,下调促凋亡蛋白Bax、Bad、Bcl-xS的表达,从而抑制细胞凋亡[4]。除经典的雌激素反应元件(estrogen response element,ERE)途径外,雌激素还可通过与其他转录因子如激活蛋白 1(activator protein 1,AP-1)、刺激蛋白1(stimulating protein 1,SP-1)、核因子κB(nuclear factor-kappa B,NF-κB)等相互作用调节基因转录。有研究表明,NF-κB的活化在雌激素促肿瘤细胞增殖中有重要意义[5]。雌激素可能通过P300/CBP对NF-κB的乙酰化发挥重要作用,NF-κB/p65不同赖氨酸位点的乙酰化具有不同功能,p65赖氨酸310位点乙酰化可增强其转录活性[6],促进有关靶基因表达[7]。
本研究以ER阳性人乳腺癌细胞MCF-7为实验对象,采用乙酰化酶抑制剂Garcinol,观察其对雌激素促乳腺癌细胞MCF-7增殖、抑制凋亡的影响,检测组蛋白H3、H4和非组蛋白NF-κB/p65乙酰化水平,以及cyclin D1、Bcl-2、Bcl-xL表达,探讨乙酰化酶抑制剂Garcinol对雌激素促乳腺癌细胞MCF-7增殖的作用与机制。 1 材料和方法 1.1 材料
乳腺癌细胞MCF-7由重庆医科大学基础医学院病理生理学教研室提供。无酚红DMEM干粉培养基(美国SAFC Bioscience公司),新生牛血清(美国Gibco公司)。乙酰化酶抑制剂Garcinol(美国Enzo Life Science公司),17β-雌二醇(17β-E2,美国Cayman公司)。乙酰化(ac)-H3、ac-H4兔抗人单克隆抗体,NF-κB/ac-p65兔抗人单克隆抗体(美国Abcam公司),H3兔抗人单克隆抗体(美国BioLegend公司),NF-κB/p65兔抗人多克隆抗体(北京信路威科技股份有限公司),cyclin D1兔抗人单克隆抗体(美国Epitomics公司),Bcl-xL兔抗人多克隆抗体(北京博奥森生物技术有限公司),Bcl-2兔抗人多克隆抗体、β-actin鼠抗人单克隆抗体、HRP标记山羊抗小鼠IgG、HRP标记山羊抗兔IgG(北京中杉金桥生物技术有限公司),FITC-羊抗兔IgG(武汉博士德生物工程有限公司)。CCK-8试剂盒(碧云天生物技术研究所),RT-PCR试剂盒(北京百泰克生物技术有限公司)。自动酶标仪、PAGE凝胶电泳仪、垂直电泳槽、PCR仪、电泳凝胶图像分析系统(美国 Bio-Rad 公司),FACScan型流式细胞仪(美国 Becton Dickinson公司),Leica Sp2激光共聚焦显微镜(德国Leica公司)。去雌激素新生牛血清按文献[8]方法制备。 1.2 细胞培养
乳腺癌细胞MCF-7常规复苏,培养于含10%去雌激素新生牛血清、1×105U/L青霉素、100 mg/L链霉素的无酚红高糖DMEM培养液中。置于37℃、5%CO2及饱和湿度的孵箱中培养。 1.3 CCK-8法检测细胞增殖
取对数生长期的MCF-7细胞,调整细胞密度为2×104个/mL,接种于3块96孔培养板中,每孔200 μL。本课题组在前期工作中完成17β-E2促MCF-7细胞增殖的最佳有效浓度测定[9]。设置试剂对照组、未处理细胞组、17β-E2(100 nmol/L)处理组、17β-E2(100 nmol/L)联合Garcinol处理组(10、20、30、40、50 μmol/L 5个浓度),每组设5个平行孔。细胞接种24 h后加药,置于37℃、5% CO2及饱和湿度的孵箱内培养。药物分别作用24、48、72 h后,按照CCK-8试剂盒说明书每孔加入20 μL CCK-8试剂,继续在培养箱中培养2 h后用酶标仪在450 nm波长处测光密度(D450)值。实验重复3次。Garcinol对17β-E2促细胞增殖的抑制率 (%)=[1-(17β-E2联合Garcinol组D450-未处理细胞组D450)/(17β-E2组D450-未处理细胞组D450)] ×100%。根据抑制率求取半效抑制浓度,确定后续实验处理细胞的浓度和时间。 1.4 流式细胞术检测细胞周期
实验分为未处理细胞组、17β-E2(100 nmol/L)处理组、17β-E2(100 nmol/L)联合Garcinol(35 μmol/L)处理组。细胞接种24 h后加药,培养48 h,收集各组细胞,经预冷的PBS离心洗涤2次,以-20℃预冷的70%乙醇固定,4℃冰箱放置24 h,PBS 洗涤1 次,然后加20 mg/L核糖核酸酶A(RNaseA),37℃水浴1 h,再加100 mg/L碘化丙啶(PI),4℃避光染色30 min,流式细胞仪测定荧光强度(激发光波长为 488 nm)。采用ModFit 2.0分析软件进行细胞周期DNA含量分析。实验重复3次。 1.5 流式细胞术检测细胞凋亡
细胞分组及处理同1.4项,用不含EDTA的胰酶消化收集各组细胞,调整细胞密度为1×106个/mL,取1 mL细胞悬液用预冷PBS离心洗涤2次。加入500 μL的结合缓冲液悬浮细胞,加入5 μL Annexin Ⅴ-FITC混匀后,加入5 μL PI,混匀,室温、避光反应5~15 min。立即上流式细胞仪检测。实验重复3次。 1.6
细胞免疫荧光术检测NF-κB/p65核转运情况 细胞分组和处理同1.4项,取对数生长期的细胞,调整细胞密度为5×103个/mL进行爬片,细胞接种24 h后加药,培养48 h。PBS漂洗3次,每次5 min,用4%多聚甲醛室温固定细胞30 min,PBS同上漂洗后加0.5% Triton打孔30 min,PBS同上漂洗,正常封闭用山羊血清封闭1 h,滴加1 50的兔抗人多克隆NF-κB/p65抗体,4℃避光孵育过夜,PBS同上漂洗后加1 40的FITC标记的羊抗兔IgG,37℃避光孵育1 h,PBS同上漂洗后加1 1 000的PI室温染色30 s,抗荧光淬灭封片液封片,激光共聚焦显微镜半定量分析荧光强度。实验重复3次。 1.7 RT-PCR检测cyclin D1、Bcl-2 、Bcl-xL mRNA表达
细胞分组和处理同1.4项,按照高纯总RNA快速提取试剂盒(离心柱型)说明书操作步骤提取各组MCF-7细胞总RNA,测定RNA纯度与浓度,按反转录试剂盒说明书先反转录合成第1条cDNA,再以等量的cDNA为模板进行PCR反应。Cyclin D1引物:上游 5′-GCG AGG AAC AGA AGT GCG-3′,下游 5′-TGG AGT TGT CGG TGT AGA TGC -3′,扩增产物长度为192 bp。Bcl-2引物:上游 5′-ATG TGT GTG GAG AGC GTC AAC-3′,下游 5′-AGA CAG CCA GGA GAA ATC AAA C-3′,扩增产物长度为221 bp。Bcl-xL引物:上游 5′-CCA CTT ACC TGA ATG ACC ACC TA-3′,下游 5′-TGT TCC CAT AGA GTT CCA CAA A-3′,扩增产物长度为376 bp。β-actin引物: 上游 5′-CTG GGA CGA CAT GGA GAA AA-3′,下游 5′-AAG GAA GGC TGG AAG AGT GC-3′,扩增产物长度为564 bp。反应条件: 94℃预变性3 min后,95℃ 50 s、59.5℃ 45 s、72℃ 40 s共35个循环,最后72℃延伸10 min。取5 μL PCR产物行1.5%琼脂糖凝胶电泳,GoodView显色,Quantity One软件分析各扩增产物的表达量。实验重复3次。
1.8 蛋白质印迹分析检测ac-H3、ac-H4、NF-κB/ac-p65、cyclin D1、Bcl-2、Bcl-xL蛋白表达
细胞分组和处理同1.4项。收集各组细胞到1.5 mL EP管中,按1×106个细胞加1 mL RIPA和10 μL 苯甲基磺酰氟(PMSF)。置于冰上裂解30 min,每间隔10 min在涡旋振荡器上充分震荡裂解。2 400×g 4℃离心15 min,取上清于-80℃保存。BCA法测定蛋白浓度。行聚丙烯酰胺凝胶电泳(PAGE),转移至PVDF膜,5%脱脂牛奶室温封闭2 h后加一抗,4℃孵育过夜,TBST洗膜后加二抗,37℃孵育2 h,ECL显色,用Bio-Rad图像分析系统拍照,Quantity One软件分析蛋白相对表达量。实验重复3次。 1.9 统计学处理
采用SPSS 17.0 软件,数据以 x±s 表示,两组间比较采用t检验,多组间比较采用单因素方差分析。检验水准(α)为 0.05。 2 结 果 2.1
Garcinol对雌激素促MCF-7细胞增殖的影响 100 nmol/L 17β-E2联合不同浓度Garcinol分别作用MCF-7细胞24、48、72 h,随作用时间延长和剂量增加,细胞增殖抑制率升高(P<0.01,图 1),说明Garcinol 对雌激素促MCF-7细胞增殖有抑制作用。根据抑制率求取半效抑制浓度,以35 μmol/L Garcinol作用48 h用于后续实验。
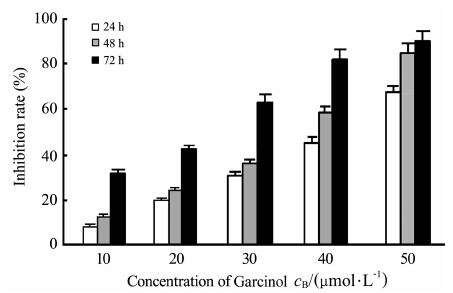
|
图 1 Garcinol对雌激素促MCF-7细胞增殖的抑制作用 Fig 1 Inhibitory effect of Garcinol against proliferation of MCF-7 cells treated with 17β-estradiol P<0.01 among different concentrations and time groups; n=15,x±s |
2.2 Garcinol对雌激素所致细胞周期转化的影响
结果(图 2)显示,与未处理细胞组比较,100 nmol/L 17β-E2作用MCF-7细胞48 h,G0/G1期细胞比例降低,G2/M期比例增加(P<0.01);17β-E2联合Garcinol(35 μmol/L)处理后G0/G1期细胞比例增加,S期和G2/M期比例降低(P<0.01)。
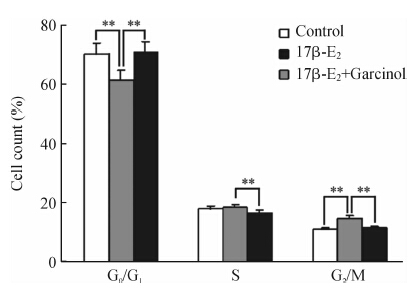
|
图 2 Garcinol对雌激素处理的MCF-7细胞周期的影响 Fig 2 Effect of Garcinol on MCF-7 cell cycle after treated with 17β-estradiol(17β-E2) **P<0.01; n=3,x±s |
与未处理细胞组[(4.30±0.11)%]比较,100 nmol/L 17β-E2作用MCF-7细胞48 h,细胞凋亡率降至[(2.10± 0.20)%],差异有统计学意义 (P<0.01);17β-E2联 合Garcinol(35 μmol/L)处理后,细胞凋亡率升至[(16.35±0.22)%,P<0.01]。 2.4 Garcinol对雌激素处理后细胞ac-H3、ac-H4、NF-κB/ac-p65蛋白表达的影响
结果(图 3)显示,未处理细胞组中ac-H4的基础表达较ac-H3偏低,100 nmol/L 17β-E2处理MCF-7细胞48 h,ac-H3(P<0.01)、ac-H4(P<0.05)、ac-p65蛋白表达升高(P<0.01);17β-E2联合使用Garcinol(35 μmol/L)后,ac-H3、 ac-p65的表达水平降低(P<0.01),但ac-H4变化无统计学意义(P>0.05)。

|
图 3 Garcinol对雌激素处理的MCF-7 细胞ac-H3、ac-H4、NF-κB/ac-p65蛋白表达的影响 Fig 3 Effect of Garcinol on protein expression of ac-H3, ac-H4 and NF-κB/ac-p65 in MCF-7 cells treated with 17β-estradiol(17β-E2) *P<0.05,**P<0.01; n=3,x±s |
结果见图 4。与未处理细胞(43.46±1.48)比较,100 nmol/L 17β-E2处理MCF-7细胞48 h,p65从胞质到胞核的核转运增强(72.69±2.35,P<0.01);联合使用Garcinol(35 μmol/L),p65核转运受到抑制(34.83±1.33,P<0.01)。
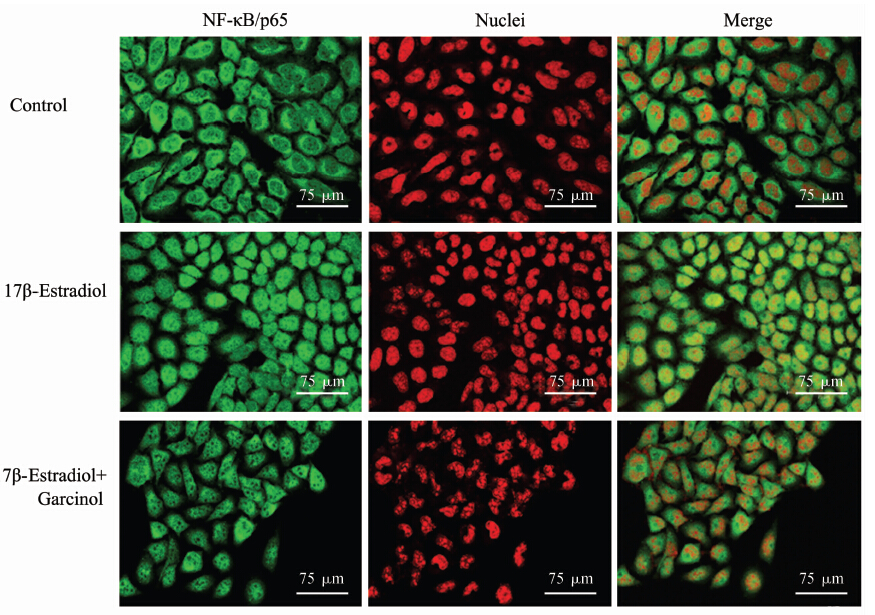
|
图 4 免疫荧光检测Garcinol对雌激素处理的MCF-7 细胞NF-κB/p65核转运的影响 Fig 4 Immunofluorescence analysis of Garcinol affecting nuclear translocation of NF-κB/p65 in MCF-7 cells treated with 17β-estradiol |
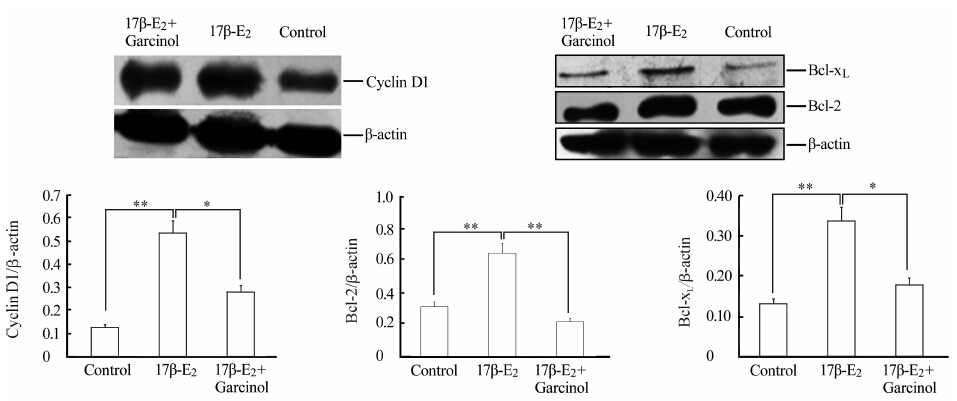
结果(图 5、图 6)显示,与未处理细胞比较,100 nmol/L 17β-E2处理MCF-7细胞48 h,cyclin D1、Bcl-2、Bcl-xL mRNA和蛋白表达增强(P<0.05,P<0.01);联合使用Garcinol (35 μmol/L)后,三者表达均降低(P<0.05,P<0.01)。
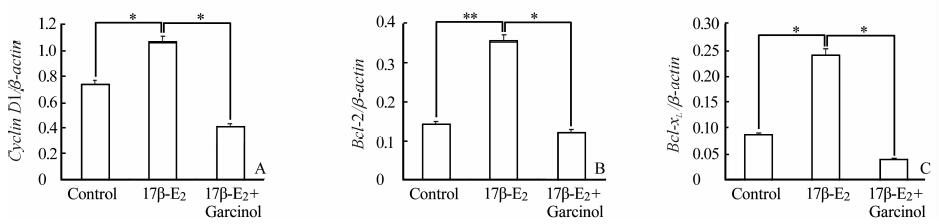
|
图 5 Garcinol对雌激素处理的MCF-7 细胞cyclin D1(A)、Bcl-2(B)、Bcl-xL (C) mRNA表达的影响 Fig 5 Effect of Garcinol on expression of cyclin D1(A),Bcl-2(B) and Bcl-xL(C) mRNA in MCF-7 cells treated with 17β-estradiol(17β-E2) *P<0.05,**P<0.01; n=3,x±s |
|
图 6 Garcinol对雌激素处理的MCF-7细胞cyclin D1、Bcl-2、Bcl-xL蛋白表达的影响 Fig 6 Effect of Garcinol on protein expression of cyclin D1, Bcl-2,and Bcl-xL in MCF-7 cells treated with 17β-estradiol(17β-E2) *P<0.05,**P<0.01; n=3,x±s |
由乙酰化酶HAT导致的高乙酰化是癌基因激活的重要方式[10]。四类主要的HAT包括:Gcn5/PCAF、MYST(Hbo1,MOZ,Ybf2/Sas3,Sas2,Tip60)、p300/CBP、Rtt109,每一类显示不同的组蛋白底物特殊性[11]。在雌激素促乳腺癌的发生发展中,乙酰化修饰异常可能具有重要作用。研究表明,核受体辅激活因子通常具有HAT活性,随着细胞信号通路活化,激素可诱导核受体[ER、糖皮质激素受体(GR)、维A酸受体(RAR)、维生素D受体(VDR)]靶基因组蛋白乙酰化水平升高、基因转录活化[12]。转录 结合因子的基因组分析发现,雌激素调节基因启动子区聚合酶Ⅱ(Pol Ⅱ)募集与组蛋白乙酰化水平正相关[3]。Kutanzi等[13]构建雌激素诱导的(ACI)大鼠乳腺癌模型,鉴定高雌激素水平与乳腺组织的形态学和表观变化的关系,发现其过增生改变与表观失调相一致,认为雌激素引起的组蛋白残基高乙酰化表观改变在早期乳腺癌进展中有重要意义。研究发现,p300/CBP和PCAF介导了雌激素诱导的MCF-7细胞H3、H4高乙酰化及受体靶基因转录激活,PCAF主要乙酰化H3[12, 14, 15]。本课题组前期工作亦已证实,17β-E2可促进MCF-7细胞的PCAF基因转录和蛋白水平表达[16, 17]。本研究结果显示,雌激素处理对乳腺癌MCF-7细胞增殖有较强的促进作用,细胞周期转化增强,细胞有丝分裂增强,细胞凋亡率降低;同时蛋白质印迹分析显示,细胞组蛋白ac-H3、ac-H4、非组蛋白NF-κB/ac-p65表达水平明显增高。联合乙酰化酶抑制剂Garcinol处理后,可抑制雌激素促MCF-7细胞增殖作用,使细胞周期转化阻滞于G0/G1期,细胞凋亡率增加;相应可见,组蛋白ac-H3和非组蛋白NF-κB/ac-p65的表达水平降低,但ac-H4未见明显变化。本研究结果表明,雌激素促MCF-7细胞增殖、凋亡抑制效应与组蛋白和非组蛋白NF-κB/p65的乙酰化水平增高有关,Garcinol可通过抑制乙酰化水平对雌激素促乳腺癌增殖产生抑制作用。
Garcinol是从生长在印度热带地区藤黄属果皮中提取的一种苯甲酮,分子式为C38H50O6,相对分子质量为602,其抗肿瘤活性与化学结构式中双羟基石碳酸及β-二酮基有关[18]。Garcinol可通过其结构中邻苯二酚上C13、C14位的-OH基团与HAT上的乙酰-CoA结合位点结合,抑制乙酰化作用[19]。Garcinol具有较好的细胞渗透性,体外研究发现能有效抑制p300/CBP和PCAF的活性和功能[20],实验中作为乙酰化酶抑制剂应用。组蛋白H4的乙酰化主要通过HAT(MYST/Hbo1)完成[21],本研究中Garcinol对雌激素促ac-H4表达无抑制作用可能与此有关。Garcinol可能通过抑制HAT、降低乙酰化水平抑制癌基因激活,发挥抗肿瘤作用,这对抑制雌激素促癌发生发展可能具有重要的作用。
NF-κB参与细胞增殖调控和凋亡过程,研究显示NF-κB活性失控对乳腺癌发生有重要意义[22, 23]。p300/CBP是NF-κB的辅激活因子,雌激素可能通过p300/CBP对NF-κB/p65的乙酰化表观修饰增强其转录活性[24]。ER通过与NF-κB蛋白形成复合体,进而与靶基因cyclin D1启动子远端的κB元件结合,控制cyclin D1表达,NF-κB/p65的活化对雌激素诱导增殖时的cyclin D1表达是必需的[5]。Cyclin D1是调控细胞周期转化的重要周期素蛋白,主要能够促进细胞由G0期进入G1期,使处于有丝分裂期的细胞百分数增加。此外,活化的NF-κB/p65亦调节Bcl-2、Bcl-xL等抗凋亡靶基因的表达[7],NF-κB对于ER被募集到抗凋亡基因启动子的ERE有必要作用[24]。增强NF-κB转录活性需要p300/CBP和PCAF参与,但这些不同的辅激活蛋白怎样被募集到NF-κB靶基因启动子区以及与NF-κB协同的时空作用方式尚不清楚[25]。NF-κB/p65依赖的反式激活在多个水平受乙酰化依赖的调节,主要包括:(1)NF-κB/p65依赖的组蛋白乙酰化增加,使NF-κB/p65依赖的基因,如ERE容易接近;(2)直接乙酰化NF-κB亚单位p65、p50,调节NF-κB不同功能,乙酰化p65与转录激活、DNA结合亲和性有关,乙酰化p50增强其与DNA结合活性[26]。
本研究结果显示,雌激素促进乳腺癌MCF-7细胞增殖和凋亡抑制效应与NF-κB/p65乙酰化水平增高表现一致,可见p65核转运相应加强;NF-κB的活化与cyclin D1、Bcl-2、Bcl-xL 基因转录和蛋白表达水平升高一致;乙酰化酶抑制剂Garcinol对此效应产生抑制作用。我们认为,降低NF-κB/p65乙酰化水平,抑制NF-κB通路活性,从而下调cyclin D1、Bcl-2、Bcl-xL表达可能是Garcinol抑制雌激素促乳腺癌细胞增殖的重要机制;在乳腺癌表观遗传机制中,组蛋白与非组蛋白NF-κB的乙酰化修饰异常,在导致基因转录异常、肿瘤发生发展的作用中可能存在密切关系,二者均值得高度关注。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Singh B N,Zhang G,Hwa Y L,Li J,Dowdy S C,Jiang S W.Nonhistone protein acetylation as cancer therapy targets[J].Expert Rev Anticancer Ther,2010,10:935-954. |
| [2] | Mooney S M,Goel A,D'Assoro A B,Salisbury J L,Janknecht R.Pleiotropic effects of p300-mediated acetylation on p68 and p72 RNA helicase[J].J Biol Chem,2010,285:30443-30452. |
| [3] | Kininis M,Chen B S,Diehl A G,Isaacs G D,Zhang T,Siepel A C,et al.Genomic analyses of transcription factor binding,histone acetylation,and gene expression reveal mechanistically distinct classes of estrogen-regulated promoters[J].Mol Cell Biol,2007,27:5090-5104. |
| [4] | Pozzi S,Benedusi V,Maggi A,Vegeto E.Estrogen action in neuroprotection and brain inflammation[J].Ann N Y Acad Sci,2006,1089:302-323. |
| [5] | Rubio M F,Werbajh S,Cafferata E G,Quaglino A, Col G P,Nojek I M,et al.TNF-alpha enhances estrogen-induced cell proliferation of estrogen-dependent breast tumor cells through a complex containing nuclear factor-kappa B[J].Oncogene,2006,25:1367-1377. |
| [6] | Chen L F,Mu Y,Greene W C.Acetylation of RelA at discrete sites regulates distinct nuclear functions of NF-kappaB[J].EMBO J,2002,21:6539-6548. |
| [7] | Sung B,Pandey M K,Ahn K S,Yi T,Chaturvedi M M,Liu M,et al.Anacardic acid (6-nonadecyl salicylic acid),an inhibitor of histone acetyltransferase,suppresses expression of nuclear factor-kappaB-regulated gene products involved in cell survival,proliferation,invasion,and inflammation through inhibition of the inhibitory subunit of nuclear factor-kappaB alpha kinase,leading to potentiation of apoptosis[J].Blood,2008,111:4880-4891. |
| [8] | Han D,Denison M S,Tachibana H,Yamada K.Effects of estrogenic compounds on immunoglobulin production by mouse splenocytes[J].Biol Pharm Bull,2002,25:1263-1267. |
| [9] | Zhang C,Zhao J,Deng H.17beta-estradiol up-regulates miR-155 expression and reduces TP53INP1 expression in MCF-7 breast cancer cells[J].Mol Cell Biochem,2013,379:201-211. |
| [10] | Di Cerbo V,Schneider R.Cancers with wrong HATs:the impact of acetylation[J].Brief Funct Genomics,2013,12:231-243. |
| [11] | Marmorstein R,Trievel R C.Histone modifying enzymes:structures,mechanisms,and specificities[J].Biochim Biophys Acta,2009,1789:58-68. |
| [12] | Chen H,Lin R J,Xie W,Wilpitz D,Evans R M.Regulation of hormone-induced histone hyperacetylation and gene activation via acetylation of an acetylase[J].Cell,1999,98:675-686. |
| [13] | Kutanzi K R,Koturbash I,Kovalchuk O.Reversibility of pre-malignant estrogen-induced epigenetic changes[J].Cell Cycle,2010,9:3078-3084. |
| [14] | Jin W,Chen L,Chen Y,Xu S G,Di G H,Yin W J,et al.UHRF1 is associated with epigenetic silencing of BRCA1 in sporadic breast cancer[J].Breast Cancer Res Treat,2010,123:359-373. |
| [15] | Jin W,Liu Y,Chen L,Zhu H,Di G H,Ling H,et al.Involvement of MyoD and c-myb in regulation of basal and estrogen-induced transcription activity of the BRCA1 gene[J].Breast Cancer Res Treat,2011,125:699-713. |
| [16] | 李苏华,邓华瑜,陈黎.细胞外调节蛋白激酶在雌激素促乳腺癌细胞MCF-7增殖中的作用[J].第二军医大学学报,2009,30:395-399. Li S H,Deng H Y,Chen L.Role of extracellular signal-regulated protein kinase in estrogen-induced proliferation of breast cancer cell line MCF-7[J].Acad J Sec Mil Med Univ,2009,30:395-399. |
| [17] | 李苏华,邓华瑜,郑维萍.ERK抑制对乳腺癌细胞(MCF-7)PCAF的影响和意义[J].重庆医科大学学报,2010,35:1155-1159. |
| [18] | Saadat N,Gupta S V.Potential role of garcinol as an anticancer agent[J].J Oncol,2012,2012:647206. |
| [19] | Arif M,Pradhan S K,Thanuja G R,Vedamurthy B M,Agrawal S,Dasgupta D,et al.Mechanism of p300 specific histone acetyltransferase inhibition by small molecules[J].J Med Chem,2009,52:267-277. |
| [20] | Balasubramanyam K,Altaf M,Varier R A,Swaminathan V,Ravindran A,Sadhale P P,et al.Polyisoprenylated benzophenone,garcinol,a natural histone acetyltransferase inhibitor,represses chromatin transcription and alters global gene expression[J].J Biol Chem,2004,279:33716-33726. |
| [21] | Iizuka M,Takahashi Y,Mizzen C A,Cook R G,Fujita M,Allis C D,et al.Histone acetyltransferase Hbo1:catalytic activity,cellular abundance,and links to primary cancers[J].Gene,2009,436:108-114. |
| [22] | Zubair A,Frieri M.Role of nuclear factor-κB in breast and colorectal cancer[J].Curr Allergy Asthma Rep,2013,13:44-49. |
| [23] | Baumgarten S C,Frasor J.Minireview:inflammation:an instigator of more aggressive estrogen receptor (ER) positive breast cancers [J].Mol Endocrinol,2012,26:360-371. |
| [24] | Pradhan M,Baumgarten S C,Bembinster L A,Frasor J.CBP mediates NF-kappaB-dependent histone acetylation and estrogen receptor recruitment to an estrogen response element in the BIRC3 promoter[J].Mol Cell Biol,2012,32:569-575. |
| [25] | Kim J W,Jang S M,Kim C H,An J H,Kang E J,Choi K H.New molecular bridge between RelA/p65 and NF-kappaB target genes via histone acetyltransferase TIP60 cofactor[J].J Biol Chem,2012,287:7780-7791. |
| [26] | Quivy V,Van Lint C.Regulation at multiple levels of NF-kappaB-mediated transactivation by protein acetylation[J].Biochem Pharmacol,2004,68:1221-1229. |
 2014, Vol. 35
2014, Vol. 35


