2. 解放军401医院胸心外科, 青岛 266071
△共同第一作者
*通信作者
2. Department of Cardiothoracic Surgery, No. 401 Hospital of PLA, Qingdao 266071, Shandong, China
△Co-first authors.
* Corresponding author.
心肌肥厚可分为生理性肥厚(physiological hypertrophy)和病理性肥厚(pathological hypertrophy)。在心血管疾病中,病理性心肌肥厚通常由高血压、主动脉狭窄、心肌缺血及瓣膜缺损等疾病引起,以心肌细胞肥厚并伴有相邻组织扩张的病理性重构而导致心功能不全和心脏衰竭,且可以部分引起心脏相关基因表达和分子表型的改变[ 1]。现有研究认为病理性心肌肥厚是心衰的前期病变,是心衰、脑卒中、冠心病、猝死等的独立危险因素[ 2]。 而由耐力运动训练诱导的生理性心肌肥厚和重构(运动员心脏)被认为对心功能是有益的,虽然同样伴随着心肌细胞体积的增大和新生肌小节的形成,但是很少出现心肌纤维化、细胞坏死和凋亡。因此,心功能一直保持正常或有所增强,不会失代偿或转变为心衰[ 3]。
心肌肥厚的产生和相关机制研究有赖于动物实验模型的成功建立。目前诱导生理性心肌肥厚的手段包括跑台运动(treadmill running)[ 4]、游泳训练(swim training)[ 5]和自主跑轮(voluntary wheel running)[ 6],但自主跑轮在运动的定时和定量方面无法精确,所以在实际模型建立中应用较少。被动跑轮目前主要在疲劳试验研究中应用,但是其在生理性心肌肥厚模型建立方面未见报道。为了探讨被动跑轮在建立生理性心肌肥厚动物模型中的作用,本研究利用被动跑轮对大鼠进行训练,对跑轮运动进行定量定时,以便更准确地诱导大鼠的生理性心肌肥厚;并对诱导大鼠的心脏组织形态学、超声心动图、心衰标记物心房钠尿肽(atria natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)的表达量等,与改良主动脉弓缩窄(transverse aortic constrictionm,TAC)手术诱导的病理性心肌肥厚模型进行比较,以全面评估被动跑轮建立生理性心肌肥厚动物模型的可行性。
1 材料和方法 1.1 动物来源及分组
健康雄性8周龄SPF级Sprague-Dawley(SD)大鼠40只,体质量200~220 g,购自上海西普尔-必凯实验动物有限公司,生产许可证号:SCXK(沪)2008-0016。饲养于第二军医大学实验动物中心,使用许可证号:SYXK(沪)2012-0003,SPF级条件饲养,繁育饲料购于上海仕林生物科技有限公司。实验于长海医院胸心外科实验中心完成。本研究全部内容通过第二军医大学长海医院科学研究伦理委员会审核,所有操作均遵循国家《实验动物管理条例》及《国家实验动物管理实施细则》。40只实验大鼠随机为正常对照组、被动跑轮运动组、假手术组和主动脉弓缩窄组,每组10只。各组大鼠在完全相同的环境中饲养,可自由获取水和食物,分别对被动跑轮运动组和主动脉弓缩窄组行被动跑轮运动训练和主动脉弓缩窄术诱导建立生理性心肌肥厚模型和病理性心肌肥厚模型。
1.2 主要仪器及试剂大鼠转轮式跑步机(DB021型,北京智鼠多宝生物科技有限责任公司),687型小动物呼吸机(美国Harvard公司),REF加热垫(美国Gaymar公司),Vevo770超声及17.5 MHz超声探头、L/L-S分析天平(加拿大VisualSonics公司)。ANP抗体(sc-18811,美国Santa Cruz公司),BNP抗体(ab-19645,英国Abcam公司)。
1.3 动物模型的建立 1.3.1 被动跑轮训练诱导生理性心肌肥厚模型
参考Bedford标准[ 7]用DB021型转轮式跑步机,以18转/分的转速对被动跑轮运动组大鼠进行中等运动强度的训练。运动训练过程包括预训练和正式训练两个阶段。预训练为期4 d,转速由12转/分跑10 min,增加至18转/分,跑20 min,后降至12转/分,跑10 min结束。此后时间逐渐增加至60 min,第5天始每天正式跑60 min。共训练5周,每周训练5 d。
1.3.2 主动脉弓缩窄诱导病理性心肌肥厚模型大鼠称质量后腹腔注射3%水合氯醛300 mg/kg,同时在皮下注射阿托品注射液0.5 mg/kg,以抑制呼吸道的分泌物。麻醉成功后,行气管插管,潮气量4~5 mL,呼吸频率50~60次/min。手术区域备皮,消毒,铺无菌孔巾,取胸骨上段正中切口,用开胸器撑开切口,分离胸腺,暴露升主动脉。用穿有3号丝线的过线器,从右头臂干和左颈总动脉之间穿过胸主动脉,8G针头垫扎主动脉,随后将针头退出,造成约70%缩窄。结扎牢固后,将胸腺回位盖住结扎部位。由胸腔引出一消毒的塑料管,逐层关胸,缝好肌肉后,将呼吸机的模式改为呼吸末正压模式,同时用注射器经塑料管吸出胸腔内的气体,使肺部较好地复张,然后拔掉塑料管并缝合伤口。待大鼠自主呼吸恢复后,拔出气管插管,将其放在37℃加热垫待其苏醒,后装笼饲养。假手术组不结扎胸主动脉,其他与主动脉弓缩窄组作相同处理。
1.4 超声心功能评价方法及观察指标大鼠训练或术后5周用3%水合氯醛(300 mg/kg)腹腔注射麻醉后行经胸超声检查。各组动物胸部备皮,获得M型超声心动图像,测量心率(heart rate),左室前壁舒张末期厚度(left anterior ventricular wall thickness in diastole,LVAWd)和左室后壁舒张末期厚度(left ventricular posterior wall thickness in diastole,LVPWd),左心室舒张末期内径(left ventricular internal dimensions at end-diastole,LVIDd),每搏输出量、射血分数、缩短分数。每只大鼠在每个切面上检测2次,每次读取连续5个心动周期的数值,取平均值用于统计。所有测量均由两位超声医师双盲操作,取两者均值。
1.5 标本采集与处理超声检测完毕,称量大鼠体质量后,颈椎离断法处死大鼠。取大鼠心脏,电子天平称取心脏质量。剪去大血管、心房及右室游离壁,保留的室间隔、左室游离壁称重作为左室质量,并称取双肺脏质量以及胫骨长度,计算心脏质量指数(heart weight-to-body weight ratio,HW/BW)、左室质量指数(LV weight-to-body weight ratio,LVW/BW)、肺脏质量指数(lung weight-to-body weight ratio,LungW/BW)和左室质量胫骨长度比(LV weight-to-tibia length ratio,LVW/TL)。用于心衰标记物ANP和BNP蛋白检测的心肌组织立即置于液氮中保存。余心肌组织用10%甲醛溶液固定,制片后用H-E染色,普通光镜下观察心肌组织的形态学变化。
1.6 蛋白质印迹检测左室心肌ANP、BNP蛋白表达按100 mg样品加1 mL组织裂解液的比例加入裂解液提取大鼠左室心肌组织蛋白。配制12% SDS-PAGE分离胶和5%积层胶,每孔加入40 μg蛋白样品,置电泳缓冲液中,60 V电泳约30 min,待样品进入分离胶后,120 V电泳至所需时间。将蛋白转印至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜,用5%脱脂奶粉于室温封闭2 h,分别加一抗[ANP抗体(1∶500); BNP抗体(1∶1 000)]。4℃孵育过夜,次日TBST洗膜3次,每次5 min,再加相应二抗室温孵育1 h,发光剂孵育6 min,曝光、显影、定影,结果用Image J凝胶图像分析系统对条带进行分析,实验重复3次。
1.7 统计学处理
采用SPSS18.0统计软件,计量数据以 ±s表示,组间计量资料采用双因素方差分析(two-way analysis of variance),检验水准(α)为0.05。
±s表示,组间计量资料采用双因素方差分析(two-way analysis of variance),检验水准(α)为0.05。
在预训练中,尽管采用先慢后快的训练方式,但仍有1只大鼠无法满足实验要求而淘汰,淘汰率10%(1/10)。预实验发现主动脉弓缩窄术中及术后导致大鼠死亡的主要原因为主动脉弓破裂和缩窄过多导致急性左心衰竭。操作熟练开始正式实验后,主动脉弓缩窄组大鼠术后1周死亡率为10%(1/10),术后1~5周死亡率为11.1%(1/9),总死亡率为20%(2/10);假手术组大鼠术后无死亡。
2.2 各组心脏超声结果比较结果(图 1A)表明:与正常对照组相比,被动跑轮运动组大鼠心率下降,但组间差异无统计学意义;与假手术组相比,主动脉弓缩窄组大鼠心率增加20%,差异有统计学意义(P<0.05)。两种大鼠模型的心脏结构与各自对照组比较,被动跑轮运动组大鼠的LVAWd和LVPWd分别增加26%和24%(P<0.05,图 1B、1C),而LVIDd无明显变化;TAC组大鼠的LVAWd和LVPWd分别增加17%和24%(P<0.05),而LVIDd下降38%(P<0.01,图 1D)。结果提示主动脉弓缩窄手术诱导的病理性心肌肥厚为典型的向心性肥厚。心功能方面,被动跑轮运动组较正常对照组的射血分数增加5%(图 2A)、每搏输出量增加44%(图 2B)、缩短分数增加9%(图 2),差异均有统计学意义(P<0.05); 主动脉弓缩窄组较假手术组的射血分数下降8%(图 2A)、每搏输出量减少42%(图 2B)、缩短分数下降11%(图 2C),差异均有统计学意义 (P<0.01)。结果表明:被动跑轮运动组大鼠心功能增强,而主动脉弓缩窄组降低。
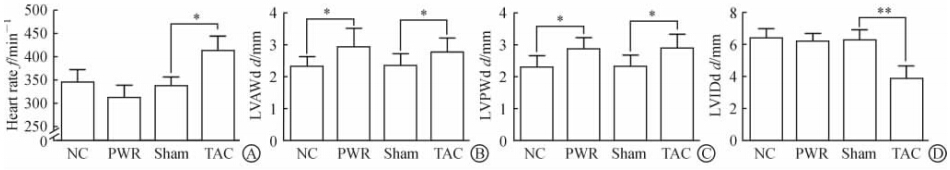 | 图 1 心肌肥厚模型大鼠的心脏结构超声心动图检测Fig. 1 Echocardiography analysis of cardiac structure in different groupsA:Heart rate; B: Left anterior ventricular wall thickness in diastole(LVAWd); C: Left ventricular posterior wall thickness in diastole(LVPWd); D: Left ventricular internal dimensions at end-diastole(LVIDd).NC:Normal control group; PWR: Passive wheel running group;Sham: Sham group; TAC: Transverse aortic constriction group. *P<0.05,**P<0.01; n=8, ±s ±s |
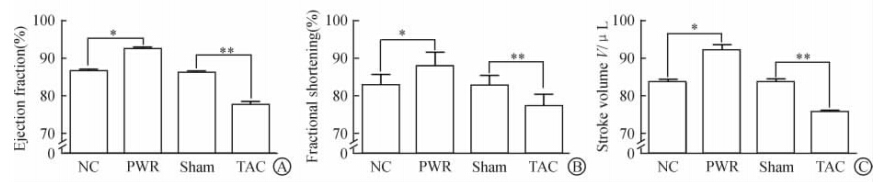 | 图 2 心肌肥厚模型大鼠的心脏功能超声心动图检测Fig. 2 Echocardiography analysis of cardiac functions in different groupsA:Ejection fraction; B: Fractional shortening; C: Stroke volume.NC:Normal control group; PWR:Passive wheel running group;Sham: Sham group;TAC:Transverse aortic constriction group. *P<0.05,**P<0.01; n=8, ±s ±s |
与各自对照组比较,两模型组大鼠体质量差异均无统计学意义。与正常对照组相比,被动跑轮运动组大鼠HW/BW、LVW/BW、LungW/BW 分别增加25.0%、37.3%、23.8%(P<0.05);与假手术组相比,主动脉弓缩窄组的HW/BW和LVW/BW以及LungW/BW分别增加31.6%、38.8%和56.6%,差异均有统计学意义(P<0.05或P<0.01,图 3A~3C)。LVW/TL在各组间比较差异无统计学意义(图 3D)。
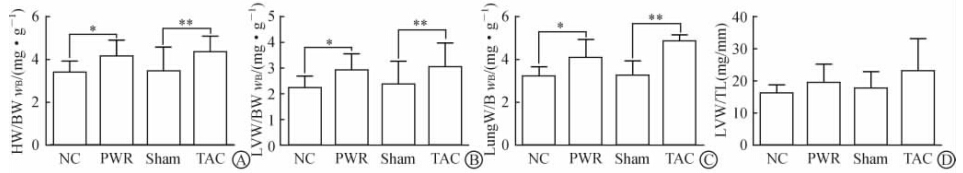 | 图 3 心肌肥厚模型大鼠的病理检测Fig. 3 Pathological examination of cardiac hypertrophic models in different groupsA:Heart weight-to-body weight ratio(HW/BW);B:LV weight-to-body weight ratio(LVW/BW);C: Lung weight-to-body weight ratio(LungW/BW);D: LV weight-to-tibia length ratio (LVW/TL). NC:Normal control group; PWR:Passive wheel running group;Sham: Sham group;TAC:Transverse aortic constriction group. *P<0.05,**P<0.01; n=5, ±s ±s |
H-E染色病理组织切片观察发现:正常对照组及假手术组心肌纤维排列正常,无血管扩张及血管壁增厚等表现(图 4A、4C);被动跑轮运动组训练5周后大鼠的心肌细胞胞质变宽,细胞核变大,心肌细胞排列整齐、着色均匀,心肌细胞间连接紧密(图 4B);主动脉弓缩窄组大鼠术后5周,表现为心肌细胞胞质变宽,胞核变大,在相同倍数单位面积下细胞数减少,心肌细胞排列不整齐、着色不均匀,心肌细胞间连接松散(图 4D)。
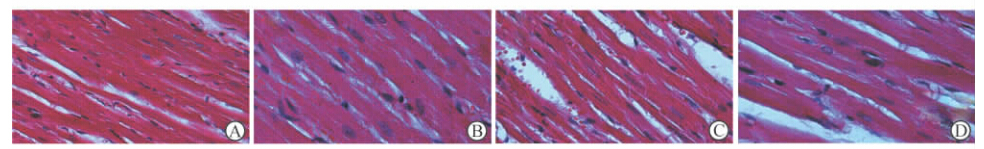 | 图 4 心肌肥厚模型大鼠的H-E染色Fig. 4 Hematein-Eosin staining of cardiac hypertrophic models in each groupA: Normal control group; B: Passive wheel running group; C: Sham group; D: Transverse aortic constriction group. Original magnification:×400 |
蛋白质印迹检测结果(图 5)显示:被动跑轮运动组大鼠左心室ANP、BNP蛋白表达量降低,分别是正常对照组的0.67倍和0.48倍,组间差异均有统计学意义(P<0.05);而主动脉弓缩窄组大鼠ANP、BNP较假手术组分别升高约1.98倍和2.03倍,差异有统计学意义(P<0.05)。结果提示病理性心肌肥厚和生理性心肌肥厚基因调控存在差别。
 | 图 5 心肌肥厚模型大鼠ANP和BNP蛋白的表达Fig. 5 Atria natriuretic peptide (ANP) and brain natriuretic peptide (BNP) expression in each groupNC: Normal control group; PWR:Passive wheel running group; Sham: Sham group;TAC:Transverse aortic constriction group. *P<0.05; n=3, ±s ±s |
进行有计划的有氧耐力运动训练会引起心肌肥厚,这被视为有利的生理适应,已建立了许多实验策略,其中跑台运动和游泳训练应用较多。Chung等[ 8]在研究怀孕的雌性小鼠与运动组的转录差异时利用了自主跑轮运动,但自主跑轮运动对运动强度和运动时间因不能精确控制而应用范围较窄。本实验参考Bedford标准[ 7]对被动跑轮运动组大鼠进行中等运动强度的训练,最大耗氧量为60%,定速跑轮对大鼠的运动速度和时间有了很好的控制,从而保证运动强度的准确性。本研究结果显示,与正常对照组比较,被动跑轮运动组经过5周的运动训练后大鼠的心脏和左心室质量指数分别增加25.0%和37.3%,均明显增加;心衰标记物ANP和BNP表达量明显降低,分别是正常对照组的0.67倍和0.48倍,并且比主动脉弓缩窄组诱导的病理性心肌肥厚也明显降低,提示生理性心脏肥厚模型建立成功。我们选择中等运动强度的训练,尽量避免大鼠力竭运动造成心脏的伤害,Maron等曾报道力竭运动后出现舒张末期左心室内径扩大,导致病理性扩张型心肌病的发生可能[ 9]。主动脉弓缩窄法是目前应用广泛的制作病理性心肌肥厚动物模型的方法[ 10],但主动脉弓缩窄程度过重易导致急性左心功能衰竭发生[ 11]和术中主动脉弓破裂是建模失败的主要原因。本研究采用胸骨正中上至胸骨上窝的手术切口,下至第二肋骨水平,极大减少手术对肺及胸膜的损伤,降低手术死亡率。与假手术组相比,心脏、左室质量指数、左室质量胫骨长度比和肺脏质量指数均明显增加,提示病理性心脏肥厚模型建立成功。
本研究中被动跑轮运动诱导的生理性肥厚的心室内径变化不大,而主动脉弓缩窄诱导病理性心肌肥厚模型舒张末期内径下降38%。究其原因,在被动跑轮运动的条件下,心脏需要提高每搏输出量和心率以满足血流供应需求的增加,长期运动刺激心脏为适应机体血供的需求,其心肌结构发生平衡、协调变化,心肌能量代谢和心脏的功能都增强,属于生理性代偿反应。运动心脏的结构和功能的适应性重塑使其具备良好的功能储备。病理组织切片检查可证实心室肌虽然同样伴随着心肌细胞体积的增大和新生肌小节的形成,但是排列整齐,心肌纤维化、细胞坏死和凋亡较少,因此心功能一直保持正常或有所增强,不会失代偿或转变为心衰。本实验中主动脉弓缩窄组在术后5周时还处于代偿期,超声心功能检查变化虽不明显,但心衰标记物ANP和BNP已经明显增加。
本研究说明被动跑轮运动能成功诱导生理性心肌肥厚,为运动对心肌肥厚影响研究提供了一个可靠的动物模型。尽管我们采取的训练方法严格按照参考Bedford标准制定运动强度,但是运动强度有时也要因动物而异。我们相信随着对被动跑轮的特点和作用机制的不断深入研究,将更有助于对运动保护心功能的认识,为科学制定心血管疾病的预防和康复提供新的思路。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Beisvag V,Kemi O J,Arbo I,Loennechen J P,Wisløff U,Langaas M,et al.Pathological and physiological hypertrophies are regulated by distinct gene programs[J].Eur J Cardiovasc Prev Rehabil,2009,16:690-697. |
| [2] | Hughes S E.The pathology of hypertrophic cardiomyopathy[J].Histopathology,2004,44:412-427. |
| [3] | Fagard R H.Impact of different sports and training on cardiac structure and function[J].Cardiol Clin,1997,15:397-412. |
| [4] | Diffee G M,Nagle D F.Regional differences in effects of exercise training on contractile and biochemical properties of rat cardiac myocytes[J].J Appl Physiol (1985),2003,95:35-42. |
| [5] | Medeiros A,Oliveira E M,Gianolla R,Casarini D E, Negrāo C E,Brum P C.Swimming training increases cardiac vagal activity and induces cardiac hypertrophy in rats[J].Braz J Med Biol Res,2004,37:1909-1917. |
| [6] | Natali A J,Turner D L,Harrison S M,White E. Regional effects of voluntary exercise on cell size and contraction-frequency responses in rat cardiac myocytes [J].J Exp Biol,2001,204(Pt 6):1191-1199. |
| [7] | Bedford T G,Tipton C M,Wilson N C,Oppliger R A,Gisolfi C V.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol Respir Environ Exerc Physiol,1979,47:1278-1283. |
| [8] | Chung E,Heimiller J,Leinwand L A.Distinct cardiac transcriptional profiles defining pregnancy and exercise[J].PLoS One,2012,7:e42297. |
| [9] | Maron B J,Pelliccia A.The heart of trained athletes:cardiac remodeling and the risks of sports,including sudden death[J].Circulation,2006,114:1633-1644. |
| [10] | Hu P,Zhang D,Swenson L,Chakrabarti G,Abel E D,Litwin S E.Minimally invasive aortic banding in mice:effects of altered cardiomyocyte insulin signaling during pressure overload[J].Am J Physiol Heart Circ Physiol,2003,285:H1261-H1269. |
| [11] | Nakamura A,Rokosh D G,Paccanaro M,Yee R R, Simpson P C,Grossman W,et al.LV systolic performance improves with development of hypertrophy after transverse aortic constriction in mice[J].Am J Physiol Heart Circ Physiol,2001,281:H1104-H1112. |
 2014, Vol. 35
2014, Vol. 35


