2. 浙江中医药大学中医临床基础研究所, 杭州 310053
2. TCM Clinical Research Institute, Zhejiang Chinese Medical University, Hangzhou 310053, Zhejiang, China
糖尿病肾病(diabetic nephropathy,DN)是常见的糖尿病微血管并发症之一。近年研究发现,炎症是DN持续发展的关键因素,其中核因子κB( nuclear factor-κB,NF-κB)及单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)起重要的介导作用[1, 2],但其确切的分子机制仍不明确。沉默信息调节因子1(silent information regulator 1,SIRT1)是一种依赖烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶,通过对组蛋白、多种转录因子的翻译后修饰(去乙酰化),调节相关基因转录活性,参与细胞衰老、寿命延长、抗氧化应激和能量代谢等多种细胞功能活动的调节,与衰老相关性疾病、代谢性疾病等密切相关[3]。研究表明,SIRT1可使NF-κB亚单位RelA/p65去乙酰化,进而抑制其转录活性,减少炎症因子的产生,防止炎症引起的损伤[4, 5]。在对肾脏疾病的研究中发现,SIRT1可以通过抑制肾脏固有细胞的凋亡、炎症反应、自噬等多种途径,延缓多种肾脏疾病包括DN的进展[6]。本研究通过观察沉默SIRT1基因和激活SIRT1对高糖诱导的系膜细胞NF-κB p65蛋白乙酰化水平及MCP-1表达的影响,从炎症角度探讨SIRT1对高糖诱导的系膜细胞损伤的保护作用。 1 材料和方法 1.1 实验材料
大鼠肾小球系膜细胞株(rat mesangial cells,RMC)由杭州市中医院肾病中心惠赠,HEK293T细胞株购自ATCC,感受态细胞JM109购自杭州浩基生物科技有限公司。低糖DMEM培养基、高糖DMEM培养基购自Hyclone公司,胎牛血清购自普飞生物公司。限制性内切酶AgeⅠ、EcoRⅠ和T4 DNA连接酶购自Fermentas公司;10×M Buffer、实时荧光定量PCR试剂盒SYBR○ R Premix Ex TaqTM(Perfect Real Time)购自TaKaRa公司;慢病毒载体系统购自杭州浩基生物科技有限公司,包括pTRC-EGFP、pTRC-Scramble-EGFP、pHelper和pVSVG,pTRC-EGFP载体含有能持续表达小RNA的元件,同时能表达增强型绿色荧光蛋白(EGFP);抗SIRT1抗体购自Abcam公司(ab104833);抗乙酰化NF-κB p65 抗体购自Santa Cruz( PA5-17264);MCP-1(MJE00)ELISA检测试剂盒购自R&D公司。
1.2 shSIRT慢病毒载体的构建和鉴定根据SIRT1 (XM_003751934.1)基因信息,利用RNAi在线设计软件,设计合成针对SIRT1基因的有效寡核苷酸靶序列5′-CCT GAA AGA ACT GTA CCA CAA-3′(位于SIRT1基因的1 573~1 593 bp处),并合成针对靶序列的两条互补单链寡脱氧核苷酸(DNA Oligo):正向5′-CCG GCC TGA AAG AAC TGT ACC ACA ACT CGA GTT GTG GTA CAG TTC TTT CAG GTT TTT G-3′;反向5′-AAT TCA AAA ACC TGA AAG AAC TGT ACC ACA ACT CGA GTT GTG GTA CAG TTC TTT CAG G-3′ (内含AgeⅠ和EcoRⅠ酶切位点),经退火形成双链DNA,与经AgeⅠ、EcoRⅠ双酶切后的pTRC-EGFP连接,转化感受态细胞JM109,转移到含Amp抗性的LB琼脂培养基上37℃培养,挑选阳性克隆,送Invitrogen公司测序。
取状态良好、处于对数生长期的RMC接种于6孔板中,每孔细胞数约为5×104个,加入pTRC-shSIRT1病毒及助转剂至终浓度8 μg/mL,轻轻摇晃混匀,放入37℃ 5%CO2培养箱培养4~6 h后,更换完全培养液继续培养。同时设置未感染组和空载体(pTRC-scramble-EGFP病毒)对照组。3 d后通过荧光倒置显微镜观察报告基因EGFP的表达情况及SIRT1 mRNA和蛋白的表达情况。
1.3 实验分组处于对数生长期的RMC用含10% FBS和青链霉素的低糖DMEM培养液培养,待贴壁生长到融合度在50%~70%,换无血清培养液。根据加入刺激物的不同分为:(1)高糖组,用高糖培养液培养;(2)白藜芦醇(SIRT1激活剂)+高糖组,用含1 μmol/L白藜芦醇的低糖培养液培养24 h后,换用高糖培养液培养;SIRT1 RNAi组,加入干扰病毒pTRC-shSIRT1感染4 h后,换用低糖培养液培养;SIRT1 RNAi+高糖组,添加干扰病毒感染4 h后,换用高糖培养液培养,同时设正常对照组和甘露醇高渗对照组,每组设3个复孔。
1.4 实时荧光定量PCR检测SIRT1和MCP-1 mRNA的表达收集细胞,用TRIzol提取RNA,测定并计算RNA的纯度和浓度;取RNA在反转录酶的作用下合成cDNA,用SYBR Green嵌合荧光法进行实时PCR扩增。荧光引物采用Primer Premier 6.0和Beacon designer软件进行设计,由上海生物工程有限公司负责合成。18S(基因序列号:M11188)上游引物为5′-GAA TTC CCA GTA AGT GCG GGT CAT A-3′,下游引物为5′-CGA GGG CCT CAC TAA ACC ATC-3′,扩增产物长度为105 bp;SIRT1 (基因序列号:XM_003751934.1)上游引物为5′- CAG GTA CAG GAA TTG CTC CAC CA-3′,下游引物为5′-CTG ATC TCC TTG TTC AAG TTC ACA G-3′ ,扩增产物长度为85 bp;MCP-1(基因序列号:M57441)上游引物为5′-CAC CTG CTG CTA CTC ATT CAC TG-3′,下游引物为5′-CTT CTT TGG GAC ACC TGC TGC T-3′,扩增产物长度为93 bp。反应体系:ddH2O 10.5 μL,SYBR○ R Premix Ex TaqTM (2×) 12.5 μL,上游引物(10 μmol/L) 0.5 μL,下游引物(10 μmol/L) 0.5 μL,模板cDNA 1.0 μL,总体系量25 μL。反应条件: 95℃预变性1 min; 95℃变性10 s,62℃退火延伸25 s,45个循环。在每个循环的延伸阶段读取光密度值。每个样品重复3次,取其循环阈值(Ct)均值,分别计算各组的ΔCt(Ct内参基因-Ct目的基因),再以正常组细胞为1进行均一化,以2-ΔΔCt表示基因的相对表达水平。
1.5 蛋白质印迹法检测SIRT1和NF-κB p65乙酰化蛋白的表达收集细胞,采用总蛋白提取试剂盒提取细胞总蛋白,用BCA法对提取的蛋白进行浓度测定。取60 μg总蛋白进行SDS-PAGE。电泳完毕后将蛋白转移到PVDF膜上。将膜放入T-TBS(含3%脱脂奶粉)封闭1 h后,分别加入一抗(SIRT1: 1∶1 000;乙酰化NF-κB p65: 1∶500)4℃孵育过夜,洗膜,然后用二抗(1∶5 000)室温孵育1 h,在暗室中用增强化学发光检测试剂显色,拍片晾干。采用Bandscan 5.0软件分析条带的光密度值,目的蛋白相对表达量=目的蛋白光密度值/内参β-actin光密度值。
1.6 ELISA检测细胞上清液中MCP-1蛋白含量收集细胞培养上清液,按照MCP-1 ELISA试剂盒说明书操作测定其浓度。
1.7 统计学处理采用SPSS 11.0 统计软件进行统计学分析,计量资料以 ±s表示,组间差异的比较采用方差分析。检验水准(α)为0.05。 2 结 果 2.1 干扰SIRT1基因的shSIRT慢病毒载体构建成功
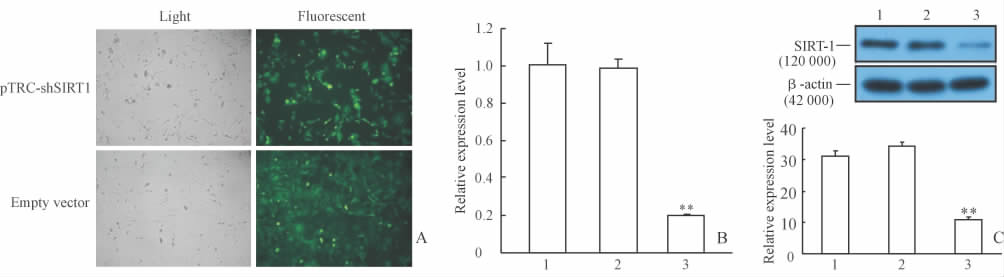
测序结果表明设计合成的寡核苷酸已经正确插入到pTRC-EGFP载体中。将pTRC-shSIRT1病毒感染RMC后,绝大多数细胞表达绿色荧光蛋白,细胞感染效率在90%以上(图 1A)。实时荧光定量PCR和蛋白质印迹结果显示,与空载体对照组和未感染组相比,pTRC-shSIRT1病毒感染组SIRT1 mRNA和蛋白表达水平均明显下调(图 1B、1C)。
|
图 1 pTRC-shSIRT1病毒感染RMC后EGFP和SIRT1的表达 Fig 1 Expression of EGFP and SIRT1 in RMCs after infection with pTRC-shSIRT1 infection A: Expression of EGFP in RMCs under fluorescent microscope; B: SIRT1 mRNA expression detected by real-time PCR; C: SIRT1 protein expression detected by Western blotting analysis. 1: Non-transfected group; 2: Empty vector; 3: pTRC-shSIRT1 transfected group. RMCs: Rat mesangial cells; EGFP: Green fluorescent protein; SIRT1: Silent information regulator 1. Original magnification:×100(A). **P<0.01 vs non-transfected group and empty vector group; n=3, ±s |
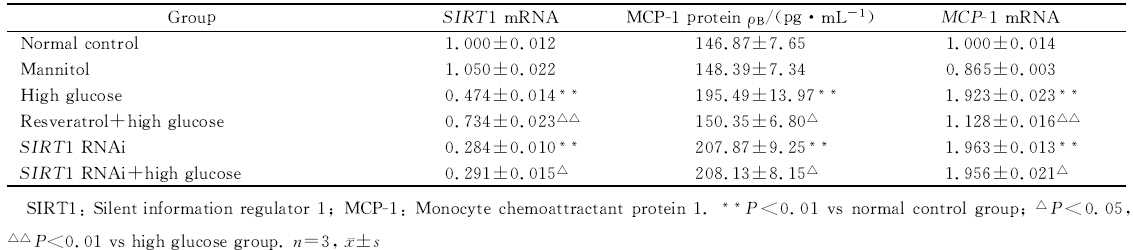
实时荧光定量PCR结果和蛋白质印迹结果显示,高糖刺激可抑制SIRT1 mRNA和蛋白的表达,与正常对照组比较差异有统计学意义(P<0.01)。采用SIRT1激活剂白藜芦醇预处理可使高糖介导的SIRT1 mRNA和蛋白表达增加,与高糖组比较差异有统计学意义(P<0.01);通过SIRT1 RNAi干扰可使高糖介导的SIRT1 mRNA和蛋白表达进一步减少,其中SIRT1蛋白表达与高糖组比较差异有统计学意义(P<0.05)。结果详见表 1、图 2A。
2.3 激活和沉默SIRT1对高糖诱导的RMC乙酰化NF-κB p65蛋白表达的影响蛋白质印迹结果(图 2B)显示,高糖诱导24 h后可使乙酰化NF-κB p65蛋白表达增加,与正常对照组比较差异有统计学意义(P<0.01)。以RNA干扰技术使SIRT1沉默后,可促进高糖诱导的RMC NF-κB蛋白乙酰化水平,与高糖组比较差异有统计学意义(P<0.05)。相反,白藜芦醇干预则可以降低高糖诱导的NF-κB蛋白乙酰化水平,与高糖组比较差异有统计学意义(P<0.01)。
|
|
表 1 各组细胞MCP-1 mRNA、MCP-1蛋白和SIRT1 mRNA的表达情况 Tab. 1 Expression of MCP-1 mRNA,MCP-1 protein and SIRT1 mRNA in each group |
实时荧光定量PCR结果和ELISA结果显示,高糖诱导24 h后可促进MCP-1 mRNA 和蛋白的表达,与正常对照组比较差异有统计学意义(P<0.01)。以RNA干扰技术使SIRT1沉默可进一步上调高糖诱导的RMC MCP-1表达水平,与高糖组比较差异有统计学意义(P<0.05)。相反,白藜芦醇干预可使高糖诱导的MCP-1表达降低,与高糖组比较差异有统计学意义(P<0.05,P<0.01)。结果见表 1。

|
图 1 各组细胞SIRT1蛋白表达(A)及NF-κB p65乙酰化水平(B) Fig 1 Expression of SIRT1 protein(A)and acetylation of NF-κB p65(B)in each group 1: Normal control group; 2: Mannitol group; 3: High glucose group; 4: Resveratrol+high glucose group; 5: SIRT1 RNAi group;6: SIRT1 RNAi + high glucose group. SIRT1: Sitent information regulator 1; NF-κB p65: Nuclear factor-κB p65 subunit. **P<0.01 vs normal control group; △P<0.05,△△P<0.01 vs high glucose group. n=3, ±s |
糖尿病时由高糖诱发的多元醇通路活跃、肾素-血管紧张素系统(RAS)活性增加、糖基化产物(advanced glycation end-products,AGEs)的形成、蛋白激酶C(protein kinase C,PKC)和氧化应激以及各种细胞因子介导的炎症反应都可引起肾脏的损伤[2],其中炎症反应是关键因素。NF-κB是调控炎症反应的关键蛋白[7],由p50和p65两个蛋白亚基组成。在静息状态下,NF-κB与其抑制因子IκB相结合,使NF-κB以无活性的形式存在于胞质中;当细胞受到各种刺激后,IκB发生酶解,NF-κB被活化。近年诸多研究表明,NF-κB p65 310赖氨酸残基乙酰化水平对NF-κB的活性至关重要:NF-κB p65 310赖氨酸残基乙酰化,RelA/p65亚单位不能与IκBα结合,进入核内,与DNA相关元件结合,刺激相关基因表达;相反,RelA/p65亚单位去乙酰化,允许NF-κB/IκBα相互作用,进而抑制NF-κB活性[8, 9]。研究表明,SIRT1激活能使NF-κB的RelA/p65亚单位去乙酰化,进而抑制NF-κB的转录活性,从而改善炎症[4, 5]。Yoshizaki等[10]研究结果显示,SIRT1的激活使RelA/p65亚单位去乙酰化,从而抑制TNF-α诱导的炎症反应,而敲除3T3-L1脂肪细胞SIRT1基因,可增加NF-κB p65的乙酰化水平,增强与炎症相关因子基因增强子的结合。
肾小球系膜细胞是肾小球固有细胞中反应最活跃的细胞,在DN早期即可分泌大量炎性因子,致使细胞外基质(extracellular matrix,ECM)积聚,导致肾小球硬化。研究发现,限制热量摄入可通过激活SIRT1进而抑制炎症和促进自噬改善DN;SIRT1的激活剂白藜芦醇可以通过p53途径和FOX途径减轻高糖诱导的系膜细胞氧化应激水平、维持正常的线粒体结构和功能,阻断TGF-β1诱导的系膜细胞凋亡[11, 12, 13]。但是系膜细胞中,SIRT1与NF-κB p65之间是否存在相互作用尚未见报道。本研究分别采用沉默SIRT1处理和白藜芦醇干预,观察高糖诱导的RMC NF-κB p65的乙酰化水平及MCP-1表达的变化。 结果显示,高糖刺激使RMC表达SIRT1减少。由于SIRT1含量的降低,SIRT1介导的抗炎作用被削弱,即NF-κB p65乙酰化水平升高,MCP-1基因及蛋白表达增加。白藜芦醇预处理能逆转高糖诱导引起的SIRT1表达降低,使NF-κB p65乙酰化水平降低,MCP-1基因及蛋白表达减少。而沉默SIRT1基因却促进了高糖的作用,使NF-κB p65乙酰化水平和MCP-1表达进一步升高。这提示SIRT1可通过NF-κB p65亚单位去乙酰化在高糖诱导的系膜细胞炎症损伤中起保护作用。这可能为将来DM的治疗提供一种新的策略。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Navarro-González J F,Mora-Fernández C,Muros de Fuentes M,García-Pérez J.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol,2011,7:327-340. |
| [2] | Luis-Rodríguez D,Martínez-Castelao A,Górriz J L,De-Álvaro F,Navarro-González J F.Pathophysiological role and therapeutic implications of inflammation in diabetic nephropathy[J].World J Diabetes,2012,3:7-18. |
| [3] | Kong X X,Wang R,Liu X J,Zhu L L,Shao D,Chang Y S,et al.Function of SIRT1 in physiology[J].Biochemistry (Mosc),2009,74:703-708. |
| [4] | Zhu X,Liu Q,Wang M,Liang M,Yang X,Xu X,et al.Activation of SIRT1 by resveratrol inhibits TNF-伪 induced inflammation in fibroblasts[J].PLoS One,2011,6:e27081. |
| [5] | Jung Y J,Lee J E,Lee A S,Kang K P,Lee S,Park S K,et al.SIRT1 overexpression decreases cisplatin-induced acetylation of NF-魏B p65 subunit and cytotoxicity in renal proximal tubule cells[J].Biochem Biophys Res Commun,2012,419:206-210. |
| [6] | Kume S,Kitada M,Kanasaki K,Maegawa H,Koya D.Anti-aging molecule,SIRT1:a novel therapeutic target for diabetic nephropathy[J].Arch Pharm Res,2013,36:230-236. |
| [7] | Schmitz M L,Mattioli I,Buss H,Kracht M.NF- kappaB:a multifaceted transcription factor regulated at several levels[J].Chembiochem,2004,5:1348-1358. |
| [8] | Chen L F,Fischle W,Verdin E,Greene W C.Duration of nuclear NF-魏B action regulated by reversible acetylation[J].Science,2001,293:1653-1657. |
| [9] | Kiernan R,Brès V,Ng R W,Coudart M P,El Messaoudi S,Sardet C,et al.Post-activation turn-off of NF-kappa B-dependent transcription is regulated by acetylation of p65[J].J Biol Chem,2003,278:2758-2766. |
| [10] | Yoshizaki T,Milne J C,Imamura T,Schenk S,Sonoda N,Babendure J L,et al.SIRT1 exerts anti-inflammatory effects and improves insulin sensitivity in adipocytes[J].Mol Cell Biol,2009,29:1363-1374. |
| [11] | Kitada M,Takeda A,Nagai T,Ito H,Kanasaki K,Koya D.Dietary restriction ameliorates diabetic nephropathy through anti-inflammatory effects and regulation of the autophagy via restoration of SIRT1 in diabetic Wistar fatty (fa/fa) rats:a model of type 2 diabetes[J].Exp Diabetes Res,2011,2011:908185. |
| [12] | Xu Y,Nie L,Yin Y G,Tang J L,Zhou J Y,Li D D,et al.Resveratrol protects against hyperglycemia-induced oxidative damage to mitochondria by activating SIRT1 in rat mesangial cells[J].Toxicol Appl Pharmacol,2012,259:395-401. |
| [13] | Kume S,Haneda M,Kanasaki K,Sugimoto T,Araki S,Isshiki K,et al.SIRT1 inhibits transforming growth factor beta-induced apoptosis in glomerular mesangial cells via Smad7 deacetylation[J].J Biol Chem,2007,282:151-158. |
 2014, Vol. 35
2014, Vol. 35