2. 第二军医大学东方肝胆外科医院特殊二科, 上海 200438
2. Division of Special Treatment Ⅱ, Eastern Hepatobiliary Surgical Hospital, Second Military Medical University, Shanghai 200438, China
原发性肝癌在世界范围是第五大常见恶性肿瘤,是第三大致死性肿瘤,而早期肝癌仍以手术切除为主要治疗方法[1]。由于肝脏的特殊结构,血供丰富,以及肝癌患者中有不少人合并肝硬化、血小板减少、凝血功能障碍,肝癌切除患者围术期出血一直是个世界性难题,故肝癌切除患者围术期止血剂的使用较为广泛。随着手术技术的提高,目前肝癌切除围术期出血、输血已大为减少,但围术期止血剂的使用却未见明显减少[2, 3]。肝癌切除患者术后远期死亡主要原因是术后肿瘤复发,被认为与如下因素有关:病毒性肝炎、Child-Pugh评分、肿瘤大小、肿瘤数目、肿瘤分化、血管侵犯、甲胎蛋白(alpha-fetoprotein,AFP)水平、术中输血、切缘情况等[4, 5, 6]。但止血剂对肝癌患者术后远期生存的影响一直未受重视。为探讨围术期静脉止血剂的使用是否影响肝癌切除患者术后复发与生存,本研究回顾性分析了止血剂应用对肿瘤术后复发与术后生存时间的影响。
1 资料和方法 1.1 一般资料选取第二军医大学东方肝胆外科医院2005年1月到2007年12月连续收治的504例肿瘤直径<5 cm的T1-2N0M0期,肝功能Child-Pugh评分A、B级,手术切除标本肉眼及病理切缘阴性的肝癌患者,按照围术期是否使用过静脉止血剂(凝血酶原复合物、纤维蛋白原、血凝酶、蛇毒类凝血酶等,通常多种静脉止血剂合用)分为使用和未使用止血剂2组。所有患者住院信息从本院信息库和病案室获取,负责收集整理资料的研究者不参与患者各种检查治疗。
患者术后第1年每2个月到我院复查随访,以后每3~4个月复查随访1次。每次复查测AFP定量和肝脏超声,检查皆由独立的与研究无关医生完成,每6个月行腹部CT检查1次。如果怀疑复发,立即行增强CT或MRI检查。复发患者将进行相关治疗。术后生存时间定义为从手术当天到患者发生疾病相关死亡或失访的时间,疾病相关死亡指患者死于肿瘤复发、复发治疗过程的并发症。其他原因死亡记为删失病例。无瘤生存期指患者手术当天到患者证实肿瘤复发,或非肿瘤复发患者从手术当天到失访日期。
1.2 统计学处理采用SPSS 19.0统计软件,数据表达为百分数、x±s、x与95%CI。两组临床相关参数比较用t检验、χ2检验。两组间累计生存时间和无瘤生存时间分析采用Kaplan-Meier法,并用log-rank法比较两组间的差异。根据以前研究将20个可能相关参数纳入本研究,实验室相关检查正常值范围取本院实验室正常值参考范围。各参数通过单因素分析后,将P<0.5的因素纳入Cox比例风险回归模型的多因素分析中进行逐步回归分析,在多因素逐步回归分析过程中P<0.1的因素纳入下一步回归中。检验水准(α)为0.05。
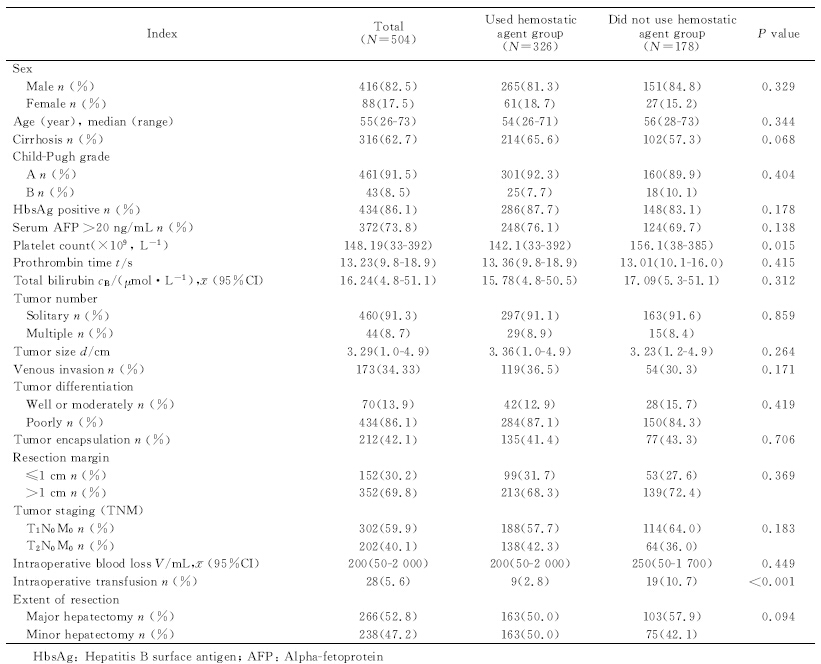
2 结 果 2.1患者一般资料及基线资料对比 共有504例肝癌患者纳入研究,其中男性416例,女性88例;年龄26~73岁,中位年龄55岁;患者术前肝功能中461例为Child A级,43例为Child B级;其中326例(64.68%)患者围术期使用过多种静脉止血剂,178例(35.32%)患者围术期未使用静脉止血剂(表 1)。所有患者的随访时间为7~72个月,中位随访时间为64个月,其中241例(47.82%)复发,180例(35.71%)患者死亡,1、3、5年总生存率分别为97.02%、79.56%、66.07%,1、3、5年无瘤生存率分别为84.13%、63.49%、53.57%。
使用静脉止血剂组患者随访时间为7~72个月,中位随访时间为62个月;未使用静脉止血剂组随访时间为10~72个月,中位随访时间为64个月。两组间性别、年龄分布、血浆AFP水平、肝炎指标、病理学指标以及手术相关指标差异无统计学意义。使用止血剂组患者血小板计数相对较低(P=0.015);两组患者术中出血量差异虽无统计学意义,但未用止血剂组患者输血者比使用止血剂组多(10.7% vs 2.8%,P<0.001)。详见表 1、表 2。
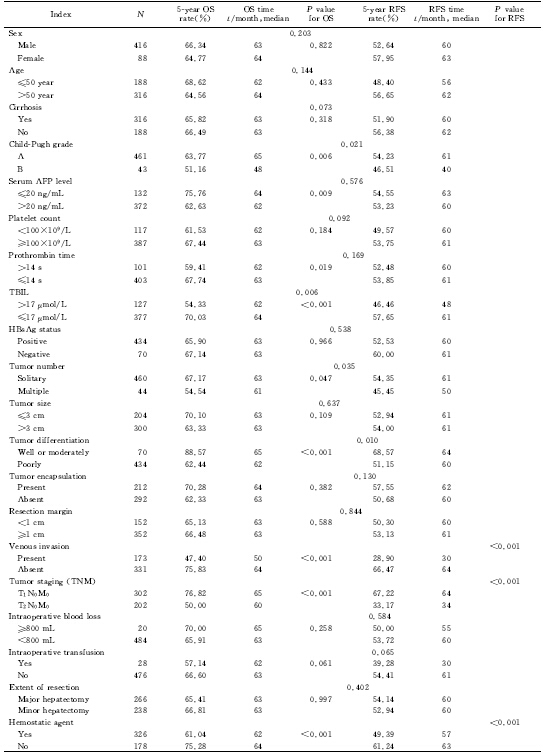
2.2 总生存时间、无瘤生存时间的比较224例复发患者中使用止血剂162例,未用止血剂62例;死亡的173例患者中18例死于肝癌之外的其他原因,止血剂组死亡127例,未用止血剂组死亡46例。使用止血剂组和未使用止血剂组的总生存、无瘤生存曲线见图 1。两组患者总生存时间差异有统计学意义(P=0.002),无瘤生存时间差异亦有统计学意义(P=0.001)。使用止血剂组患者总生存率(1、3、5年生存率分别为96.63%、75.77%、61.04%)比未用止血剂组患者总生存率(97.75%、86.52%、75.28%)低(P=0.002);使用止血剂组患者无瘤生存率(1、3、5年无瘤生存率分别为73.73%、59.51%、49.08%)比未使用止血剂组患者无瘤生存率(89.89%、70.79%、61.80%)低(P=0.001)。
|
|
表 1 患者一般资料及两组基线资料的比较 Tab. 1 Comparison of the baseline data of the two groups |

|
图 1 两组患者总生存时间(A)及无瘤生存时间(B)的比较 Fig 1 Comparison of overall survival (OS) time and recurrence-free survival (RFS) time of the two groups |
|
|
表 2 总生存与无瘤生存相关危险因素单因素分析 Tab. 2 Univariate analysis of risk factors for overall survival (OS) time and recurrence-free survival (RFS) time |
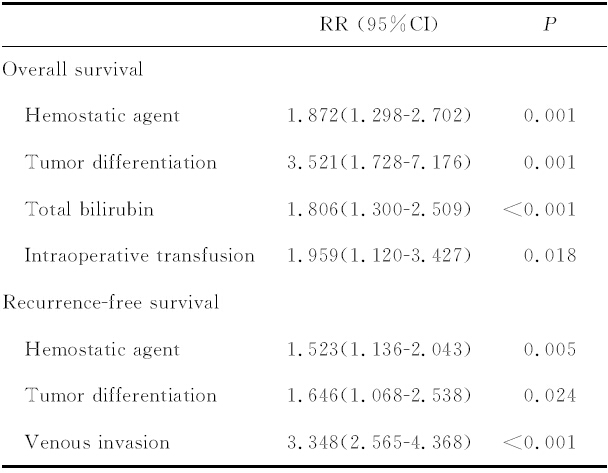
肝癌切除术后与总生存和无瘤生存相关因素单因素分析见表 2。多因素分析(表 3)示:止血剂的使用、肿瘤低分化、术前总胆红素升高、术中输血是影响总生存的独立危险因素;止血剂的使用、肿瘤低分化、肿瘤发生微血管侵犯是影响肿瘤术后复发的独立危险因素。围术期使用静脉止血剂是肿瘤切除术后远期预后较差的独立危险因素(OS:P=0.001,RR=1.872,95%CI 1.298~2.702;RFS:P=0.005,RR=1.523,95%CI 1.136~2.043)。
|
|
表 3 总生存与无瘤生存相关危险因素多因素分析 Tab. 3 Multivariate analysis of risk factors for overall survival time and recurrence-free survival time |
手术切除仍然是治疗早期肝癌的主要方法,越来越多对肿瘤患者远期预后有影响的因素得到大家的重视,其中凝血状态和血小板功能对恶性肿瘤的影响引起人们的注意[7, 8, 9, 10],可能考虑到对凝血功能、出血、输血的影响,目前有关止血剂对肿瘤复发影响方面的临床研究很少。本研究首次通过大样本临床资料证实围术期使用静脉止血剂是肝癌切除术患者远期预后不良的危险因素。通过我们的统计分析,围术期使用止血剂能明显降低肝癌切除患者远期总生存和无瘤生存时间。
目前大部分研究表明围术期输血是肝癌等恶性肿瘤切除术后复发的独立危险因素[4, 5, 6, 11],在临床上,输血多的患者通常使用止血剂也相对较多。这些研究只注意到了输血对肿瘤切除患者的远期影响,但没有注意到止血剂对患者的影响,本研究中输血患者较少,但止血剂使用患者却并不少,可以去掉输血对肿瘤复发的影响,而凸显止血剂对肝癌切除术后远期预后的影响。
临床上常用的静脉止血剂常通过以下环节发挥作用:促进凝血酶和纤维蛋白的形成、抑制凝血酶和纤维蛋白的分解或直接增加血小板活性。而凝血酶和纤维蛋白能促进血小板的激活,激活的血小板能与循环中的肿瘤细胞结合,与血小板结合后的肿瘤细胞能避免被自然杀伤细胞识别,且激活的血小板能抑制自然杀伤细胞活性,防止自然杀伤细胞清除肿瘤细胞[12, 13, 14]。当血小板与肿瘤细胞结合后血小板通过P-选择素、GPIb-Ⅸ与血管内皮细胞表面的硫酸软骨素葡聚糖和血管性血友病因子(von Willebrand factor,vWF)结合,使肿瘤细胞与血管壁发生黏附,然后转移到血管外发生增殖形成转移灶[12, 13, 15],导致肿瘤转移或复发,而肿瘤患者术后循环中的肿瘤细胞增多。故从理论上止血剂有促进肿瘤切除术后复发的可能。近年来越来越多的研究表明,肿瘤患者治疗期间如果使用抗血小板活性的药物阿司匹林能有效降低肿瘤发生、术后复发、转移灶形成和降低术后死亡率[12, 16, 17]。肝素、低分子肝素作为临床最常用的抗凝剂,也被证明能改善肿瘤患者远期预后[18, 19]。这些也间接证明围术期使用静脉止血剂是导致肿瘤切除患者远期预后不良的危险因素。本研究中发生肿瘤微血管侵犯患者的比例较高(173例,占28.64%),且发生肿瘤微血管侵犯是减少无瘤生存期的独立危险因素。止血剂的使用可能通过上述机制影响微血管侵犯患者术后复发。
本研究的不足之处为回顾性研究,缺乏机制探讨,不能完全排除使用静脉止血剂组患者的基础状态比未使用止血剂组差的可能,但本研究两组患者的基础状况除止血剂组患者血小板较低外,其他因素差异并无统计学意义,而在本研究的多因素分析中血小板并非影响肝癌切除患者远期预后的危险因素。
总之静脉止血剂的应用是影响肝癌切除患者远期预后的独立危险因素。虽然本研究结论仍有待进一步前瞻性临床研究加以证实,但如果该结论能得到证实,肝癌切除患者围术期静脉止血剂的管理应该加强。
4 利益冲突所有作者声明本文不涉及任何利益冲突。
| [1] | Guglielmi A,Ruzzenente A,Conci S,Valdegamberi A,Vitali M,Bertuzzo F,et al.Hepatocellular carcinoma: Surgical perspectives beyond the barcelona clinic liver cancer recommendations[J].World J Gastroenterol,2014,20:7525-7533. |
| [2] | Huntington J T,Royall N A,Schmidt C R.Minimizing blood loss during hepatectomy:a literature review[J].J Surg Oncol,2014,109:81-88. |
| [3] | Lodge J P.Hemostasis in liver resection surgery[J].Semin Hematol,2004,41(1 Suppl 1):70-75. |
| [4] | Poon R T,Fan S T.Hepatectomy for hepatocellular carcinoma: patient selection and postoperative outcome[J].Liver Transpl,2004,10(2 Suppl 1):S39-S45. |
| [5] | Tandon P,Garcia-Tsao G.Prognostic indicators in hepatocellular carcinoma: a systematic review of 72 studies[J].Liver Int,2009,29:502-510. |
| [6] | Yang T,Lu J H,Zhai J,Lin C,Yang G S,Zhao R H,et al.High viral load is associated with poor overall and recurrence-free survival of hepatitis B virus-related hepatocellular carcinoma after curative resection: a prospective cohort study[J].Eur J Surg Oncol,2012,38:683-691. |
| [7] | Soll C,Jang J H,Riener M O,Moritz W,Wild P J,Graf R,et al.Serotonin promotes tumor growth in human hepatocellular cancer[J].Hepatology,2010,51:1244-1254. |
| [8] | Thun M J,Namboodiri M M,Heath C W Jr.Aspirin use and reduced risk of fatal colon cancer[J].NEJM,1991,325:1593-1596. |
| [9] | Choe K S,Liauw S L.Effects of aspirin on cancer initiation and progression[J].Expert Rev Anticancer Ther,2013,13:115-117. |
| [10] | Pathi S,Jutooru I,Chadalapaka G,Nair V,Lee S O,Safe S.Aspirin inhibits colon cancer cell and tumor growth and downregulates specificity protein (Sp) transcription factors[J].PLoS One,2012,7:e48208. |
| [11] | Busch O R,Hop W C,Hoynck van Papendrecht M A,Marquet R L,Jeekel J.Blood transfusions and prognosis in colorectal cancer[J].NEJM,1993,328:1372-1376. |
| [12] | Jain S,Harris J,Ware J.Platelets: linking hemostasis and cancer[J].Arterioscler Thromb Vasc Biol,2010,30:2362-2367. |
| [13] | Goubran H A,Burnouf T,Radosevic M,El-Ekiaby M.The platelet-cancer loop[J].Eur J Intern Med,2013,24:393-400. |
| [14] | Placke T,Kopp H G,Salih H R.The wolf in sheep's clothing: Platelet-derived 鈥減seudo self鈥� impairs cancer cell 鈥渕issing self鈥� recognition by NK cells[J].Oncoimmunology,2012,1:557-559. |
| [15] | Labelle M,Begum S,Hynes R O.Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J].Cancer Cell,2011,20:576-590. |
| [16] | Stone R L,Nick A M,McNeish I A,Balkwill F,Han H D,Bottsford-Miller J,et al.Paraneoplastic thrombocytosis in ovarian cancer[J].NEJM,2012,366:610-618. |
| [17] | Chan A T,Ogino S,Fuchs C S.Aspirin use and survival after diagnosis of colorectal cancer[J].JAMA,2009,302:649-658. |
| [18] | Kozlowski E O,Pavao M S,Borsig L.Ascidian dermatan sulfates attenuate metastasis,inflammation and thrombosis by inhibition of P-selectin[J].J Thromb Haemost,2011,9:1807-1815. |
| [19] | Lazo-Langner A,Goss G D,Spaans J N,Rodger M A.The effect of low-molecular-weight heparin on cancer survival.A systematic review and meta-analysis of randomized trials[J].J Thromb Haemost,2007,5:729-737. |
 2014, Vol. 35
2014, Vol. 35