2. 海军总医院胸外科, 北京 100048
2. Department of Thoracic Surgery, Navy General Hospital of PLA, Beijing 100048, China
非小细胞肺癌(non-small cell lung cancer,NSCLC) 约占肺癌的80%,多通过淋巴、血液及肿瘤浸润等方式进行局部侵犯和远处转移[ 1 ]。如何切断肿瘤浸润转移的途径是目前控制肺癌进展的研究热点。重组人血管内皮抑素注射液——恩度(endostar)是内源性血管生成抑制剂,能够选择性抑制血管内皮细胞的增殖与迁移,达到抑制肿瘤形成新生血管、切断肿瘤细胞的营养供给途径、诱导肿瘤细胞凋亡,抑制肿瘤增殖或转移的目的[ 2 ]。研究表明,恩度联合化疗能够提高疗效[ 3,4 ]。恩度对肿瘤血管生成的抑制作用已有较多研究[ 5,6,7 ],但其对肿瘤淋巴管的生成是否具有抑制作用鲜见报道。为此,我们设计了相关研究,以期探讨恩度对NSCLC淋巴管生成及淋巴转移的作用。
1 材料和方法 1.1 动物及试剂
A549肺癌细胞株购于北京协和基础实验室细胞库,细胞在海军总医院中心实验室培养,采用含10%胎牛血清的DMEM/F12(1∶1)培养液培养,细胞培养环境为5% CO2、37.5℃恒温培养箱。BALB/c裸鼠,雌雄各半,体质量22~25 g,购于军事医学科学院实验动物中心[许可证号:SCXK(军)2012-0004]。所有动物均在室温(22±1)℃、12 h光照/12 h黑暗环境中饲养。动物实验获得海军总医院医学伦理委员会批准。恩度(国药准字S200S0088)购自山东先声麦得津生物制药有限公司;顺铂(国药准字H37021358)购自山东齐鲁制药有限公司;DMEM/F12(1∶1)培养基、胎牛血清、胰蛋白酶及实验耗材购自北京圣希康生物科技有限公司;鼠抗Podoplanin Protein/gp36试剂盒、PV-6000通用型免疫组化检测试剂盒和DAB染色试剂盒购于上海科敏生物科技有限公司。
1.2 动物模型的建立与分组于裸鼠右侧腋窝经皮下注射密度为1×107/mL的A549肺癌细胞0.2 mL,建立裸鼠异种移植荷瘤模型[ 8 ]。注射肿瘤细胞3周后,选取56只建模成功的荷瘤裸鼠[肿瘤平均直径为(7.0±0.4)mm],随机分为8组(n=7):对照组,注射生理盐水0.2 mL,每日1次;顺铂组,给予顺铂20 μg,隔日1次;3个浓度恩度组,分别给予恩度2、4、6 mg/kg,每日1次;3个浓度恩度+顺铂组,分别给予恩度2、4、6 mg/kg,每日1次,加顺铂20 μg,隔日1次。给药方法均为尾静脉给药,连续给药14 d。
1.3 观察指标给药7 d后,所有裸鼠称量、测量并记录肿瘤直径,根据用药前后裸鼠肿瘤直径的差异来评价各组药物对肿瘤生长的抑制作用。然后处死裸鼠,取肿瘤组织和可疑转移淋巴结进行H-E染色和免疫组织化学染色。免疫组织化学染色诊断由北京中杉金桥生物科技有限公司完成,采用免疫酶标法,以抗鼠podoplanin蛋白抗体作为一抗,PV-6000(辣根酶标记羊抗兔/小鼠IgG多聚体)作为二抗,二氨基联苯胺(DAB)溶液作为显色剂,染色成功后微淋巴管内皮细胞呈棕黄色。Podoplanin是一种表达于脉管系统内皮细胞内的特异蛋白,对识别淋巴管内皮细胞具有较高的特异性[ 9,10 ]。在高倍镜下进行微淋巴管计数,取5个不同视野的平均值作为微淋巴管密度。通过比较各组微淋巴管密度、转移淋巴结数目及淋巴结转移阳性率的差异评价恩度对肿瘤淋巴转移的抑制作用。
1.4 统计学处理采用SPSS 13.0统计软件进行统计学分析,数据以 ±s表示,组间差异采用独立样本的t检验进行比较。检验水准(α)为0.05。
2 结 果 2.1 各组肿瘤直径差值的比较
与给药前相比,给药后对照组、顺铂组、3个浓度(2、4、6 mg/kg)恩度组、3个浓度(2、4、6 mg/kg)恩度+顺铂组肿瘤变化差值分别为(3.58±0.43)、(1.47±0.30)、(1.68±0.26)、(1.50±0.26)、(1.25±0.22)、(0.33±0.18)、(0.30±0.16)、(0.08±0.16) mm,各实验组肿瘤平均直径差值小于对照组(P<0.05),恩度联合顺铂各组肿瘤直径差值小于单独使用恩度各组与顺铂组(P<0.05);单独使用恩度与顺铂的各组之间肿瘤直径差值差异无统计学意义(P>0.05)。 2.2 肿瘤组织、转移淋巴结形态学观察
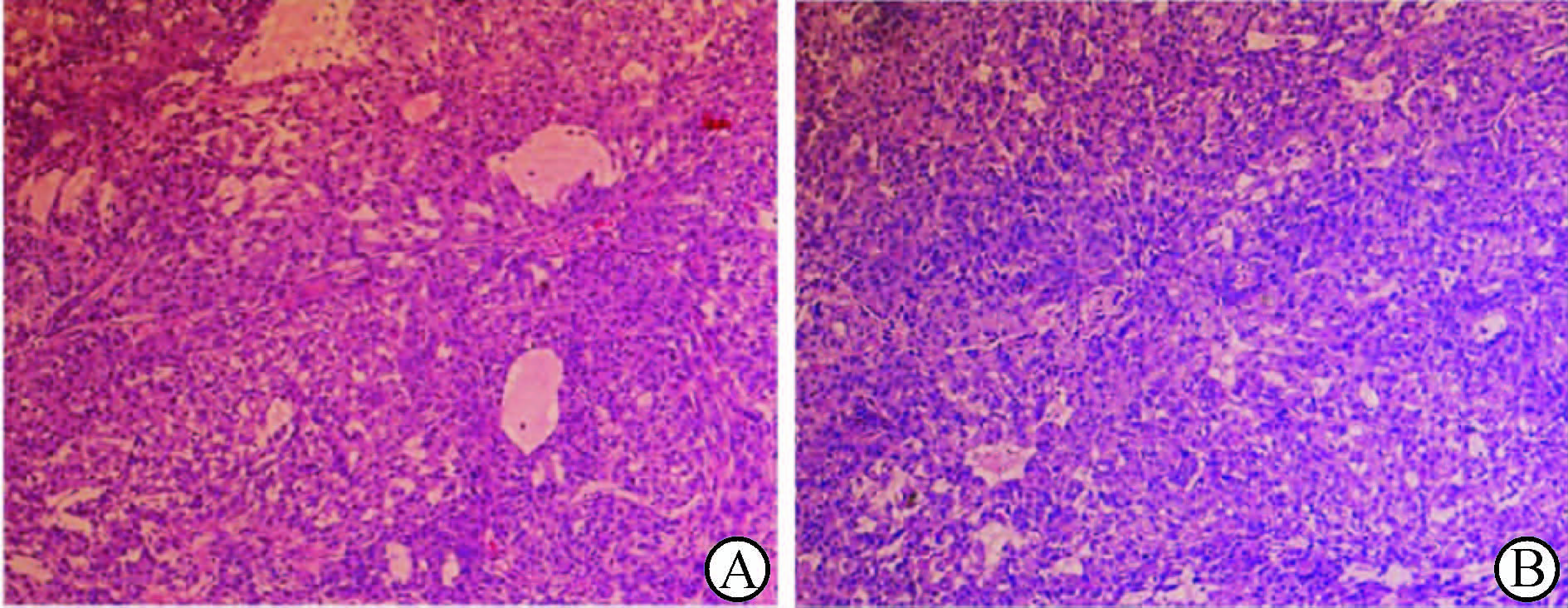
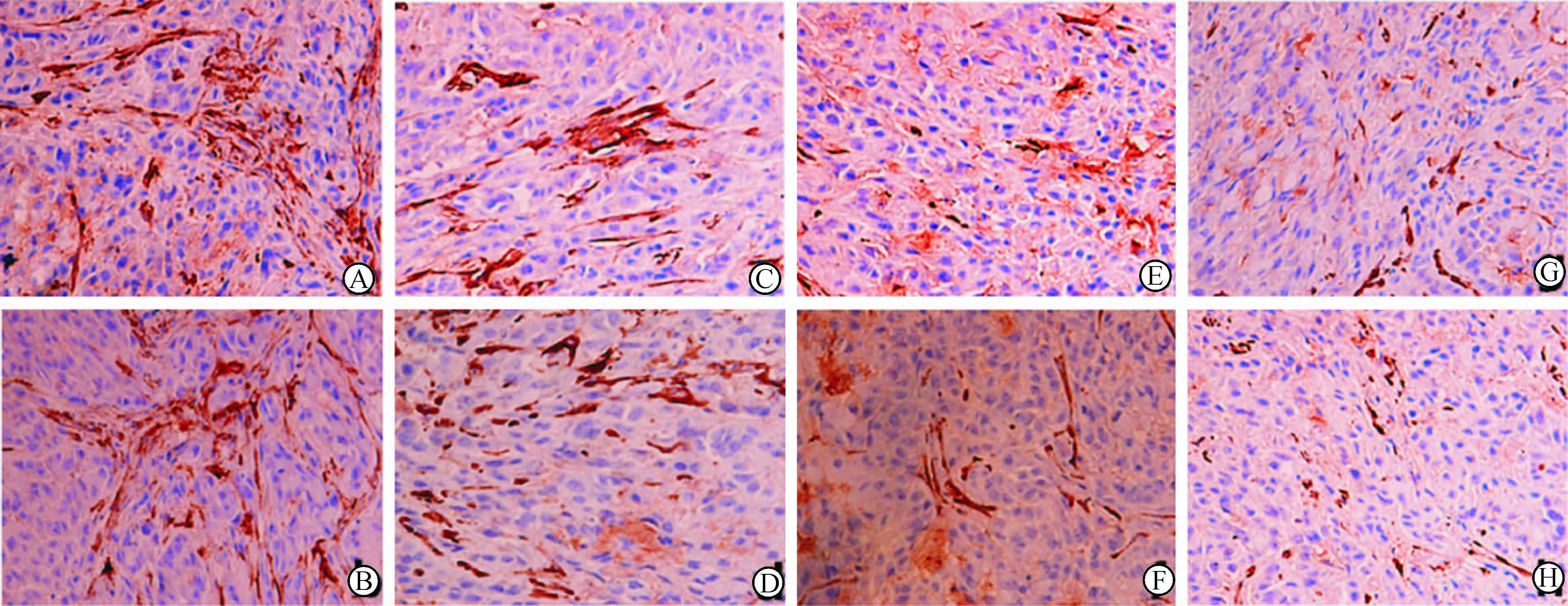
对肿瘤组织和可疑转移淋巴结组织进行H-E染色,结果显示,肿瘤组织符合肺腺癌病理改变,淋巴结组织符合转移癌组织病理改变,病理诊断为肺腺癌和肺癌淋巴结转移(图 1);肿瘤组织免疫组织化学染色结果显示,表达有podoplanin的微淋巴管内皮细胞呈棕黄色(图 2)。
|
图 1 肿瘤组织和转移淋巴结H-E染色结果 Fig 1 H-E staining of tumor tissue and metastatic lymph nodes A:H-E staining of tumor tissue; B:H-E staining of metastatic lymph nodes. Original magnification:×100 |
|
图 2 各组肿瘤组织经免疫组化处理微淋巴管着色后结果 Fig 2 Immunohistochemical staining of microlymphatic vessels of tumor tissue in each group A:Control group; B:Cisplatin group; C:Endostar 2 mg/kg group; D: Endostar 2 mg/kg+cisplatin group; E: Endostar 4 mg/kg group; F: Endostar 4 mg/kg+cisplatin group; G: Endostar 6 mg/kg group; H: Endostar 6 mg/kg+cisplatin group. Original magnification:×400 |
由表 1可见,3个浓度(2、4、6 mg/kg)恩度组、3个浓度(2、4、6 mg/kg)恩度+顺铂组的淋巴结转移阳性率、转移淋巴结数目及微淋巴管密度均明显低于对照组和顺铂组(P<0.05或P<0.01);3个浓度恩度组与3个浓度恩度+顺铂组中,6 mg/kg恩度和6 mg/kg恩度+顺铂组组淋巴转移阳性率、转移淋巴结数目及微淋巴管密度均低于2、4 mg/kg 恩度组和2、4 mg/kg恩度+顺铂组(P<0.05),而相同浓度恩度对应的恩度组和恩度+顺铂组间淋巴结转移阳性率、转移淋巴结数目及微淋巴管密度差异无统计学意义(P>0.05)。
|
|
表 1 各组淋巴结转移数、转移阳性率和微淋巴管密度的比较
Tab 1 Number of metastatic lymph nodes,positive rate of metastasis,and lymphatic vessel density in each group n=7, ±s ±s
|
在我国,肺癌发病率和死亡率均居恶性肿瘤第一位,是对人类健康和生命威胁最大的恶性肿瘤之一[ 11 ],且确诊时约三分之二为不可手术切除的晚期患者[ 1 ]。全身化疗是治疗中晚期肺癌的主要措施,细胞毒性药物是目前肿瘤化疗的一线药物,虽然能在一定程度上延缓肿瘤进展,但是不能完全阻止肿瘤的生长和转移,同时还伴有严重的不良反应[ 12 ]。本研究采用重组人血管内皮抑素注射液——恩度单独或联合顺铂治疗裸鼠肺癌模型,结果显示恩度联合顺铂提高了肿瘤的治疗效果,对肿瘤生长的抑制作用优于两种药物单独使用。恩度可以抑制血管内皮细胞的增殖和迁移,导致肿瘤血管生成减少,并增加血管渗透性,导致暴露于细胞毒性药物的肿瘤组织增加,使肿瘤细胞更容易被化疗药物杀死或抑制[ 13,14 ];同时,顺铂可以影响血管形成的过程,并导致严重的脉管毒性,进而增强内皮抑素的抗血管生成疗效[ 15 ]。因此,细胞毒性药物和抗血管生成药物联合使用能更有效地抑制肿瘤生长。
淋巴转移是肿瘤转移的主要途径之一,部分肿瘤患者在发现原发病灶的同时,已经出现了多处淋巴结转移[ 16 ] ,因此研究阻断肿瘤淋巴转移途径的方法意义重大。早期的观点普遍认为肿瘤通过周围已有的淋巴管转移,随着研究的深入,发现肿瘤可以诱导淋巴管生成从而促进转移[ 17,18 ]。本实验的创新点即在于研究重组人血管内皮抑素恩度对肺癌动物模型新生淋巴管的抑制作用,以期为血管生成抑制因子如重组人血管内皮抑素能否抑制肿瘤淋巴转移提供实验依据。比较实验中各组淋巴转移阳性率、转移淋巴结数目及微淋巴管密度检测结果的差异,可以认为恩度确实具有抑制肿瘤淋巴管生成的作用。Sleeman[ 19 ]认为,肿瘤发生早期进入血管的少量肿瘤细胞会因为血液中的血流动力学压力等因素而大部分被破坏,而淋巴管中淋巴液流动相对缓慢,侵入淋巴道的肿瘤细胞则可以继续增殖,先造成淋巴结转移,并在转移淋巴结内分化增殖,最终大量的肿瘤细胞通过胸导管进入血液循环到达全身各处组织器官而形成远处转移。推测恩度对肿瘤淋巴管生成的抑制作用,可以减少肿瘤细胞经过淋巴循环进入血液的机会,有效阻断肿瘤远处转移,降低肿瘤复发和转移的风险。
综上所述,我们通过对恩度抑制NSCLC裸鼠模型淋巴转移的基础研究,证实了恩度与传统化疗药物联合使用能够显著提高肿瘤的治疗效果,同时发现恩度除了被大家熟知的对肿瘤血管生成的抑制作用[ 5,6,7 ]外,还具有抑制肿瘤组织中淋巴管生成的作用,从而阻断肿瘤的淋巴转移,降低肿瘤复发和转移的风险。本研究结果不仅对NSCLC患者的治疗具有参考价值,也为易发生淋巴转移的其他恶性肿瘤提供了新的用药选择。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 陈 蕾,翁立坚,徐绮腻,郑 瑾.130例晚期非小细胞肺癌的预后分析[J].中国肿瘤临床,2005,32:748-750. |
| [2] | 汪力慧.恩度联合化疗与单纯应用化疗治疗晚期非小细胞肺癌的疗效比较[J].中国老年学杂志,2013,33:1384-1385. |
| [3] | Suzuki M,Iizasa T,Ko E,Baba M,Saitoh Y,Shibuya K,et al.Serum endostatin correlates with progression and prognosis of non-small cell lung cancer [J].Lung Cancer,2002,35:29-34. |
| [4] | 韩立春,邢德君.恩度联合TP方案治疗晚期非小细胞肺癌临床观察[J].中国肿瘤临床,2009,21:1205-1207. |
| [5] | 曲文书,秦叔逵,吴 穷,李苏宜,殷晓进,樊 馨.重组人血管内皮抑制素抑制内皮细胞血管生成的实验研究[J].临床肿瘤学杂志, 2008,13:307-302. |
| [6] | 史红媛,田 迎,胡秋菊,孟庆欣,王建东,卢光明.动态增强磁共振评价重组人血管内皮抑素抑制人肺癌裸鼠皮下移植瘤的血管生成[J].临床肿瘤学杂志,2012,17:17-23. |
| [7] | 赵登玲,邓 钢,李光超,余 辉,陈 晟,滕皋军.经肝动脉灌注重组人血管内皮抑制素联合TACE治疗兔VX2肝癌及肿瘤血管生成的评估[J].肿瘤,2008,28:211-215. |
| [8] | 张国明,庞作良,罗洞波.小鼠肺癌模型的建立及其在顺铂、恩度对比试验中的应用[J].新疆大学学报,2009,32: 946-948. |
| [9] | 王 艳,朱 波,叶明福,陈正堂.Podoplanin在非小细胞肺癌组织中的表达及其与肿瘤淋巴转移的关系[J].重庆医学,2005,34:1664-1666. |
| [10] | Schacht V,Ramirez M I,Hong Y K,Hirakawa S,Feng D,Harvey N,et al.T1alpha/podoplanin deficiency disrupts normal lymphatic vasculature formation and causes lymphedema [J].EMBO J,2003,22:3546-3556. |
| [11] | 王永川,魏丽娟,刘俊田,李世霞,王庆生.发达与发展中国家癌症发病率与死亡率的比较与分析[J].中国肿瘤临床,2012,39:679-682. |
| [12] | Cheng K,Zhao F,Gao F,Dong H,Men H T,Chen Y,et al.Factors potentially associated with chemotherapy-induced anemia in patients with solid cancers[J].Asian Pac J Cancer Prev,2012,13:5057-5061. |
| [13] | Folkman J.Angiogenesis in cancer therapy-endostatin and its mechanisms of action[J].Exp Cell Res,2006,312:594-607. |
| [14] | Nyberg P,Xie L,Kalluri R.Endogenous inhibitors of angiogenesis[J].Cancer Res,2005,65:3967-3979. |
| [15] | Miller K D,Sweeney C J,Sledge G W Jr.Redefining the target: chemotherapeutics as antiangiogenics[J].J Clin Oncol,2001,19:1195-1206. |
| [16] | Liang P,Hong J W,Ubukata H,Liu H R,Watanabe Y,Katano M,et al.Increased density and diameter of lymphatic microvessels correlate with lymph node metastasis in early stage invasive colorectal carcinoma [J].Virchows Arch,2006,448:570-575. |
| [17] | 吴而回,燕 敏.肿瘤抗淋巴管生成研究进展[J].世界华人消化杂志,2011,19:2555-2561. |
| [18] | Achen M G,Mann G B,Stacker S A.Targeting lymphangiogenes is to prevent tumour metastasis[J].Br J Cancer,2006,94:1355-1360. |
| [19] | Sleeman J P.The lymph node as a bridgehead in the metastatic dissemination of tumors[J].Recent Results Cancer Res,2000,157:55-81. |
 2014, Vol. 35
2014, Vol. 35


