2. 沈阳医学院药理学教研室, 沈阳 110034;
3. 沈阳医学院机能实验中心, 沈阳 110034
2. Department of Pharmacology, Shenyang Medical College, Shenyang 110034, Liaoning, China;
3. Center of Functional Experiment, Shenyang Medical College, Shenyang 110034, Liaoning, China
晕动病是感觉错配引起机体功能紊乱的代表。药理学及行为学研究表明,海马结构与啮齿类动物的晕动病发生有关[1],神经不匹配信号可能产生于海马结构。我们前期的研究表明,在感觉错配发生时海马结构的θ波活动增强,反复暴露于此感觉冲突环境中5 d,θ波活动逐渐降低,说明通过学习海马结构可接受此种新的感觉配置并将其视为匹配的状态[2]。另有文献报道,感觉错配条件下的训练可改善晕动病症状[3]。海马结构位置细胞的放电情况可反映海马结构在编码新的感觉配置时的内在活动,大鼠适应感觉错配条件后,其海马结构CA1区位置细胞的电活动鲜有报道。本研究拟对清醒大鼠在视觉-前庭感觉-本体感觉错配环境适应后采用电生理方法记录CA1区位置细胞放电,探讨海马结构编码新的感觉配置输入的机制,为海马结构参与晕动病的发生提供依据。 1 材料和方法 1.1 实验动物
10只雄性Wistar大鼠购自辽宁长生生物技术有限公司[生产许可证号:SCXK(辽)2010-0001,使用许可证号:SYXK(辽)2010-0006],体质量200~300 g,分笼饲养,自由摄食、饮水。
1.2 模型制备大鼠经戊巴比妥钠(40 mg/kg)腹腔麻醉。将牙托水泥帽安放在大鼠颅骨外表面,作为人造耳杆用于后续实验时将清醒大鼠无痛固定于立体定位仪上。经过1周恢复,在正向条件下(视觉-前庭感觉-本体感觉正常配置)训练大鼠2周。用钻头穿过牙托水泥帽及其下面的颅骨(AP:-2.0~-4.0 mm,LR:2.0~6.0 mm)钻一直径为3~5 mm的圆孔,暴露脑组织,用无菌的特氟龙软片覆盖,外涂环氧树脂胶封闭,以备神经细胞记录。
将带有透明塑料罩的立体定位装置及一个小型动物跑步机安装于一个可移动转台上。将大鼠头部无痛固定于可移动转台的立体定位架上,大鼠背部置于透明塑料罩内,四肢在跑步机上行走。在正向对照条件下,可移动转台以20 cm/s的速度沿“8”字型轨道(包含路径1和2)移动,大鼠在跑步机上的运动方向与可移动转台的运动方向一致。在反向条件下(即视觉-前庭感觉-本体感觉错配时),可移动转台在运动前旋转180°,尽管大鼠在跑步机上向前跑,但就大鼠的运动方向而言,可移动转台是向后移动的,于是产生视觉-前庭感觉-本体感觉错配的效果。整个实验过程中跑步机运行速度与可移动转台移动速度(20 cm/s)相同。整个实验包括3个时段[正向条件(正常感觉配置,即对照)、反向条件(感觉错配)、再次正向条件(正常感觉配置)]。
1.3 脑电图描记(EEG)与神经元记录以及神经元单位的隔离先将绝缘的不锈钢电极(直径:100 μm)尖端暴露0.3 mm,通过立体定位埋置在右侧或左侧的齿状回(DG)处(AP:3.8 mm,LR:1.5 mm,H:4.0 mm),用于EEG 记录。通过64导多通道信号获取处理器(MAP,Plexon Inc.,Dallas TX)将EEG数据储存在计算机中。经过连续5 d的EEG记录,EEG电功率明显下降后,从第6天开始,在海马结构CA1区记录其神经元的电活动。
将清醒大鼠固定于实验装置的约束罩内,移开无菌的特氟龙盖片,暴露脑组织。玻璃隔离的钨丝微电极(Z=1.0~1.5 MΩ,1 kHz)用立体定位的方式通过脉冲电动操纵器(SM-20,Narishige,Tokyo)逐步插入大鼠海马结构CA1区的不同部位。 神经元电活动通过64导多通道信号获取处理器储存在计算机中。采集窗口时间长度1.6 ms,采集窗口信号幅度200~600 μV,采样频率30 kHz,前置放大器放大倍数5 000,高通滤波250 Hz,低通滤波7.5 kHz,有效阈电位选择为-60~-80 μV。观察记录窗口的扫描波形,适当调整记录电极的深度,直至记录窗口出现大于阈电位的放电波形。实时观察信噪比(signal noise ratio,SNR)的大小,当稳定的SNR值大于3.0时记录采集放电信号。数字化的神经元活动使用Offline Sorter 程序(Plexon Inc.)通过其波形成分隔离成独立的单位,然后将其导入NeuroExplorer程序(Nex Technology,Littleton,MA)中进一步分析。记录大鼠海马结构CA1区神经元在3个实验时段的活动情况,每个实验时段都从路径1开始。
1.4 位置细胞的活动分析每条路径分为56个连续像素,分别构建路径1和路径2 的放电率图谱。计算每个像素的平均放电率作为沿路径1或2移动过程中所有经由该像素放电次数的每秒平均值。各实验时段之间的放电分布相似性用Pearson 相关系数(r)进行比较,由于放电位置处较小的差异或放电率的0值大大地影响了相关系数,因此放电率图谱需要通过均匀法再次构建。给定像素的均匀化的放电率定义为3个像素的均值(即给定像素及2个相邻的像素)。某像素放电率均值的增强指该放电率高于此神经元在某路径的某实验时段内全部像素平均放电率的2倍以上。在路径1或2,至少有3个相邻像素的放电率均值超过该路径某实验时段内全部像素平均放电率的2倍以上,该海马位置细胞的神经元定义为位置细胞[4, 5, 6]。在各实验时段(即正向条件、反向条件、再次正向条件)分别对该位置细胞进行分析,至少有一个时段呈现位置野的海马结构神经元才可进行下一步分析。
为评价各时段空间放电模式的相似性,我们分别计算了第1时段与随后两时段放电率分布的像素-像素相关系数。以路径1或2在第1时段(正向条件)的放电率图谱作为对照,其他两时段的放电率图谱分别对路径1和2进行构建,然后分别与第1时段(对照)中相应路径的放电率图谱通过计算Person相关系数进行比较。
1.5 位置细胞的分类位置细胞基于位置野及相关系数进行分类[6]。当海马结构神经元在第2时段(反向条件)表现出位置野且在第1和(或)第3正向时段也同时出现位置野时,该位置细胞称为双向移动相关神经元。
双向移动相关神经元根据相关系数进一步分成2个亚型。对于双向移动相关神经元,如果在给定路径(路径1或2)第1与第3正向时段之间的相关系数以及第1正向与第2反向时段之间的相关系数大于0.4,称这种位置细胞对该路径为经验非依赖型。如果相关系数之一没有达到0.4,这些神经元称作经验依赖神经元。
1.6 位置野分析首先,位置野的大小通过计数位置野中像素的数量进行简单分析。其次,分析位置野放电率的分布,计算位置野中放电率分布的偏斜度。第三,分析位置野中放电率分布的非对称性。计算位置野中放电率分布的质量中心的位置,通过质量中心将位置野分为两部分。位置野非对称指数指两部分之间像素数目的差异(即沿运动方向,位置野第1部分像素的数目减去第2部分像素的数目)。
1.7 组织学分析所有实验结束时,每只大鼠用戊巴比妥钠(50 mg/kg ,腹腔注射)再次麻醉,在神经元记录的位置处进行电凝损毁(80 μA,60 s),切片、染色确定记录位置。见图 1。
1.8 统计学处理 应用SPSS 17.0统计学软件分析数据,计量资料以 ±s表示。采用秩和检验比较神经元各实验时段间Pearson相关系数的差异。采用t检验比较组间θ电功率以及位置野长度、偏斜度、非对称指数的差异。检验水准(α)为0.05。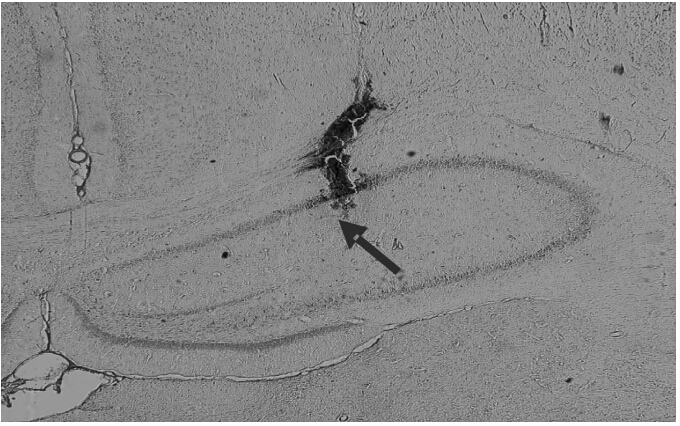 | 图 1 电极位置的组织学确定Fig 1 Histological confirmation of the electrode position Nissl staining of hippocampal slice: the top of the brown bar(arrow) indicated the actual position of the electrode marked by a 80 μA,60 s of current. Original magnification: ×100 |
在海马结构位置细胞电活动记录前对10只大鼠进行EEG记录,通过对θ电功率的计算了解大鼠对视觉-前庭感觉-本体感觉错配的适应。大鼠在第1天遭遇反向时段的感觉错配时,其θ电功率(1.53±0.03)较正常感觉配置的第1正向时段(1.01±0.02)及第3正向时段(1.01±0.04)显著增高(P<0.01)。在第5天,反向时段的θ电功率(1.12±0.06)与第1正向时段(1.08±0.03)及第3正向时段(1.00±0.02)比较差异无统计学意义,且与第1天反向时段的θ电功率(1.53±0.03)比较差异有统计学意义(P<0.01)。
2.2 大鼠海马结构CA1区位置细胞的特征性放电记录161个海马结构CA1区神经元电活动,其中位置细胞56个。每个神经元记录均经历正向(视觉-前庭感觉-本体感觉正常配置,对照)、反向(感觉错配)、再正向3个实验时段,各实验时段均包括3整圈(每圈包括路径1和2)可移动转台的运动。海马结构位置细胞锋电位的叠加波形及锋电位自相关图提示: 所有海马结构神经元锋电位记录均来自于单一神经元。
2.2.1 经验非依赖型双向移动相关位置细胞56个位置细胞中,11个(19.6%)神经元在路径1的每个时段均显示稳定的位置野。这些神经元在第1和第3正向时段以及第1正向和第2反向时段的Pearson相关系数均大于0.4。3个(5.4%)神经元在路径2亦有相同类型的位置野表现。对经验非依赖型位置细胞的相关系数分析表明:第1和第3正向时段间的相关系数均值(0.61±0.03)与第1和第2时段的相关系数均值(0.60±0.04)相比,差异无统计学意义(秩和检验,P>0.05)。
图 2显示在路径1的3个时段具有稳定位置野的位置细胞。此神经元在正向、反向条件下均显示位置野,在通过各时段时位置野没有变化(第1正向与第2反向时段相关系数为0.86;第1与第3正向时段相关系数为0.83)。
2.2.2 经验依赖型双向移动相关位置细胞56个位置细胞中,12个(21.4%)神经元在两条路径的各时段出现位置野重构,显示经验依赖的空间放电模式;6个(10.7%)神经元在路径1的各时段表现出经验依赖的空间放电模式; 15个(26.8%)神经元在路径2的各时段表现出经验依赖的空间放电模式。图 3 显示在路径1具有经验依赖位置野的位置细胞,此神经元在各实验时段表现出不同的位置野,以至于第1正向和第2反向时段间(r1=-0.15)以及第1和第3正向时段间(r1=-0.12)出现低相关系数。
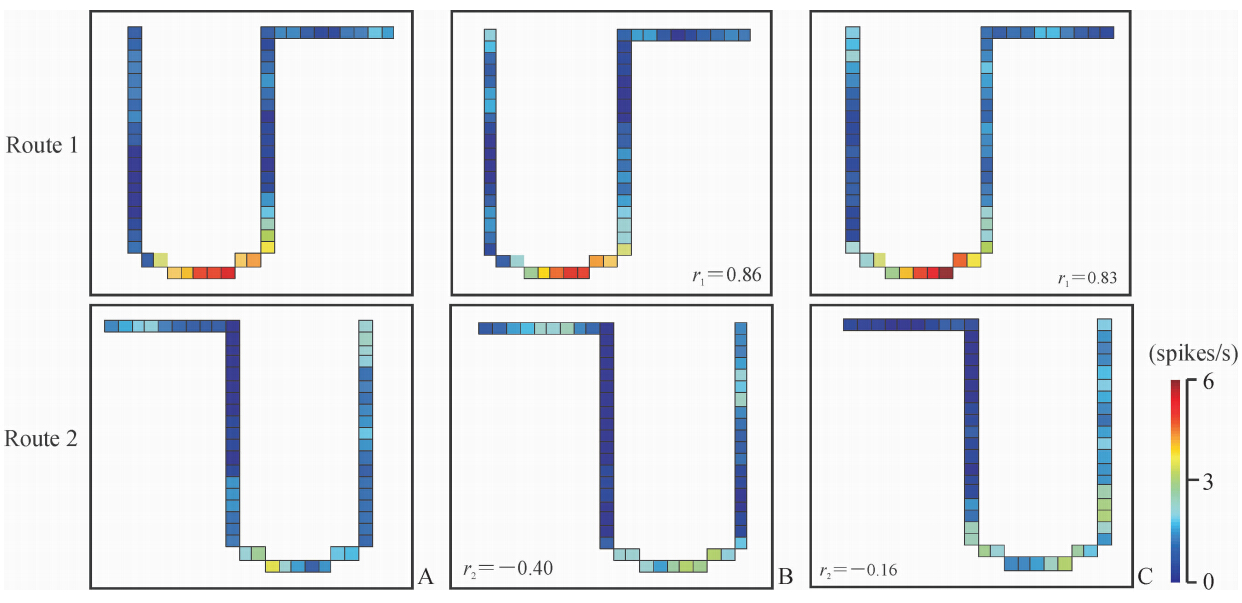 | 图 2 具有稳定空间放电形式的经验非依赖型双向移动相关位置细胞Fig 2 Experience-independent bi-directional movement-related place cells with stable spatial firing patternsA: Forward (1st session,normal sensory configuration,control);B: Backward (2nd session,sensory mismatch); C: Forward (3rd session ,same as 1st session). The stable place fields were consistently observed across the 3 sessions in Route 1. 1st forward vs 2nd backward session: r1=0.86;1st vs 3rd forward session: r1=0.83 |
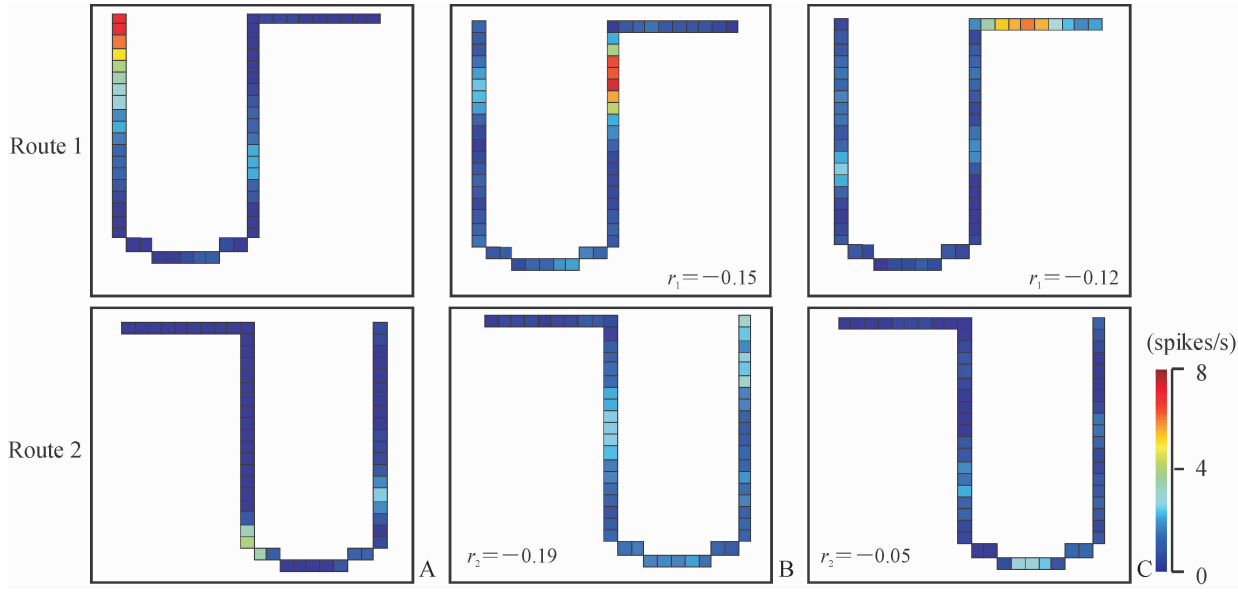 | 图 3 具有不稳定空间放电形式的经验依赖型双向移动相关位置细胞Fig 3 Experience-dependent bi-directional movement-related place cells with unstable spatial firing patternsA: Forward (1st session,normal sensory configuration,control); B: Backward (2nd session,sensory mismatch); C: Forward (3rd session,same as 1st session). The unstable place fields were consistently observed across the 3 sessions in Route 1. 1st forward vs 2nd backward session: r1=-0.15;1st vs 3rd forward session: r1=-0.12 |
经验非依赖型双向移动相关神经元位置野长度的均值[(6.59±0.73)像素]高于经验依赖型神经元[(5.46±0.67)像素],差异有统计学意义(P<0.01)。
在偏斜度分析中,经验非依赖型神经元位置野放电率分布的偏斜度均值为-0.58±0.07,经验依赖型神经元为-0.63±0.05,两组间差异无统计学意义(P>0.05)。
经验非依赖型双向移动相关神经元位置野的非对称指数均值[(1.03±0.04)像素]高于经验依赖型神经元[(0.87±0.02)像素],差异有统计学意义(P<0.05)。根据定义,位置野非对称指数为正值表明放电分布的质量中心位于位置野的后半部,并且从位置野的入口到质量中心放电率逐步增加,然后在大鼠离开位置野时放电率相对或突然回到基线水平。
3 讨 论 3.1 海马位置细胞的特征
位置细胞是与大鼠活动所处位置密切相关并具有复杂锋电位的海马锥体细胞,位置细胞主要存在于海马的CA1和CA3区。海马不同亚区在信息处理过程中存在不同作用。CA1区的作用在于探测环境中的新奇事物,比较动物从内嗅皮质获得的当前信息和存储在CA3-DG中的既往信息;而CA3在空间记忆痕迹形成早期发挥作用[7]。我们对大鼠海马结构CA1区神经元在正向(视觉-前庭感觉-本体感觉正常配置)及反向(视觉-前庭感觉-本体感觉错配)条件下进行电生理记录,该亚区部分位置细胞对正向及反向条件呈现特异性的空间放电形式。在此神经元记录以前,将大鼠使用相同的装置经历同样3个实验时段充分训练至少5 d,并记录其海马结构θ节律,发现反向时段θ节律的活动逐渐降低到近似第1正向时段水平。这表明大鼠能很好地适应感觉错配的条件。本实验记录的神经元不是错配细胞,而是编码新的感觉输入配置的位置细胞,这些位置细胞在位置野呈现学习记忆相关的特异性变化。
本研究通过对位置细胞的位置野进行分析发现:位置野是非对称性的,位置野的偏斜度是负值,位置野的非对称指数是正值,这表明本研究对位置细胞的判定与以前的研究报道[8]相符。在本研究中,正向对照条件下,大鼠在跑步机上的奔跑方向与可移动转台的运动方向一致,即可移动转台前进时大鼠在跑步机上向前跑。在反向条件下(即视觉-前庭感觉-本体感觉错配时),可移动转台在运动前旋转180°,尽管大鼠在跑步机上向前跑,但就可移动转台向前运动而言,大鼠的运动方向是完全相反的,于是产生视觉-前庭感觉-本体感觉错配,这种错配感觉是大鼠正常生活中无法自然遇到的。在正向及反向时段,位置野的非对称指数始终为正值,即位置野的非对称改变始终与运动转台的移动方向是一致的。这表明即使在无法自然遇到的感觉错配条件下,大鼠海马结构也能编码并预测将来的运动方向。此外,两种类型的位置细胞之间存在显著的差异:位置野的长度在经验非依赖型神经元比经验依赖型神经元大,并且位置野非对称指数也显示类似的趋势。这表明大鼠经过重复训练其位置细胞的位置野变化在经验非依赖型神经元比经验依赖型神经元更明显。N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)依赖的长时程增强(long-term potentiation,LTP)/长时程抑制(long-term depression,LTD)可能导致位置野的非对称变化[9],经验非依赖型神经元的海马结构神经环路通过NMDA依赖的过程比经验依赖型神经元更稳定。
经验非依赖型双向移动相关神经元在同一路径的正向、反向时段的相同位置出现位置野、视觉流和前庭感觉之间的配置在正向和反向两个时段是截然相反的,因此这些神经元编码动物的位置可能根据远处线索,与视觉流和前庭感觉无关。在本研究中,我们也记录到一些经验依赖型的双向移动相关神经元,这些神经元位置野的重构对维持最初新的位置记忆十分必要[10]。
在反向时段,上述两种类型的位置细胞能编码冲突的感觉/运动信息,此时前庭与视觉的信息不能与本体感觉(运动传出“拷贝”)相匹配。这表明位置细胞可以编码会聚的感觉传入信息,前庭信息是感觉输入之一,海马结构可能编码感觉输入的任何组合[11]。
3.2 感觉错配适应过程中海马位置细胞的作用感觉错配可引起具有自主神经紊乱症状的晕动病[12, 13]。研究表明,海马结构与下丘脑和扁桃核等自主神经中枢有密切的解剖联系[14],海马体的活动与自主神经功能以及内脏感觉有关[15]。因此与晕动病相关的自主神经紊乱可能部分归因于由新奇感觉冲动引起的海马体功能变化。
在模拟太空感觉冲突的环境下对宇航员进行飞行前训练可改善晕动病症状,适应性训练已成为治疗晕动病的一种方法。在人类,使用虚拟现实进行的行为学研究发现:一些受试者能情景依赖地适应不同条件下发生在视觉与本体-前庭感觉输入之间的感觉冲突[16]。与临床研究相符,反复暴露于感觉冲突条件下可降低大鼠海马结构θ节律的电功率[2]。本研究表明一些位置细胞在重复暴露于反向条件后可编码这一条件的感觉信息。编码感觉错配信息的位置细胞的存在可能有助于更新海马结构内原本储存的记忆,使海马比较器[17]能够接受这种新的错配信息并将其作为储存信息的一种匹配形式而存留。
总之,本研究结果表明,海马结构位置细胞有能力编码一个不能自然发生的感觉错配输入,更新海马结构比较器内的信息。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Uno A,Takeda N,Horii A,Sakata Y,Yamatodani A,Kubo T.Effects of amygdala or hippocampus lesion on hypergravity-induced motion sickness in rats[J].Acta Otolaryngol,2000,120:860-865. |
| [2] | Zou D,Aitake M,Hori E,Umeno K,Fukuda M,Ono T,et al.Rat hippocampal theta rhythm during sensory mismatch[J].Hippocampus,2009,19:350-359. |
| [3] | Newman M C,McCarthy G W,Glaser S T,Bonato F,Bubka A.Motion sickness adaptation to Coriolis-inducing head movements in a sustained G flight simulator[J].Aviat Space Environ Med,2013,84:104-109. |
| [4] | Muller R U,Kubie J L.The effects of changes in the environment on the spatial firing of hippocampal complex-spike cells[J].J Neurosci,1987,7:1951-1968. |
| [5] | Kobayashi T,Nishijo H,Fukuda M,Bures J,Ono T.Task-dependent representations in rat hippocampal place neurons[J].J Neurophysiol,1997,78:597-613. |
| [6] | Dayawansa S,Kobayashi T,Hori E,Umeno K,Tazumi T,Ono T,et al.Conjunctive effects of reward and behavioral episodes on hippocampal place-differential neurons of rats on a mobile treadmill[J].Hippocampus,2006,16:586-595. |
| [7] | Lee I,Rao G,Knierim J J.A double dissociation between hippocampal subfields: differential time course of CA3 and CA1 place cells for processing changed environments [J].Neuron,2004,42:803-815. |
| [8] | Mizuseki K,Buzsáki G.Preconfigured,skewed distribution of firing rates in the hippocampus and entorhinal cortex[J].Cell Rep,2013,4:1010-1021. |
| [9] | Mehta M R,Quirk M C,Wilson M A.Experience-dependent asymmetric shape of hippocampal receptive fields[J].Neuron,2000,25:707-715. |
| [10] | McKenzie S,Robinson N T,Herrera L,Churchill J C ,Eichenbaum H.Learning causes reorganization of neuronal firing patterns to represent related experiences within a hippocampal schema[J].J Neurosci,2013,33: 10243-10256. |
| [11] | Ho S A,Hori E,Kobayashi T,Umeno K,Tran A H,Ono T,et al.Hippocampal place cell activity during chasing of a moving object associated with reward in rats[J].Neuroscience,2008,157:254-270. |
| [12] | Stern R M,Hu S Q,Vasey M W,Koch K L.Adapation to vection-induced symptoms of motion sickness[J].Aviat Space Environ Med,1989,60:566-572. |
| [13] | Nishiike S,Okazaki S,Watanabe H,Akizuki H,Imai T,Uno A,et al.The effect of visual-vestibule-somatosensory conflict induced by virtual reality on postural stability in humans[J].J Med Invest,2013,60:236-239. |
| [14] | Petrovich G D,Canteras N S,Swanson L W.Combinatorial amygdalar inputs to hippocampal domains and hypothalamic behavior systems[J].Brain Res Rev,2001,38:247-289. |
| [15] | Aitake M,Hori E,Matsumoto J,Umeno K,Fukuda M,Ono T,et al.Sensory mismatch induces autonomic responses associated with hippocampal theta waves in rats[J].Behav Brain Res,2011,220:244-253. |
| [16] | Dumontheil I,Panagiotaki P,Berthoz A.Dual adaptation to sensory conflicts during whole-body rotations[J].Brain Res,2006,1072:119-132. |
| [17] | Duncan K,Ketz N,Inati S J,Davachi L.Evidence for area CA1 as a match/mismatch detector:a high-resolution fMRI study of the human hippocampus[J].Hippocampus,2012,22:389-398. |
 2014, Vol. 35
2014, Vol. 35


