2. 第二军医大学长海医院胸心外科, 上海 200433
2. Department of Cardiothoracic Surgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
冠状动脉(冠脉)梗阻导致心肌细胞缺血损伤、坏死而引发的缺血性心脏病是人类死亡的主要原因之一。健康细胞移植替代损伤、坏死心肌细胞可明显促进局部血管新生,改善心功能,防止心室壁变薄及瘢痕的扩大[1,2]。但在缺血环境中移植细胞成活率较低,提高细胞的成活率有助于进一步提高移植治疗效果。黄盛东等[3]成功制备了血管生长素(angiogenin,ANG)衍生物重组腺病毒(Ad-ANG),并发现其具有促进缺血局部血管增生的潜能。因此,本研究将Ad-ANG体外转染自体骨髓基质细胞(marrow stromal cells,MSCs),再注射移植到慢性心肌缺血猪模型,观测缺血区心肌血管再生、MSCs的成活情况及其对心功能的影响,以探讨高表达ANG的自体基质细胞移植对缺血性心脏病心功能的保护和促血管新生作用。 1 材料和方法 1.1 主要仪器及试剂
呼吸机、磁共振(MRI)仪及冠脉数字减影血管造影(DSA)机(德国Siemens公司);HP 5500心脏彩色超声仪(美国Hewlett-Packard公司);荧光显微镜(德国Leica公司);冠脉缩窄环(Ameriod环,美国Research Instruments公司);兔抗人ANG抗体,免疫组化染色试剂盒(美国Santa Cruz公司);抗兔辣根过氧化物酶(美国Vector Laboratories公司);ECL化学发光系统(上海普飞生物科技公司);CM-DiI (美国Molecular Probes公司);胎牛血清、胰酶(美国Gibco公司);手术器械(上海手术器械厂)。
1.2 动物模型的建立及分组 选用Yorkshire实验猪36只,体质量20~25 kg,雌雄不限,购自第二军医大学实验动物中心(许可证号:后医动字1101号)。动物模型的建立和缺血心肌MSCs细胞的注射均在麻醉下完成。麻醉采用气体吸入和静脉注射复合麻醉(氯胺酮5 mg/kg,2%异氟烷吸入维持),气管插管。麻醉后右侧卧位,左侧经第3肋间进胸,打开心包暴露心脏,在冠脉左旋支(LCx)近心端安置冠脉缩窄环。术后恢复呼吸后,常规饲养。约在术后第28天常规冠脉造影,心脏短轴面经TTC(1,3,5-三苯基氯化四氮唑)染色,评价动物模型的效果。模型动物随机分3组,每组12只。组Ⅰ为高表达ANG的自体MSCs移植组 (Ad-ANG-MSCs组);组Ⅱ为单纯自体MSCs移植组(Ad-null-MSCs组);组Ⅲ为注射无血清DMEM培养液的对照组(Control组)。 1.3 高表达ANG的MSCs的制备Ad-ANG的获得:ANG衍生物cDNA 的克隆与测序,E1、E3 缺陷型重组腺病毒黏粒构建,Ad-ANG的产生和扩增详见文献[3]。MSCs的分离培养:骨髓细胞取自猪自体髂骨骨髓,利用Ficoll密度梯度离心法获得其中的骨髓基质细胞,贴壁培养(37℃、含20%FBS的IMDM培养液、5%CO2、72 h)后获得高纯度的MSCs[4]。高表达ANG的MSCs的获得:Ad-ANG转染培养细胞(感染复数为50,24 h)。同时以Ad-GFP(高表达绿色荧光蛋白)检验转染率,经检测该法可接近100%的转染率。
1.4 活细胞标记及MSCs的注射移植首先制备MSCs单细胞悬液,加入CM-DiI,25℃下混悬20 min。用荧光显微镜观察MSCs细胞可见染色均匀,红色荧光强度高于背景100倍,说明标记成功。MSCs的注射移植:慢性心肌缺血模型一般在4周可成功建立。将经冠脉造影评价为成功的动物模型再次麻醉开胸,沿LCx分布的心肌缺血区均匀选择9个点进行MSCs的注射移植。组Ⅰ注射移植高表达ANG的自体MSCs;组Ⅱ注射移植未转染Ad-ANG的自体MSCs;组Ⅲ则注射无血清DMEM培养液。细胞密度为2×107/mL,注射量约每点0.5 mL。为防止细胞自针眼逆向流出,在针眼处心外膜用6-0 prolene线“U”字缝闭针眼。
1.5 冠脉造影将实验动物麻醉,自股动脉建立动脉插管,DSA机下完成。每只模型动物在注射移植MSCs前及注射移植后4周分别行两次冠脉造影,用于评估动物模型的建立(LCx已完全闭塞或闭塞大于95%认为是有效的动物模型),并评估移植治疗的效果。移植治疗效果常用侧支循环指数(Rentrop计分法)进行评估:主血管完全充盈评为3分;主血管部分充盈评为2分;分支血管微弱充盈,主血管不充盈评为1分;未见到侧支血管评为0分[5]。
1.6 心脏彩色超声检查在实验动物麻醉状态下,采用心脏彩色超声仪检测心功能各项指标,如射血分数(EF)、缺血区心室壁厚度(IWT)、左室舒张末容积(LVEDV)等的变化。
1.7 病理组织学检查在实验完成后处死动物(麻醉下推注高浓度KCl液),心脏停跳后立即取出心脏标本。左室梗死区的百分数计算:将标本沿心脏冠状面切成厚约0.5 cm薄片,并双面拍照,去除心房及右心室后,称量每一薄片。利用Scion Image Analysis program软件系统测出每一片心肌梗死区的分数,并取上下两面间的平均值。左室梗死区的百分数等于每一片心肌梗死区的百分数与该片心肌质量的乘积之和除以整个左心室的总质量。成活的移植细胞观察:制作冰冻切片,在荧光显微镜下观察MSCs注射移植区,比较成活MSCs细胞的分布、数量等。血管计数:常规制作石蜡切片,观察MSCs注射移植区的新生血管情况并计算总血管数。
1.8 蛋白质印迹检测ANG蛋白的表达提取MSCs注射移植区组织样本蛋白,电泳、转膜。按顺序加入兔抗人ANG抗体、抗兔辣根过氧化物酶,ECL显色。定量分析底片灰度(Image-Quant软件)。
1.9 统计学处理采用SPSS 19.0统计软件包进行统计学分析,计量资料以 ±s表示,Rentrop分数采用Kruskal-Wallis检验。检验水准(α)为0.05。
2 结 果 2.1 慢性缺血性心脏病猪模型的建立
3只猪在建模手术后死亡,1只猪在二次手术时失误导致死亡,另1只在二次手术后因感染死亡,剩余31只猪存活至实验完成,纳入后续研究。其中组Ⅰ 11只,组Ⅱ 10只,组Ⅲ 10只。在两次外科手术中各组间的血流动力学(心率、血压)无差异。安放Ameroid环后4周,经冠脉造影示LCx 100%闭塞,LCx支配区域无明显搏动;左前降支(LAD)支配区域则无改变,保持100%通畅;心脏短轴面经TTC染色,缺血或梗死心肌不着色,而正常心肌呈砖红色(图 1)。结果提示心肌慢性缺血猪模型成功建立。
 | 图 1 慢性心肌缺血动物模型的建立Fig 1 Establishment of porcine chronic ischemic heart model A: An ameroid occluder around left circumflex (LCx) coronary artery and formation of the infarction area; B: A left ventricle cross-section showing the infarction area; C: An occluded ameroid ring 4 weeks after implantation; D: An pre-implantation ameroid ring |
MSCs形态呈梭形,贴壁生长,细胞生长较迅速(图 2A);荧光显微镜下,MSCs细胞CM-DiI染色均匀,荧光强(图 2B)。
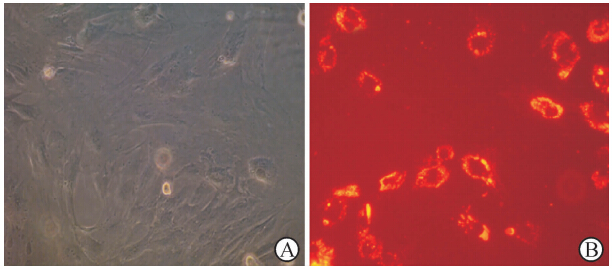 | 图 2 MSCs移植前形态和CM-DiI染色Fig 2 Pre-implanted marrow stromal cells (MSCs) morphology and CM-DiI staining under fluorescence microscopyA: MSCs grew rapidly with spindle morphology; B: MSCs showed uniform CM-DiI staining. Original magnification:×200 |
动物模型建立后经冠状动脉造影行Rentrop评分,各组差异无统计学意义。经过干预治疗,4周后再次行冠状动脉造影及Rentrop评分,显示组Ⅰ分值升高最为显著,与治疗前及组Ⅱ和组Ⅲ治疗后比较差异均有统计学意义(P<0 01,图 3、表1)。
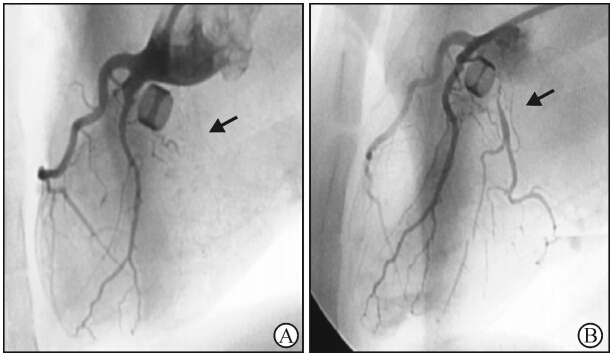 | 图 3 治疗前后冠脉造影比较Fig 3 Comparison of coronary angiography analysis before and after treatmentThe collateral vessel formation and enhanced perfusion of left circumflex (LCx) 4 weeks after marrow stromal cell implantation (arrows). A: Pre-treatment; B: Post-treatment |
| 表1 各组Rentrop分值的改变情况Tab 1 Changes of Rentrop scores by coronary artery angiography in each group ±s |
动物模型建立后,心脏彩色超声检查显示左心室明显增大,LCx供血区心室壁变薄,心脏搏动减弱,收缩力降低,EF明显降低。经干预治疗后4周,组Ⅰ变薄心肌厚度有所增加,LVEDV减小,心肌收缩明显改善,EF增加,差异有统计学意义(P<0.01)。组Ⅱ改善程度较组Ⅰ弱,组Ⅲ则缺血区心室壁继续变薄,缺血区面积增大(P<0.01,表2~表4)。
| 表2 各组EF值的变化情况Tab 2 Changes of ejection fraction (EF) by echocardiography in each group ±s |
| 表 3 各组缺血区心室壁厚度的变化情况Tab 3 Changes of ischemic wall thickness (IWT) by echocardiography in each group l/mm, ±s |
| 表4 各组左室舒张末容积的变化情况Tab 4 Changes of left ventricular end diastolic volume (LVEDV) by echocardiography in each group ±s,V/mL |
左室侧壁LCx供血区心室壁厚度获得维持,组Ⅰ心脏的几何构型接近正常,心肌缺血区面积较小(图 4A),组Ⅲ心脏几何构型破坏,心肌缺血坏死区面积较大(图 4B)。组Ⅰ缺血坏死百分数为(3.35±1.35)%,组Ⅱ为(6.57±3.11)%,组Ⅲ为(16.47±5.31)%,统计分析表明,组Ⅰ与组Ⅱ、组Ⅲ比较缺血区减小(P<0.05),组Ⅱ较组Ⅲ减小(P<0.05)。
在心肌缺血边缘,组Ⅰ可见较大量成活的经CM-DiI标记的移植细胞(图 4C),这些细胞与成纤维细胞和自体心肌细胞形成了较小的缺血区面积,维持了心脏的几何结构。组Ⅱ也可见成活的经CM-DiI标记的移植细胞,但其呈零星样分布,数量明显较组Ⅰ少。组Ⅰ在缺血的边缘区明显可见新生血管形成(图 4D),其高倍视野下的血管数量为(33.5±11.6)个/HPF,而组Ⅱ、组Ⅲ分别为(11.2±6.6)和(1.3±0.5)个/HPF。各组之间差异均具有统计学意义(P<0 01)。
 | 图 4 病理学检查图片Fig 4 Pathological examinationA: Group Ⅰ (treated with autologous marrow stromal cells transfected with angiogenin) had smaller ischemic area,preserved thickness of the lateral wall,and the geometry of the left ventricle (arrow); B: Group Ⅲ (treated with serum-free DMEM medium) had geometry loss of the left ventricle and ventricle wall thinning (arrow); C: Group Ⅰ had a large number of CM-DiI labeled marrow stromal cells (arrow) on fluorescence microscope; D: Group Ⅰ had distinct angiogenesis and increased vascular vessels in the marginal zone by H-E staining. Original magnification: ×100(C),×200(D) |
组Ⅰ左室侧壁缺血区ANG蛋白相对表达量为0.325±0.058,组Ⅱ为0.079±0.025,组Ⅲ为0.091±0.019,前者明显高于后两者(P<0.01),后两者间差异无统计学意义。
3 讨 论
一系列研究证实细胞移植能明显增强缺血心肌心功能,但机制并不明确[6,7,8]。目前比较明确的观点是细胞移植能够促进血管新生,改善局部血液供应,维持心室壁厚度,防止心室扩张,进而改善心功能,推迟心功能衰竭的发生[9,10]。然而移植细胞在缺血环境中能否成活及成活时间长短是影响其治疗效果的重要因素。由于植入体内的Ameroid环缓慢膨胀,使环内的血管逐渐缩窄,约经过3~4周可使血管完全闭塞,因此较好地模拟了人类由于粥样斑块形成逐渐阻塞冠状动脉而形成缺血性心脏病的慢性病理过程。猪作为大型动物,被认为是建立最接近人的慢性缺血性心脏病模型的动物[11,12]。本研究中冠脉造影提示几乎所有动物均形成满意的模型。
移植MSCs能够维持心室壁厚度,防止心室几何结构破坏,从而改善心功能,这是由于其具有多向分化潜能的多能干细胞的特性,能分化成多种细胞类型,自我更新,替代缺血坏死的细胞、组织,达到治疗缺血性心脏病的目的[11]。 由于MSCs获得较为方便,细胞易于培养扩增,经常被应用为基因载体。本实验正是利用了这些特性,选用MSCs作为移植细胞。此外,应用自身的MSCs可避免异体移植所引起的免疫原性,从而提高了MSCs在缺血区的成活率。
ANG属RNA酶超家族,相对分子质量约为14 400,具有较为强大的促血管生成作用[13,14]。体外实验发现ANG能够对包括平滑肌细胞、内皮细胞等表现出很强的促细胞增殖、增生作用;体内实验也显示其能够在局部刺激形成新生血管,促进局部血供[15,16]。腺病毒介导的基因转染具有很高的转染效率(接近100%),性质较稳定,对人类相对安全,且其宿主范围广,包装容量大,可达到很高滴度,在体内基因转移中具有较大优势。因此本研究采用腺病毒作为转染载体,蛋白质印迹结果也证实移植转染Ad-ANG的细胞4周后缺血心肌仍较强地表达ANG蛋白。
CM-DiI是一种细胞膜荧光染色剂,通过与膜结构的脂质分子结合而标记细胞,染色率可达100%,有着强而稳定的红色荧光。CM-DiI对细胞无毒,对染色细胞的生长、分裂、分化和活力均无影响,可通过细胞分裂使子代细胞膜染色;且稳定长效,可在细胞表面保持半年到1年[17]。本实验中,在移植后的4周,荧光显微镜下可见具有稳定红色荧光的移植细胞,说明CM-DiI是个良好的示踪剂,能够有效显示移植细胞在活体组织中的迁移及分化。
在本实验中,经心脏彩色超声检查并计算缺血区大小后发现,移植转染Ad-ANG的MSCs使EF增加,心脏功能较前明显改善,心室壁厚度增加,有效地防止心室几何结构破坏。未转染Ad-ANG的MSCs移植亦能使心功能改善,但其改善的程度较转染组小,而对照组则心室壁厚度进一步变薄,缺血梗死面积扩大,与既往文献[4, 6, 11, 18]结果类似。
针对转染Ad-ANG是否使局部ANG蛋白表达增高、是否促进局部血管增生以及是否促进移植的MSCs成活,本实验发现,转染组(组Ⅰ) Rentrop计分、缺血区血管计数、ANG蛋白表达高于其余两组;荧光显微镜下可见大量标记CM-DiI的移植细胞,而未转染组(组Ⅱ),其移植细胞成活的数量远较组Ⅰ少。这些结果提示转染Ad-ANG的MSCs可以分泌较高水平的ANG,能更好地促进局部血管新生,改善局部内环境,从而提高移植细胞的成活率,促进和改善心功能。
我们前期曾应用腺病毒介导的血管内皮生长因子(VEGF)进行类似实验[19]。VEGF能够较强烈地促进血管内皮细胞生长并诱导血管形成,但常使血管通透性增高;ANG能对内皮细胞起作用,还能刺激血管平滑肌细胞及成纤维细胞增生,因此可能作用更强大。本实验虽未对ANG和VEGF进行比较,但我们观察发现ANG的促血管生成作用等同或超过VEGF的作用。
综上所述,将Ad-ANG转染MSCs并移植至缺血区心肌,不仅能通过MSCs细胞在局部产生促血管新生的ANG蛋白,改善局部血供,挽救缺血区受到损害的心肌细胞,提高移植细胞的成活率,而且移植的MSCs具有多向分化潜能,能分化成不同细胞类型,替代缺血坏死的心肌组织细胞。这种方法的两种效果在治疗缺血性心脏病中可达到协同和叠加作用,加之自体MSCs易获取、扩增且不具有免疫原性,因此应用转染Ad-ANG的MSCs移植治疗缺血性心脏病具有明确的优越性和良好的临床应用前景。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Williams A R,Trachtenberg B,Velazquez D L,McNiece I,Altman P,Rouy D,et al. Intramyocardial stem cell injection in patients with ischemic cardiomyopathy: functional recovery and reverse remodeling[J].Circ Res,2011,108:792-796. |
| [2] | Karpov A A,Uspenskaya Y K,Minasian S M,Puzanov M V,Dmitrieva R I,Bilibina A A,et al.The effect of bone marrow- and adipose tissue-derived mesenchymal stem cell transplantation on myocardial remodelling in the rat model of ischaemic heart failure[J].Int J Exp Pathol,2013,94:169-177. |
| [3] | 黄盛东,董书强,张宝仁,梅 举,李白翎.人血管生长素衍生物的重组腺病毒制备[J].第二军医大学学报,2000,21:420-422. |
| [4] | Zeng B,Lin G,Ren X,Zhang Y,Chen H.Over-expression of HO-1 on mesenchymal stem cells promotes angiogenesis and improves myocardial function in infarcted myocardium[J].J Biomed Sci,2010,17:80. |
| [5] | Balci B,Yilmaz O.Extent of coronary collateral vessel decrease with advanced age[J].Acta Cardiol,2004,59:431-434. |
| [6] | Habib M,Shapira-Schweitzer K,Caspi O,Gepstein A,Arbel G,Aronson D,et al.A combined cell therapy and in-situ tissue-engineering approach for myocardial repair[J].Biomaterials,2011,32:7514-7523. |
| [7] | Mauritz C,Martens A,Rojas S V,Schnick T,Rathert C,Schecker N,et al.Induced pluripotent stem cell (iPSC)-derived Flk-1 progenitor cells engraft,differentiate,and improve heart function in a mouse model of acute myocardial infarction[J].Eur Heart J,2011,32:2634-2641. |
| [8] | Rajasingh J,Thangavel J,Siddiqui M R,Gomes I,Gao X P,Kishore R,et al.Improvement of cardiac function in mouse myocardial infarction after transplantation of epigenetically-modified bone marrow progenitor cells[J].PLoS One,2011,6:e22550. |
| [9] | Park J H,Yoon J Y,Ko S M,Jin S A,Kim J H,Cho C H,et al.Endothelial progenitor cell transplantation decreases lymphangiogenesis and adverse myocardial remodeling in a mouse model of acute myocardial infarction[J].Exp Mol Med,2011,43:479-485. |
| [10] | Picichè M,Fadel E,Kingma J G Jr,Dagenais F,Robillard J,Simard D,et al.Blood flow to the heart from noncoronary arteries: an intriguing but challenging research field[J].Cardiovasc Revasc Med,2012,13:25-29. |
| [11] | Lassaletta A D,Chu L M,Robich M P,Elmadhun N Y,Feng J,Burgess T A,et al.Overfed Ossabaw swine with early stage metabolic syndrome have normal coronary collateral development in response to chronic ischemia[J].Basic Res Cardiol,2012,107:243. |
| [12] | Loffredo F S,Steinhauser M L,Gannon J,Lee R T.Bone marrow-derived cell therapy stimulates endogenous cardiomyocyte progenitors and promotes cardiac repair[J].Cell Stem Cell,2011,8:389-398. |
| [13] | Pizzo E,Sarcinelli C,Sheng J,Fusco S,Formiggini F,Netti P,et al.Ribonuclease/angiogenin inhibitor 1 regulates stress-induced subcellular localization of angiogenin and controls its growth and survival activities[J].J Cell Sci,2013,126(Pt 18):4308-4319. |
| [14] | Kendall A C,Whatmore J L,Harries L W,Winyard P G,Smerdon G R,Eggleton P.Changes in inflammatory gene expression induced by hyperbaric oxygen treatment in human endothelial cells under chronic wound conditions[J].Exp Cell Res,2012,318: 207-216. |
| [15] | Jang S H,Song H D,Kang D K,Chang S I,Kim M K,Cho K H,et al.Role of the surface loop on the structure and biological activity of angiogenin[J].BMB Rep,2009,42:829-833. |
| [16] | Trouillon R,Kang D K,Park H,Chang S I,O’Hare D.Angiogenin induces nitric oxide synthesis in endothelial cells through PI-3 and Akt kinases[J].Biochemistry,2010,49:3282-3288. |
| [17] | Hu K X,Wang M H,Fan C,Wang L,Guo M,Ai H S.CM-DiI labeled mesenchymal stem cells homed to thymus inducing immune recovery of mice after haploidentical bone marrow transplantation[J].Int Immunopharmacol,2011,11:1265-1270. |
| [18] | Tang T,Wu M,Yang J.Transplantation of MSCs transfected with SHH gene ameliorates cardiac dysfunction after chronic myocardial infarction[J].Int J Cardiol,2013,168:4997-4999. |
| [19] | 徐驯宇,黄盛东,陆方林,崔 勇,鲍春荣,张宝仁,等.Ad VEGF转染自体骨髓基质细胞移植治疗猪慢性缺血性心脏病[J].第二军医大学学报,2005,26:381-385. |
 2014, Vol. 35
2014, Vol. 35


