2. 上海交通大学医学院附属第六人民医院四肢显微外科研究所, 上海 200233;
3. 上海交通大学医学院附属第六人民医院神经外科, 上海 200233
2. Institute for Microsurgery of Extremities, the Sixth People's Hospital of Shanghai, Shanghai Jiaotong University School of Medicine, Shanghai 200233, China;
3. Department of Neurosurgery, the Sixth People's Hospital of Shanghai, Shanghai Jiaotong University School of Medicine, Shanghai 200233, China
外泌体(exosome)是由细胞经过“内吞-融合-外排”等一系列调控过程而形成,并可分泌至胞外的分子直径为40~100 nm的亚细胞双层膜囊泡,其内含有与细胞来源相关的蛋白质、miRNA及mRNA等物质[1]。外泌体既可以通过质膜受体直接激活受体细胞,也可以转运蛋白质、mRNA、miRNA甚至细胞器进入受体细胞内,同时也可以携带处于不同病理状态下的细胞所含有的特异性物质,从而在生理学和病理学上都发挥着重要作用[2,3]。干细胞来源的外泌体由于含有20S蛋白酶体、合成ATP所需要的各种酶、调控血管再生的miRNAs及血管内皮生长因子等物质,在抗缺血再灌注损伤、促进血管再生及缺血器官功能恢复中具有重要作用[4,5];而肾纤维化患者尿液中提取的外泌体内CD2AP mRNA含量较正常者低,可以作为早期发现肾病的一种非侵袭性检测方法[2];此外,外泌体可以携带并传递病毒进入受体细胞,这有利于病毒在细胞间的传播[6]。
外泌体不仅具有治疗功能,也具有疾病的诊断功能,因此找到一种快速分离外泌体的方法显得尤为重要。由于外泌体直径为40~100 nm,相对分子质量过小,难以用普通方法将其提取出来。目前所用的提取方法主要包括超速离心法、免疫磁珠法和液相色谱法。超高速离心机由于造价昂贵,普及率低,并且离心耗时较长,限制了超速离心法在普通实验室对外泌体的快速提取研究;免疫磁珠法和液相色谱法同样存在着效率低、难以广泛普及的问题。基于外泌体的大小,我们利用旋转超滤技术快速、大批量地从骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的培养上清液中分离出外泌体,为今后外泌体的基础实验研究与临床应用提供了一条新的获取途径。 1 材料和方法 1.1 细胞、试剂和仪器
BMSCs原代细胞由本课题组提取[7];人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自美国ATCC;α-MEM基础培养基、BCA蛋白分析试剂盒、SuperSignal West Femto化学发光底物购自美国Thermo公司;M-200基础培养基、低血清生长添加剂(LSGS)、胎牛血清(FBS)购自美国Gibco公司;兔抗人CD9、CD63单克隆抗体及辣根过氧化物酶标记的羊抗兔IgG购自英国 Abcam公司;Model 8050旋转超滤仪、100 000 NWCO超滤膜、0.22 μm过滤器购自美国Millipore公司;CCK-8试剂盒购自日本同仁化学研究所;酶联免疫检测仪购自美国Bio-Rad公司;H-7650透射电子显微镜为日本Hitachi公司生产;Centrifuge 5417R低温高速离心机为德国Eppendorf公司生产。
1.2 BMSCs的培养使用含10% FBS的α-MEM培养液培养BMSCs,待细胞融合至90%~95%后进行传代,第3代以后的细胞可用于外泌体的提取。待细胞融合达70%时,用0.01 mol/L磷酸盐缓冲液(PBS)冲洗3次并更换培养液,孵育48 h后,收集细胞上清液,-80℃保存备用。
1.3 外泌体的提取将收集到的细胞上清液约100 mL分装于2个50 mL离心管中,4℃ 300×g离心10 min除去残余细胞,2 000×g离心20 min除去细胞碎片,小心收集上清并用0.22 μm孔径过滤器进行过滤。将收集到的上清液加入装有100 000 NWCO超滤膜的Model 8050旋转超滤仪中,接通氮气并将最大进气压力控制在517.125 kPa以下,打开磁力搅拌器,使涡漩高度为液体高度的1/3。待上清液超滤完毕后,加入50 mL PBS并再次超滤,重复3次。超滤完毕后,用0.5 mL PBS悬浮超滤膜上的外泌体,并转移至1.5 mL的Eppendorf管中,-80℃冰箱中保存备用。
1.4 外泌体的形态特征观察取外泌体悬液20 μL滴于孔径2 nm的载样铜网上,室温下静置3 min,用滤纸从滤网侧边吸干液体,滴加3%磷钨酸溶液30 μL,室温环境下负染5 min,用滤纸吸干负染液,并在室温下干燥后,将此铜网置于透射电镜的样品室内,观察外泌体形态并拍摄电镜照片。
1.5 外泌体的总蛋白定量测定使用BCA法对外泌体蛋白进行定量。配制蛋白标准品浓度梯度,拟合标准曲线方程。取20 μL样品稀释5倍,并设3个复孔,测定光密度(D)值,根据标准曲线方程和稀释倍数计算实际样品蛋白浓度。
1.6 外泌体特异性蛋白的分析配制15%分离胶和5%浓缩胶,取外泌体悬液40 μL与5×SDS上样缓冲液10 μL混合煮沸5 min,加于凝胶上样孔内,浓缩胶恒压80 V,分离胶恒压120 V,200 mA恒流1 h。将凝胶中的蛋白质通过湿转法转移至硝酸纤维素膜上,室温下用含5%脱脂牛奶的封闭液封闭处理1 h,经1×TBST缓冲液洗脱后,加入CD9、CD63单克隆抗体于4℃条件下反应过夜,再次洗脱后,加入辣根过氧化物酶标记的羊抗兔二抗,于室温下平缓摇动1 h。经1×TBST缓冲液洗膜3次后,用化学发光底物进行检测。
1.7 外泌体生物活性鉴定使用CCK-8试剂盒检测外泌体对HUVECs增殖活性的影响。取第3代对数生长期的HUVECs按每孔3 000个细胞接种到96孔板内,每孔细胞悬液量为 100 μL,复种3孔,同时设立空白对照孔(加培养液100 μL)。使用含LSGS的M-200培养液培养12 h使其同步化后,弃去培养液,每孔内加入100 μL含LSGS的M-200培养液及10 μL CCK-8溶液,孵育3 h后使用酶联免疫检测仪在450 nm处测定D450值。随后分别使用含有浓度为0、5、10、20、200 μg/mL外泌体的含LSGS的M-200培养液培养细胞,于培养后1、3 d以同样的方法测定D450值。以D450值的平均值为纵坐标,孵育时间(d)为横坐标,绘制细胞增殖曲线。
2 结 果 2.1 外泌体的形态
透射电镜下可见,BMSCs来源的外泌体为大小均匀、形态一致的圆形或椭圆形膜性小囊泡,直径均为100 nm左右。染色后可见囊泡有完整的包膜,其内有低电子致密物(图1)。
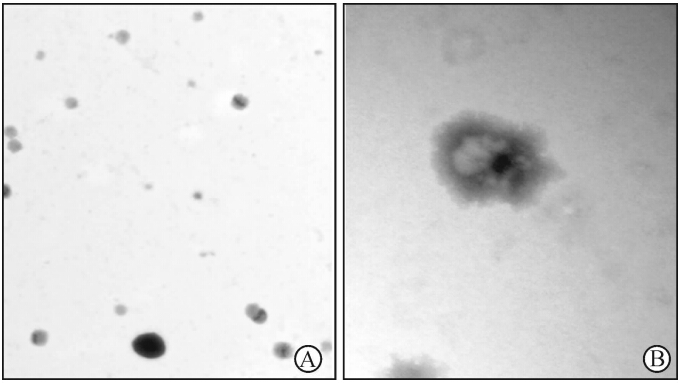 | 图 1 BMSCs来源外泌体的超微结构Fig 1 Ultrastructure of BMSCs-derived exosomeBMSCs:Bone marrow mesenchymal stem cells. Original magnification:×40 000 (A);×200 000 (B) |
使用BCA法定量外泌体总蛋白,测得样品蛋白浓度约为(370.0±12.5) μg/mL。每106个BMSCs的细胞上清液中平均能提取约7.2 μg外泌体。
2.3 CD9、CD63蛋白在外泌体中的表达蛋白质免疫印迹法检测结果显示,BMSCs来源的外泌体表达CD9、CD63蛋白(图2)。该结果进一步证实了BMSCs外泌体的存在。
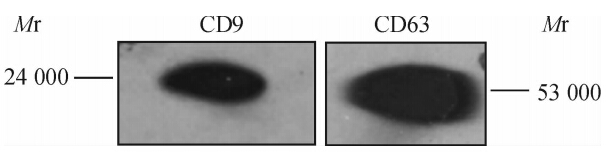 | 图 2 CD9、CD63蛋白在BMSCs来源外泌体中的表达Fig 2 Expression of CD9 and CD63 protein in BMSCs-derived exosome as detected by Western blotting analysis BMSCs: Bone marrow mesenchymal stem cells |
CCK-8法检测结果显示,培养1、3 d时,通过旋转超滤方法提取的外泌体能提高HUVECs的体外增殖能力,在0~200 μg/mL外泌体浓度范围内,外泌体浓度越高,HUVECs的增殖能力越强(图3)。说明旋转超滤法能提取到有生物学功能的外泌体,外泌体中含有的某些物质具有促进细胞增殖的作用。
 | 图 3 不同浓度BMSCs来源外泌体对HUVECs增殖作用的影响Fig 3 Effect of BMSCs-derived exosome (different concentrations) on proliferation of HUVECs BMSCs:Bone marrow mesenchymal stem cells; HUVECs:Human umbilical vein endothelial cells |
旋转超滤技术分离外泌体是利用超滤膜孔径的大小对不同相对分子质量的物质进行允许及拦截的原理,将溶剂及部分小分子物质过滤到膜的另一侧,而将大于膜孔径的高相对分子质量物质截留在超滤膜上,从而达到分离的目的,与离心超滤分离外泌体的原理相似。不同的是,离心超滤是利用离心力将溶剂及小分子溶质分离出去,仍然需要在100 000×g条件下离心1~2 h来获得外泌体[8]。而本研究所介绍的方法是通过氮气产生的压力将细胞上清液经100 000 NWCO滤膜过滤而得到外泌体,使用PBS多次冲洗以最大限度减少培养液中蛋白质的污染,分离100 mL培养液中的外泌体,整个过程一般只需要1 h。而传统的差速离心技术是将细胞上清液依次在300×g、2 000×g、20 000×g条件下除去残余细胞及细胞碎片,最后经100 000×g超速离心1~2 h得到外泌体,由于离心后外泌体聚集成块,不利于后期的实验研究。研究发现使用超速离心法从106个BMSCs的细胞上清液中可提取约5.62 μg外泌体[9],而我们使用旋转超滤法从每106个BMSCs的细胞上清液中平均能提取约7.2 μg的外泌体,这说明旋转超滤法能够获得等同于甚至较超速离心更多的外泌体。尽管不同种类的细胞及不同生长状态的细胞分泌的外泌体量会有差异,但是超速离心需要100 000×g离心力,这会产生巨大压力,可能会损伤部分外泌体;而旋转超滤法仅仅需要最高517.125 kPa的压力,可大大减少由于压力过大引起的外泌体破裂,这可能也是旋转超滤法能够提高外泌体提取量的一个原因。
根据所选择滤器直径的不同,旋转超滤仪价格在4 000~10 000元不等,使用的压力来源与高纯氮气在一般研究机构都有配备,因此并不需要特别高昂的设备。这相对于超速离心机的高昂价格和低普及率具有明显的优势,有利于普通实验室开展外泌体的研究。其他提取方法如免疫磁珠法,由于它是利用外泌体膜表面特异性表达的蛋白质,依靠受体配体结合的原理,通过人为增加外泌体的相对分子质量而将其分离出来,尽管它不需要利用超速离心机,但是由于不同种细胞分泌的外泌体含有不同的特异性表面蛋白,这使得它不能普遍应用于所有外泌体的提取,同时存在试剂价格昂贵的问题[10]。而液相色谱技术虽然获取外泌体的纯度较高,但是获取量少,并且由于需要特殊的设备也限制了它的广泛应用[11]。由于外泌体直径为40~100 nm,具有普遍性,而旋转超滤技术是根据外泌体直径大小来进行分离提取,因此和超速离心一样也具有应用的普遍性。
研究发现最容易与外泌体混淆的就是脱落微泡(shedding vesicles or microparticles),它是一群直径在100~1 000 nm之间、电子显微镜下形态各异、不具有明显的圆形及椭圆形结构的膜状囊泡,它通过出芽方式由细胞产生,其质膜表面富含β1-整合蛋白,内部含有多种蛋白水解酶,也可以在细胞间承担转运物质的作用。但是它的产生与作用方式与外泌体皆不同,外泌体的产生是细胞通过内吞作用将各种蛋白质及miRNA等物质包裹进入质膜内形成内吞小体,内吞小体彼此融合后形成早期核内体[12],之后的转运必须由内吞体分选复合物(ESCRT)-0识别并隔绝早期核内体上的遍在蛋白化蛋白质,位于结合位点上游的ESCRT-Ⅰ和Ⅱ共同作用使质膜变形并向内形成出芽小泡,最后在ESCRT-Ⅲ的剪切作用下与核内体质膜分离[13]。出芽小泡的形成意味着早期核内体逐渐成熟为晚期核内体,即多泡体。多泡体膜与细胞膜融合后将大量质膜包裹的直径50~80 nm的微泡释放到细胞外环境中,这些被释放进入细胞外环境中的微泡即为外泌体[14](图4)。而脱落微泡是由细胞膜直接向外突出,直接包裹细胞质形成的微小囊泡。外泌体是细胞通过胞吞的方式包裹进入,最后外泌体膜与内吞小体膜融合后释放内部物质发挥生物学功能,而脱落微泡则是通过微泡膜直接与细胞膜融合后将物质释放进入细胞[15,16]。我们使用旋转超滤方法前经过0.22 μm滤器过滤,排除了直径220 nm及以上的微泡,但是不能够排除直径100~220 nm的微泡,而传统的超速离心方法同样也存在这个问题的困扰。我们提取的微泡直径约100 nm,表达外泌体特异性表面标记物CD63和CD9,并且具有促进HUVECs增殖的作用,说明旋转超滤法能够从细胞培养液中提取具有生物学活性的外泌体。但若要彻底排除一些微泡的干扰,还需进一步纯化。
 | 图 4 外泌体形成模式图Fig 4 Generation of exosomes After endocytosis,plasma membrane wraps protein,mRNA,and miRNA fuse into endosomes,maturation of the endosome leads to the individualization of a multivesicular body containing intraluminal vesicles,the multivesicular body can fuse with the plasma membrane and release intraluminal vesicles into extracellular milieu. Once in the extracellular milieu,the intraluminal vesicles are referred to as exosome |
外泌体在开放系统中暴露的时间越长,能够分离得到的外泌体量也就越少。因此不管是基础实验研究还是临床疾病诊断,快速获得高质量、低污染的外泌体是研究其功能、内容物及作用机制的一个重要前提。利用旋转超滤法提取外泌体具有便捷、快速、高效等优点,所使用的旋转超滤仪价格便宜,可以很好地普及使用,为研究外泌体提供了较好的技术支持。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Sokolova V,Ludwig A K,Hornung S,Rotan O,Horn P A,Epple M,et al.Characterisation of exosomes derived from human cells by nanoparticle tracking analysis and scanning electron microscopy[J].Colloids Surf B Biointerfaces,2011,87:146-150. |
| [2] | Lv L L,Cao Y H,Pan M M,Liu H,Tang R N,Ma K L,et al.CD2AP mRNA in urinary exosome as biomarker of kidney disease[J].Clin Chim Acta,2014,428:26-31. |
| [3] | Tetta C,Bruno S,Fonsato V,Deregibus M C,Camussi G.The role of microvesicles in tissue repair[J].Organogenesis,2011,7:105-115. |
| [4] | Lai R C,Yeo R W,Tan K H,Lim S K.Mesenchymal stem cell exosome ameliorates reperfusion injury through proteomic complementation[J].Regen Med,2013,8:197-209. |
| [5] | Zhu W,Huang L,Li Y,Zhang X,Gu J,Yan Y,et al.Exosomes derived from human bone marrow mesenchymal stem cells promote tumor growth in vivo[J].Cancer Lett,2012,315:28-37. |
| [6] | Ramakrishnaiah V,Thumann C,Fofana I,Habersetzer F,Pan Q,de Ruiter P E,et al.Exosome-mediated transmission of hepatitis C virus between human hepatoma Huh7.5 cells[J].Proc Natl Acad Sci USA,2013,110:13109-13113. |
| [7] | Guo F,Lv S,Lou Y,Tu W,Liao W,Wang Y,et al.Bone marrow stromal cells enhance the angiogenesis in ischaemic cortex after stroke:involvement of notch signalling[J].Cell Biol Int,2012,36:997-1004. |
| [8] | Zhang L,Wu X,Luo C,Chen X,Yang L,Tao J,et al.The 786-0 renal cancer cell-derived exosomes promote angiogenesis by downregulating the expression of hepatocyte cell adhesion molecule[J].Mol Med Rep,2013,8:272-276. |
| [9] | Bian S,Zhang L,Duan L,Wang X,Min Y,Yu H.Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model[J].J Mol Med (Berl),2014,92:387-397. |
| [10] | Tauro B J,Greening D W,Mathias R A,Ji H, Mathivanan S,Scott A M,et al.Comparison of ultracentrifugation,density gradient separation,and immunoaffinity capture methods for isolating human colon cancer cell line LIM1863-derived exosomes[J].Methods,2012,56:293-304. |
| [11] | Chen T S,Arslan F,Yin Y,Tan S S,Lai R C,Choo A,et al.Enabling a robust scalable manufacturing process for therapeutic exosomes through oncogenic immortalization of human ESC-derived MSCs[J].J Transl Med,2011,9:47. |
| [12] | Raposo G,Stoorvogel W.Extracellular vesicles: exosomes,microvesicles,and friends[J].J Cell Biol,2013,200:373-383. |
| [13] | Raposo G,Stoorvogel W.Extracellular vesicles: exosomes,microvesicles,and friends[J].J Cell Biol,2013,200:373-383. |
| [14] | Colombo M,Moita C,van Niel G,Kowal J,Vigneron J,Benaroch P,et al.Analysis of ESCRT functions in exosome biogenesis,composition and secretion highlights the heterogeneity of extracellular vesicles [J].J Cell Sci,2013,126(Pt 24):5553-5565. |
| [15] | Cocucci E,Racchetti G,Meldolesi J.Shedding microvesicles:artefacts no more[J].Trends Cell Biol,2009,19:43-51. |
| [16] | Sabin K,Kikyo N.Microvesicles as mediators of tissue regeneration[J].Transl Res,2014,163:286-295. |
 2014, Vol. 35
2014, Vol. 35


