2. 第三军医大学新桥医院骨科, 重庆 400037
2. Department of Orthopaedics, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
骨关节炎(osteoarthritis,OA)是多因素所致的软骨退行性病变,疼痛和畸形严重影响了患者的生活质量,目前原因仍不清楚。在骨骼系统,miRNA在蛋白翻译水平精细调控软骨细胞的分化,深刻影响软骨的生长发育[1, 2]。目前研究发现miRNA-140在晚期OA软骨细胞中表达显著降低[2],但其在早期OA中的表达以及作用尚不清楚。本研究拟观察早期OA软骨细胞miRNA-140的表达规律以及转染外源性双链miRNA-140(ds-miRNA-140)对软骨细胞功能的影响。
1 材料和方法
1.1 动物模型
成年新西兰大白兔20只,雌雄比为1∶1,购自重庆市渝达实验兔场,许可证号: SCXK(渝)2007-0009。 参照Pickarski等[3]的前交叉韧带切断术(anterior cruciate ligament transection,ACLT)方法,制作成年兔OA模型:动物麻醉后右膝关节周围用电动剃刀剪毛,碘伏消毒,做髌骨内侧小切口,将髌骨外翻并屈曲膝关节,显露出前交叉韧带,用眼科剪将其切断,冲洗关节,闭合关节囊和皮肤,肌注抗生素1次。动物自由活动,分笼饲养。以兔右膝关节为实验侧,左膝为正常对照侧,设定模型建立后4周右膝为B组(n=10),8周右膝为C组(n=10),左膝自身对照为A组(n=10)。 1.2 细胞培养
兔处死后无菌条件下切开关节收集关节软骨,收集的软骨组织切成1~2 mm3大小的碎片,室温下分别用0.2%胰蛋白酶和0.2%Ⅱ型胶原酶消化30 min和2 h,将获得的细胞在含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM/F12培养液中培养。原代细胞单层培养。 1.3 软骨细胞转染ds-miR-140
采用ds-miR-140序列模拟内源性miR-140。先合成2条RNA寡核苷酸序列5′-CAG UGG UUU UAC CCU AUG GUA G-3′和 5′-ACC ACA GGG UAG AAC CAC GGA C-3′,退火后获得ds-miR-140(由上海吉玛生物公司合成)。按照Lipofectamine 2000(Invitrogen)操作手册进行细胞转染,每次实验使用相同浓度的Silencer Negative Control #1 small interfering RNA (Ambion)转染作为对照。 1.4 实时定量PCR检测miRNA和mRNA的表达
根据TRIzol试剂盒(北京博凌科为生物科技有限公司)说明书提取软骨细胞总RNA。miRNA的检测:取25 ng总RNA,使用茎环结构反转录引物5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACC TAC CA-3′进行反转录反应,然后95℃孵育10 min使反转录酶失活。实时定量PCR在7500 Real-time PCR System (Applied Biosystems,美国)中进行,mi-RNA-140检测的上游引物为5′-GCC TCA GTG GTT TTA CCC TA-3′,下游引物为5′-GTG CAG GGT CCG AGG T-3′。
Ⅱ型胶原蛋白(Col2a1)、金属蛋白酶13(MMP-13) mRNA的检测:应用Readyto-Go You-Prime First-Strand Beads (GE Healthcare,英国)试剂盒将总RNA反转录成cDNA。使用TaqMan Gene Expression Assay进行实时定量PCR分析,Col2a1探针为Hs00164004_m1,MMP-13探针为Hs00233992_m1。以U18和GAPDH基因作为内参对照。Col2a1引物序列:5′-TCC TAA GGG TGC CAA TGG TGA-3′ (上游),5′-AGG ACC AAC TTT GCC TTG AGG AC-3′(下游);MMP-13引物序列:5′-TCC CAG GAA AAT AGC TGA GAA CTT-3′(上游),5′-AAA CCC AAA TGC TTC AAA GAC AG-3′(下游);GAPDH引物序列:5′-GCA CCG TCA AGG CTG AGA AC-3′(上游),5′-TGG TGA AGA CGC CAG TGG A-3′(下游);U18引物序列: 5′-GCA GTC CGC ACA CAG TAT CTG ACG ATA GCA-3′ (上游),5′-GCG AGC TCG TCC AAC CGA ATA TA-3′ (下游)。 1.5 蛋白质印迹检测Col2a1和MMP-13蛋白表达
用PBS漂洗软骨细胞,加入适量预冷的细胞裂解液,收集蛋白裂解液至EP管中,超声裂解后,4℃ 2 920×g离心20 min,收集上清。BCA法测定蛋白浓度后,取等量总蛋白(约80 μg)的样品,加入上样缓冲液混匀后100℃变性10 min,上样进行10% SDS-PAGE。电泳结束后使用Bio-Rad Mini湿式转移电泳槽以恒流200 mA转膜2 h至PVDF膜,5%脱脂奶粉(0.1% TBST配制)室温封闭3 h,TBST漂洗3次后加入一抗(Col2a1大鼠抗兔单克隆抗体1∶500,MMP-13大鼠抗兔单克隆抗体1∶500,PIERCE公司),4℃孵育过夜。TBST漂洗3次后,加辣根过氧化物酶标记的二抗,室温孵育1 h,TBST漂洗3次,ECL显影。以β-actin作为内参对照。 1.6 统计学处理
采用SPSS 13. 0软件进行统计学分析,数据用 x±s表示,组间比较采用t检验,检验水准(α)为0.05。 2 结 果 2.1 OA关节软骨细胞miRNA-140的表达变化
由图 1可见,早期OA关节软骨细胞miRNA-140的表达显著减少,4周(B组)时,下降到正常值(A组)的63%,8周(C组)下降到57%,B、C组和A组比较差异有统计学意义(P<0.01),B组和C组之间比较差异无统计学意义(P>0.05)。
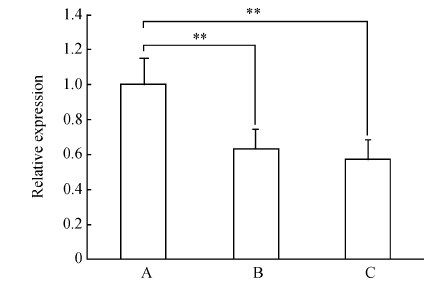 |
图 1各组软骨细胞miRNA-140的表达(定时定量PCR) Figure 1Expressions of miRNA-140 in chondrocytes of each groups as detected by real-time quantitation PCR |
由图 2可见,B组细胞Col2a1 mRNA的表达量与A组比较降低了52%,C组与A组比较降低了63%,B组、C组和A组比较差异均有统计学意义(P<0.01),B组和C组之间差异无统计学意义(P>0.05)。A、B、C 3组细胞转染ds-miRNA-140后,A组Col2a1 mRNA的表达未发生明显变化,B组转染后Col2a1 mRNA的表达增加了60%,C组转染后Col2a1 mRNA的表达增加了127%,B、C两组与转染前相比差异均有统计学意义(P<0.01),而B组与C组转染后Col2a1 mRNA的表达差异无统计学意义(P>0.05)。
正常关节软骨细胞(A组)Col2a1蛋白表达较多,转染ds-miR-140前后差异不大;OA关节软骨细胞(B、C组)Col2a1蛋白表达减少,但在转染ds-miR-140后表达增加明显(图 3)。
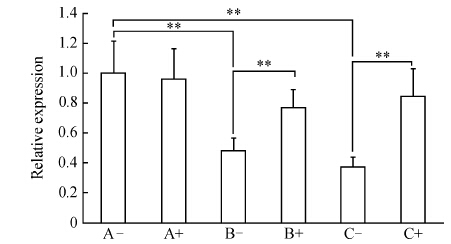 |
图 2各组软骨细胞col2a1 mRNA的表达(定时定量PCR) Figure 2Expressions of col2a1 mRNA in chondrocytes of each groups as detected by real-time quantitation PCR |
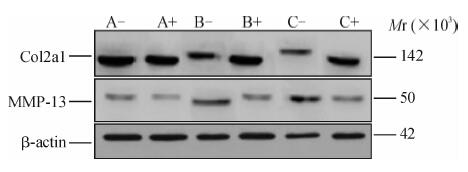 |
图 3各组软骨细胞MMP-13和col2al蛋白的表达(蛋白质印记分析) Figure 3NMP-13 and col2al protein Expressions in chondrocytes of each groups as detected by Western blotting analysis |
由图 4可见,B组细胞MMP-13 mRNA的表达量和A组比较增加了3.01倍,C组和A组比较增加了4.15倍,B组、C组和A组比较差异均有统计学意义(P<0.01),B组和C组之间差异无统计学意义(P>0.05)。A、B、C 3组细胞转染ds-miRNA-140后,A组MMP-13 mRNA的表达未发生明显变化,B组转染后MMP-13 mRNA的表达是转染前的54.53%,C组转染后MMP-13 mRNA的表达是转染前的42.61%,B、C两组与转染前相比差异均有统计学意义(P<0.01),而B组与C组转染后MMP-13 mRNA的表达差异无统计学意义(P>0.05)。
正常关节软骨细胞(A组)MMP-13蛋白表达量较低,转染ds-miR-140后MMP-13蛋白表达变化不大;B组和C组在转染前MMP-13蛋白表达丰富,尤其C组丰度更大,转染ds-miR-140后B组和C组MMP-13蛋白表达显著降低,接近A组丰度(图 3)。
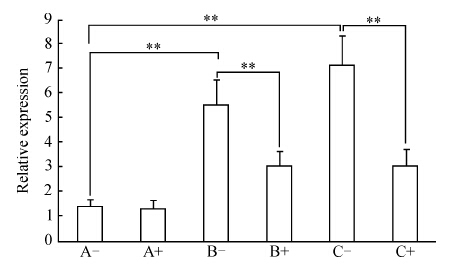 |
图 4各组软骨细胞NMP-13 mRNA表达(定时定量PCR) Figure 4Expressions of NMP-13 mRNA in chondrocytes of each groups as detected by real-time quantitation PCR |
OA的发病原因尚不清楚,OA软骨细胞中miRNA的异常变化引起了广泛关注[4, 5, 6, 7],了解其机制将为更深入地研究OA的发病原因提供新的思路。miRNA-140是胚胎软骨发育期仅在软骨组织中表达的一种miRNA[8, 9, 10, 11, 12, 13, 14],随着软骨细胞分化发育成熟,细胞内miRNA-140表达也增强,研究表明正常关节软骨细胞中miRNA-140的表达比骨髓基质干细胞(MSCs)高2倍以上[9]。缺乏miRNA-140的小鼠出生后骨骼发育畸形,关节软骨细胞凋亡[9, 12]。而敲除miRNA-140基因,关节软骨则很快发生老年性改变[9],所以miRNA-140是软骨细胞生长发育和功能维持最重要的miRNA之一。
研究发现晚期OA 软骨细胞内miRNA-140表达显著减少[8, 9, 10, 11],导致OA中多种降解软骨组织的酶增加,如解整链蛋白金属蛋白酶(ADAMTS5,disintegrin and metalloproteinase with thrombospondin motifs)高表达[9],最终软骨组织降解破坏。但早期OA软骨细胞miRNA-140变化情况目前不太清楚。本研究制作早期的OA关节模型,观察8周内关节软骨细胞miRNA-140的变化情况,结果显示在OA 4周时软骨细胞内miRNA-140的表达就明显下降,8周时下降更明显,提示miRNA-140在早期OA软骨细胞内即迅速降低,而且降低幅度较大,这种减少的情况和程度可能一直持续到晚期OA软骨细胞。早期OA软骨细胞中miRNA-140表达下降原因不清楚,有研究表明IL-1β和其他相关细胞因子会显著抑制miR-140的表达[9],推测生物力学、遗传、创伤、感染等因素可能会作用在一个共同的通路上造成早期OA软骨细胞内miRNA-140下降,其机制有待进一步研究。
本研究同时还观察了Col2a1和MMP-13的表达变化。Col2a1表达是软骨细胞功能的重要标志,它的下降预示关节软骨开始发生退变,而这个时候影像学表现可能没有任何改变[8]。本研究观察到OA软骨细胞中Col2a1的mRNA和蛋白表达显著降低,与文献报道晚期OA软骨细胞Col2a1基因和蛋白表达降低的程度[8]接近,显示在OA早期软骨细胞的功能即受到严重损害。MMP-13是重要的软骨基质降解酶,MMP-13的增加能加剧软骨的退变[11]。本研究观察到OA 4周和8周时软骨细胞中MMP-13的表达均显著增加,提示及早干预这种变化有利于预防早期关节炎,防止OA进一步发展,特别是在关节影像学发生改变以前干预,可以避免关节置换手术。
本研究通过转染外源性ds-miRNA-140来提高miRNA-140的表达,发现OA早期软骨细胞Col2a1的基因和蛋白表达在4周时均得到增加,到8周时略有增加,但增加幅度不大;同时MMP-13表达显著下降,8周时几乎降低了一半。研究初步显示ds-miRNA-140在改善早期OA软骨细胞功能方面具有积极作用。
尽管miRNA-140在OA研究中展示了良好的应用前景[15],但其机制还不清楚。目前在OA软骨细胞中确认的 miR-140靶目标主要有组蛋白脱乙酰酶 (HDAC4)[16]、趋化因子配体12(CXCL12)[17]、胰岛素生长因子结合蛋白5(IGFBP5)[11]、ADAMTS-5和MMP-13[8]、 Smad3(TGFβ信号通路转录子)[11]、天冬酰胺氨肽酶(Dnpep)[12]、Sp1转录子(细胞循环调节激活剂P15INK4b )[18]、血小板源性生长因子A(PDGF-A)[19]等。这些靶目标是软骨细胞表型相关的重要因子。miRNA-140也会影响重要信号通路Bmp2(小鼠)和BMP2(人)[8, 13],Nakamura等[12]在miRNA-140基因缺失小鼠实验中证实miRNA-140可作用于Dnpep,进而抑制BMP信号通路,保持软骨细胞分化。
MMP-13是软骨细胞最重要的基质降解酶之一,是miRNA-140的直接靶目标,miRNA-140在MMP-13 mRNA的3′端有结合位点,负向调节MMP-13的表达,改善人C28/I2软骨细胞的炎症程度[20]。本研究中转染外源性ds-miRNA-140出现MMP-13表达显著下降可能是miRNA-140直接作用在MMP-13 mRNA的结果,但转染ds-miRNA-140后,Col2a1升高的机制有待研究。Col2a1并不是miRNA-140的直接靶目标,miRNA-140表达受Sox9(transcription factor SRY-box-containing gene 9)调控,Sox9是miRNA-140的主要上游调控子[15, 21],其家族中的L-Sox5和Sox6辅助调节Sox9[19, 22]。Sox9蛋白与Col2a1的第一个内含子中的特异性序列结合,影响Col2a1表达。Sox9上游的调节因素很多,其中Wnt/β-catenin信号通路和Sox9关系最为密切,是Sox9上游的重要调控开关[18],该信号通路激活会强烈抑制Sox9表达,所以我们设想研究中转染ds-miRNA-140后Col2a1升高的现象不是miRNA-140直接作用的结果,而是miRNA-140抑制了Wnt/β-catenin信号通路,解除了对Sox9的抑制后Sox9表达增加所致。
脱靶效应是miRNA-140研究中需要考虑的一个重要问题,miRNA-140的靶基因很多,现发现有574个,其中保守靶基因有55个,而非保守基因则高达519个[13],ds-miRNA-140的脱靶效应mRNA可能会更多[23]。
Miyaki和Nicolas等[8, 13]认为miRNA-140影响骨形态形成蛋白(bone morphogenetis protein,BMP)2信号通路。miRNA-140、miRNA-675受Sox-9、Sox-5、Sox-6的调节,Sox-9是重要的软骨细胞外基质基因,提示miRNA-140与软骨功能关系密切[15, 22],但miRNA-140具体调控机制目前仍不太清楚,了解其复杂的调控机制是今后重要的研究内容。
除miRNA-140外,其他miRNA在OA软骨细胞中也起重要作用,沉默miRNA-34a基因可以抑制软骨细胞的凋亡[24]。miRNA-23b通过下调蛋白激酶A信号通路而促进MSCs分化为软骨细胞[25]。miRNA-27b 抑制OA软骨细胞MMP-13的表达[5]。 Martinez-Sanchez等[26]发现正常人软骨细胞中miRNA-145的增高抑制软骨细胞外基质基因(Col2a1、蛋白多糖等)以及miRNA-675、miRNA-140的表达,而RUNX2和MMP-13表达增高。 miRNA-22可调节IL-1β、BMP-7和BMP-13等的表达,抑制软骨细胞炎症反应和分解代谢[6, 27],这些miRNA在软骨细胞中组成复杂的调控网络,而miRNA-140在其中的地位有待研究。
miRNA同时精细调节多种基因的功能强于siRNA,在临床应用中也可能取得更好的效果。miRNA-140揭示了OA病因病理新的领域,明确miRNA-140在OA软骨细胞中的作用和机制,特别是其靶基因,可能为OA治疗提供新的策略与思路。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。 (志谢 本次研究工作得到美国加州大学圣迭戈分校生物工程系及Scripps骨科研究所Peter Chen 教授的大力支持,在此表示感谢!)
| [1] | Lewis B P,Burge C B,Bartel D P.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120:15-20. |
| [2] | Miyaki S,Asahara H.Macro view of microRNA function in osteoarthritis[J].Nat Rev Rheumatol,2012,8:543-552. |
| [3] | Pickarski M,Hayami T,Zhuo Y,Duong le T.Molecular changes in articular cartilage and subchondral bone in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis[J].BMC Musculoskelet Disord,2011,12:197. |
| [4] | Díaz-Prado S,Cicione C,Muios-López E,Hermida- Gómez T,Oreiro N,Fernández-López C,et al.Characterization of microRNA expression profiles in normal and osteoarthritic human chondrocytes[J].BMC Musculoskelet Disord,2012,13:144. |
| [5] | Akhtar N,Rasheed Z,Ramamurthy S,Anbazhagan A N,Voss F R,Haqqi T M.MicroRNA-27b regulates the expression of matrix metalloproteinase 13 in human osteoarthritis chondrocytes[J].Arthritis Rheum,2010,62:1361-1371. |
| [6] | Iliopoulos D,Malizos K N,Oikonomou P,Tsezou A.Integrative microRNA and proteomic approaches identify novel osteoarthritis genes and their collaborative metabolic and inflammatory networks[J].PLoS One,2008,3:e3740. |
| [7] | Zuntini M,Salvatore M,Pedrini E,Parra A,Sgariglia Fa,Magrelli A,et al.MicroRNA profiling of multiple osteochondromas: identification of disease-specific and normal cartilage signatures[J].Clin Genet,2010,78:507-516. |
| [8] | Miyaki S,Nakasa T,Otsuki S,Grogan S P,Higashiyama R,Inoue A,et al.MicroRNA-140 is expressed in differentiated human articular chondrocytes and modulates interleukin-1 responses[J].Arthritis Rheum,2009,60:2723-2730. |
| [9] | Miyaki S,Sato T,Inoue A,Otsuki S,Ito Y,Yokoyama S,et al.MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J].Genes Dev,2010,24:1173-1185. |
| [10] | Araldi E,Schipani E.MicroRNA-140 and the silencing of osteoarthritis[J].Genes Dev,2010,24:1075-1080. |
| [11] | Tardif G,Hum D,Pelletier J P,Duval N,Martel-Pelletier J.Regulation of the IGFBP-5 and MMP-13 genes by the microRNAs miR-140 and miR-27a in human osteoarthritic chondrocytes[J].BMC Musculoskelet Disord,2009,10:148. |
| [12] | Nakamura Y,Inloes J B,Katagiri T,Kobayashi T. Chondrocyte-specific microRNA-140 regulates endochondral bone development and targets Dnpep to modulate bone morphogenetic protein signaling[J].Mol Cell Biol,2011,31:3019-3028. |
| [13] | Nicolas F E,Pais H,Schwach F,Lindow M,Kauppinen S,Moulton V,et al.mRNA expression profiling reveals conserved and non-conserved miR-140 targets[J].RNA Biol,2011,8:607-615. |
| [14] | Li X,Gibson G,Kim J S,Kroin J,Xu S,van Wijnen A J,et al.MicroRNA-146a is linked to pain-related pathophysiology of osteoarthritis[J].Gene,2011,480(1-2):34-41. |
| [15] | Nakamura Y,He X,Kato H,Wakitani S,Kobayashi T,Watanabe S,et al.Sox9 is upstream of microRNA-140 in cartilage[J].Appl Biochem Biotechnol,2012,166:64-71. |
| [16] | Tuddenham L,Wheeler G,Ntounia- Fousara S,Waters J,Hajihosseini M K,Clark I,et al.The cartilage specific microRNA-140 targets histone deacetylase 4 in mouse cells[J].FEBS Lett,2006,580(1-2):4214-4217. |
| [17] | Nicolas F E,Pais H,Schwach F,Lindow M,Kauppinen S,Moulton V,et al.Experimental identification of microRNA-140 targets by silencing and overexpressing miR-140[J].RNA,2008,14:2513-2520. |
| [18] | Yang J,Qin S Y,Yi C,Ma G,Zhu H,Zhou W,et al.MiR-140 is co-expressed with Wwp2-C transcript and activated by Sox9 to target Sp1 in maintaining the chondrocyte proliferation[J].FEBS Lett,2011,585:2992-2997. |
| [19] | Eberhart J K,He X,Swartz M E,Yan Y L,Song H,Boling T C,et al.MicroRNA Mirn140 modulates Pdgf signaling during palatogenesis[J].Nat Genet,2008,40:290-298. |
| [20] | Liang Z J,Zhuang H,Wang G X,Li Z,Zhang H T,Yu T Q,et al.MiRNA-140 is a negative feedback regulator of MMP-13 in IL-1β-stimulated human articular chondrocyte C28/I2 cells[J].Inflamm Res,2012,61:503-509. |
| [21] | Oh C D,Maity S N,Lu J F,Zhang J,Liang S,Coustry F,et al.Identification of SOX9 interaction sites in the genome of chondrocytes[J].PLoS One,2010,5:e10113. |
| [22] | Yamashita S,Miyaki S,Kato Y,Yokoyama S,Sato T,Barrionuevo F,et al.L-Sox5 and Sox6 proteins enhance chondrogenic miR-140 microRNA expression by strengthening dimeric Sox9 activity[J].J Biol Chem,2012,287:22206-22215. |
| [23] | Jones S W,Watkins G,Le Good N,Roberts S,Murphy C L,Brockbank S M,et al.The identification of differentially expressed microRNA in osteoarthritic tissue that modulate the production of TNF-alpha and MMP13[J].Osteoarthritis Cartilage,2009,17:464-472. |
| [24] | Abouheif M M,Nakasa T,Shibuya H,Niimoto T, Kongcharoensombat W,Ochi M.Silencing microRNA-34a inhibits chondrocyte apoptosis in a rat osteoarthritis model in vitro[J].Rheumatology(Oxford),2010,49:2054-2060. |
| [25] | Ham O,Song B W,Lee S Y,Choi E,Cha M J,Lee C Y,et al.The role of microRNA-23b in the differentiation of MSC into chondrocyte by targeting protein kinase A signaling[J].Biomaterials,2012,33:4500-4507. |
| [26] | Martinez-Sanchez A,Dudek K A,Murphy C L.Regulation of human chondrocyte function through direct inhibition of cartilage master regulator SOX9 by micro-RNA-145 (miRNA-145)[J].J Biol Chem,2012,287:916-924. |
| [27] | Taganov K D,Boldin M P,Chang K J,Baltimore D.NFkappaB dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,103:12481-12486. |
 2014, Vol. 35
2014, Vol. 35


